黄芩素抑制高糖诱导的血管平滑肌细胞表型转化的实验研究
周 雯,唐 敏,王咸寿,冯秋芳,郑 琳,王青松
(海南医学院1.组织胚胎学教研室,2.生物技术专业实验室,3.生物化学与分子生物学教研室,海南海口571199)
我国传统中药黄芩是唇形科植物黄芩的干燥根,黄芩素是黄芩中含量最高的一种黄酮类化合物,也是黄芩的主要活性成分。研究表明,黄芩素具有清除氧自由基[1]、抗炎[2,3]、抗病毒[4]、抗肿瘤[4]及护肝[5]等广泛作用。同时,黄芩素能够抑制包括糖尿病在内的多种慢性炎症性疾病的发生和发展[1-6]。大血管病变是糖尿病的主要并发症之一,而血管平滑肌细胞从收缩型到合成型的表型转化是糖尿病大血管病发生发展的重要环节。因此,研究黄芩素在血管平滑肌细胞表型转化中的作用对于包括糖尿病在内的慢性炎症性疾病的防治具有重要意义。
1 材料与方法
1.1 材料
大鼠血管平滑肌细胞株(A10 细胞)购自ATCC细胞库。
1.2 主要试剂
黄芩素购自成都曼思特生物科技有限公司;葡萄糖、DMEM 培养基、胎牛血清购自Sigma 公司;Trizol 购自Ambion 公司;RNA 提取试剂盒、逆转录试剂盒购自TaKaRa 公司;荧光定量PCR 试剂盒购自TIANGEN 公司;PCR 引物由上海生工合成;BCA 蛋白定量试剂盒购自TaKaRa 公司;兔多抗α-SMA、鼠单抗SM22-α、鼠单抗Osteopontin(OPN)、兔多抗α-tubulin 购自武汉三鹰生物技术有限公司。
1.3 细胞培养
将大鼠血管平滑肌细胞株(A10 细胞)放置于含10% 胎牛血清的DMEM 培养基中,培养条件为5% CO2的37 ℃培养箱。细胞实验分为4 组:正常对照组(Control):5 mmol/L D-glucose 加25 mmol/L 甘露醇;黄芩素处理组(BAI):50 μg/mL 黄芩素加5 mmol/L D-glucose 加25 mmol/L 甘露醇;高糖处理组(HG):25 mmol/L D-glucose;高糖加黄芩素组(HG+BAI):50 μg/mL 黄芩素加25 mmol/L D-glucose 共4 组。
1.4 荧光定量PCR 分析α-SMA、SM22-α 和OPN mRNA 水平的改变
将黄芩素和葡萄糖处理后的细胞,加入Trizol试剂处理后,RNA 提取试剂盒提取总RNA,逆转录试剂盒获得cDNA。按照以下成分构建20 μL 反应体系:cDNA(5×稀释)4 μL,上游引物(10 μmol/L)0.4 μL,下游引物(10 μmol/L)0.4 μL,SYBR Green Master Mix 10 μL,50×ROX Reference Dye 2 试剂0.4 μL,ddH2O 4.8 μL。反应条件:50 ℃2 min,95 ℃10 min;95 ℃30 s,60 ℃30 s,40 cycles。α-SMA、SM22-α、OPN 以及β-actin 基因的引物序列表如表1 所示。以β-actin 作为内参,采用相对定量2-ΔΔCT法计算mRNA 的表达。

表1 α-SMA、SM22-α、OPN 及β-actin 基因的引物序列表Tab 1 Primers for α-SMA,SM22-α,OPN and β-actin gene sequence
1.5 Western blot 分析α-SMA、SM22-α 和OPN 蛋白水平的改变
将黄芩素和葡萄糖处理后的细胞,提取总蛋白,BCA 实验测定蛋白浓度。SDS-PAGE 电泳分离蛋白,转移到PVDF 膜上。5%脱脂牛奶封闭,一抗(1∶1 000)孵育过夜,二抗(1∶5 000)孵育1 h,ECL显影。以α-tubulin 作为内参,分析α-SMA、SM22-α、OPN 的表达改变。
1.6 统计学处理
采用SPSS 19.0 软件分析各组数据,实验数据以平均值±标准差表示。每组实验均独立重复3次,多组间数据比较采用单因素方差分析,两组间比较采用t 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 荧光定量PCR 分析α-SMA、SM22-α 和OPN mRNA 水平的改变
2.1.1 α-SMAmRNA 水平的改变 以正常对照组中的目标基因和参照基因的扩增产物比值作为标准,正常对照组α-SMA mRNA 相对表达量为1。黄芩素处理组的α-SMA mRNA 相对表达量为0.956±0.036,高糖处理组α-SMA mRNA 相对表达量为0.419±0.090,高糖加黄芩素组α-SMA mRNA相对表达量为0.699±0.079,差异具有统计学意义(F=55.08,P<0.05)。比较高糖处理组与高糖加黄芩素组,后者较前者升高66.8%。可见黄芩素能明显抑制高糖导致的α-SMA mRNA 的下调(t=4.041,P<0.05),见图1。

图1 荧光定量PCR 分析α-SMA mRNAFig 1 Real-time quantitative PCR analysis of α-SMA mRNA
2.1.2 SM22-α mRNA 水平的改变 以正常对照组中的目标基因和参照基因的扩增产物的比值作为标准,正常对照组SM22-α mRNA 相对表达量为1。黄芩素处理组的SM22-α mRNA 相对表达量为0.923±0.183,高糖处理组SM22-α mRNA 相对表达量为0.369±0.063,高糖加黄芩素组SM22-α mRNA 相对表达量为0.583±0.049,差异具有统计学意义(F=26.20,P<0.05)。比较高糖处理组与高糖加黄芩素组,后者较前者升高58.0%,表明黄芩素能明显抑制高糖导致的SM22-α mRNA 的下调(t=4.623,P<0.05),见图2。

图2 荧光定量PCR 分析SM22-α mRNAFig 2 Real-time quantitative PCR analysis of SM22-α mRNA
2.1.3 OPN mRNA 水平的改变 以正常对照组中的目标基因和参照基因的扩增产物的比值作为标准,正常对照组OPN mRNA 相对表达量为1。黄芩素处理组OPN mRNA 相对表达量为1.060±0.217,高糖处理组OPN mRNA 相对表达量为2.023±0.281,高糖加黄芩素组OPN mRNA 相对表达量为1.511±0.091,差异具有统计学意义(F=20.16,P<0.05)。比较高糖处理组与高糖加黄芩素组,后者较前者降低25.3%。表明黄芩素能明显抑制高糖导致的 OPN mRNA 的上调(t=3.007,P<0.05),见图3。
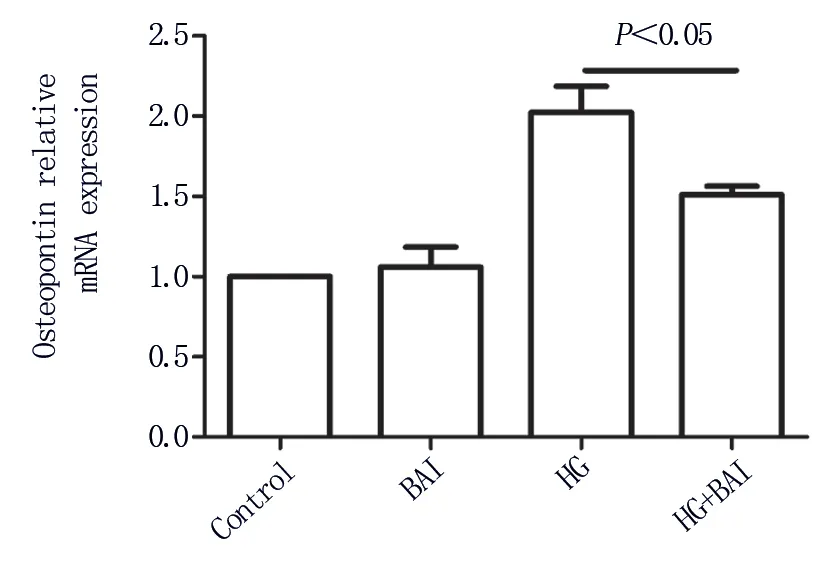
图3 荧光定量PCR 分析OPN mRNAFig 3 Real-time quantitative PCR analysis of OPN mRNA
2.2 Western blot 分析α-SMA、SM22-α 和OPN 蛋白水平的改变
以α-tubulin 作为内参,分析α-SMA、SM22-α、OPN 的表达改变。正常对照组、黄芩素处理组、高糖处理组和高糖加黄芩素组的相应蛋白Western blot分析结果如图4 所示。其中α-SMA、SM22-α、OPN和α-tubulin蛋白大小分别为42、22、60和60 kD。

图4 Western blot分析α-SMA、SM22-α和OPN 蛋白的表达Fig 4 Western blot analysis of α-SMA,SM22-α and OPN expression
2.2.1 α-SMA 蛋白水平的改变 本实验以正常对照组中的目标基因和参照基因的扩增产物的比值作为标准。正常对照组α-SMA 蛋白为0.860±0.054,黄芩素处理组α-SMA 蛋白相对表达量为0.828±0.060,高糖处理组α-SMA 蛋白相对表达量为0.213±0.034,高糖加黄芩素组α-SMA 蛋白相对表达量为0.393±0.062。单因素方差分析的方法来分析多组间α-SMA 蛋白,各组差异具有统计学意义(F=107.4,P<0.05)。比较高糖处理组与高糖加黄芩素组的相关蛋白表达,后者较前者升高84.5%。可见黄芩素能明显抑制高糖导致的α-SMA 蛋白表达的下调(t=4.411,P<0.05),见图5。

图5 Western blot 分析α-SMA 蛋白的表达Fig 5 Western blot analysis of α-SMA expression
2.2.2 SM22-α 蛋白水平的改变 本实验以正常对照组中的目标基因和参照基因的扩增产物的比值作为标准。正常对照组SM22-α 蛋白为0.760±0.054,黄芩素处理组SM22-α 蛋白相对表达量为0.728±0.042,高糖处理组SM22-α 蛋白相对表达量为0.343±0.047,高糖加黄芩素组SM22-α 蛋白相对表达量为0.486±0.051。单因素方差分析的方法来分析多组间SM22-α 蛋白水平,各组差异具有统计学意义(F=50.05,P<0.05)。比较高糖处理组与高糖加黄芩素组的相关蛋白表达,后者较前者升高41.7%。可见黄芩素能明显抑制高糖导致的SM22-α 蛋白表达的下调(t=3.557,P<0.05),见图6。

图6 Western blot 分析SM22-α 蛋白的表达Fig 6 Western blot analysis of SM22-α expression
2.2.3 OPN 蛋白水平的改变 本实验以正常对照组中的目标基因和参照基因的扩增产物的比值作为标准。正常对照组OPN 蛋白为0.260±0.054,黄芩素处理组OPN 蛋白相对表达量为0.253±0.024,高糖处理组OPN 蛋白相对表达量为1.063±0.132,高糖加黄芩素组OPN 蛋白相对表达量为0.761±0.089。各组差异具有统计学意义(F=65.66,P<0.05)。比较高糖处理组与高糖加黄芩素组,后者较前者降低28.4%。表明黄芩素能明显抑制高糖导致的OPN 蛋白表达的上调(t=3.273,P<0.05),见图7。

图7 Western blot 分析OPN 蛋白的表达Fig 7 Western blot analysis of OPN expression
3 讨论
糖尿病是一种以高血糖为主要特征复杂的异质性代谢性疾病。1 型糖尿病主要发生在年轻人,通常认为是胰岛β 细胞的自身免疫性破坏导致了胰岛素的缺乏,需要外源性胰岛素替代;2 型糖尿病是一种进行性代谢性疾病,以胰岛素抵抗和后期胰岛β 细胞功能衰竭为特征[7]。大血管病变是糖尿病的主要并发症之一,已知糖尿病大血管微环境中的炎症介质及特异性受体是血管中膜的血管平滑肌细胞表型转化的必需条件,但调控血管平滑肌细胞表型转化的具体机制尚不清楚。
血管壁中膜的主要细胞就是血管平滑肌细胞,在生理状态下,血管平滑肌细胞主要表现为收缩表型;而在病理状态下,由于各种因素的作用,血管平滑肌细胞由收缩表型转化为合成表型,同时也导致了动脉粥样硬化等病理生理现象的发生与发展[8,9]。在这种表型转化过程中,可见在收缩表型血管平滑肌细胞丰富表达的α-SMA、SM22-α 蛋白表达下调,而在合成表型血管平滑肌细胞丰富表达的骨桥蛋白(OPN)表达上调[10,11]。
我国传统中药黄芩是唇形科植物黄芩的干燥根,药用历史悠久,自《神农本草经》迄今已有2 000多年的应用历史。黄芩素是黄芩中含量最高的黄酮类化合物之一,也是黄芩的主要活性成分。研究表明,黄芩素能够抑制包括糖尿病在内的多种慢性炎症性疾病的发生和发展[1-6]。
Woo 等[12]研究发现黄芩素能通过抑制C/EBPb与DNA 的结合,从而抑制小鼠巨噬细胞RAW 264.7 细胞的COX-2 表达以及PGs 的生成;Wakabayashi 等[13]和Kang 等[14]研究发现黄芩素能通过抑制一氧化氮的合成和NF-κB 的活化,从而抑制小鼠巨噬细胞RAW 264.7 细胞的IL-12 分泌。Hsieh等[15]研究发现黄芩素能通过抑制NF-κB 的活化,从而抑制人肥大细胞系HMC-1 细胞的IL-6、IL-8、MCP-1 等炎症因子的释放。
对于离体大鼠肠系膜动脉的研究表明黄芩素具有收缩、舒张血管平滑肌的双重作用[16],其中在0.3~10 μmol/L 较低浓度条件下能收缩血管平滑肌,而在30~300 μmol/L 较高浓度条件下能舒张血管平滑肌,显示了黄芩素复杂的血管效应。实验表明黄芩素能通过抑制NF-κB 活化,抑制血管平滑肌细胞增殖和内膜增生[17]。
近年来,国内研究人员也对黄芩素拮抗慢性炎症性疾病及其机制做了大量的研究工作。张倩等[18]用LPS 刺激小鼠单核巨噬细胞RAW 264. 7 释放炎症介质NO、PGE2以及IL-6、TNF-α、iNOS、COX-2 等炎症因子,并研究黄芩素的抗炎活性。结果表明,黄芩素能显著抑制炎症介质NO、PGE2的产生和炎症因子IL-6、TNF-α 的释放,明显下调iNOS、COX-2 蛋白表达水平。魏雪芳等[19]用不同浓度的黄芩素处理2 型糖尿病大鼠,通过测定胰腺组织中丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性,发现黄芩素能够下调2 型糖尿病大鼠组织中MDA 含量和SOD 活性。杨波等[20]用不同浓度的黄芩素处理骨性关节炎大鼠,结果显示:与与假手术组比较,骨性关节炎模型组大鼠血清中IL-1β、IL-6、TNF-α 水平显著增高,与模型对照组比较,10、20、30 mg/kg 黄芩素均能够明显降低骨性关节炎模型大鼠血清中IL-1β、IL-6、TNF-α 水平。进一步研究认为黄芩素可能是通过调节miR-29a-3p 的表达来拮抗软骨细胞退化。徐薇涵等[21]用三硝基苯磺酸(TNBS)法构建溃疡性结肠炎大鼠模型,并发现黄芩素可有效减轻溃疡性结肠炎大鼠炎性反应及结肠黏膜组织炎性病理损伤,其作用机制可能与有效上调结肠黏膜组织HSP70 表达相关。
本研究发现黄芩素明显抑制了高糖导致的血管平滑肌细胞α-SMA、SM22-α mRNA 以及蛋白表达的下调和血管平滑肌细胞OPN mRNA 以及蛋白表达的上调。黄芩素明显抑制了高糖导致血管平滑肌细胞从收缩型到合成型的表型转化,而血管平滑肌细胞从收缩型到合成型的表型转化是糖尿病大血管病发生发展的重要环节。但是这种拮抗糖尿病大血管病作用的分子机制是否是通过COX-2/PGs 通路或者C/EBPb 等转录因子,还有待未来进一步研究。

