黄芪多糖对急性心肌梗死大鼠心室重构及miRNA-21 的影响
董 扬,张 芬,李幸幸,吴 杰,徐忠诚
(金华市人民医院心内二科,浙江金华321000)
急性心肌梗死(acute myocardial infarction,AMI)是由冠状动脉供血急剧下降或突然中断造成组织缺血缺氧,继而引起部分心肌组织急性坏死的一种缺血性心血管疾病,具有起病急骤,致死率高,并发症多等特点[1]。流行病学调查显示,截至2016年,我国AMI 发病人数已超过200 万,并且该数字还呈现逐年攀升的趋势[2]。尽管随着介入技术的快速发展,我国AMI 的死亡率明显降低,然而AMI 后患者的远期死亡风险依然很高。从组织学层面,AMI 后主要表现为心肌间质充血、水肿,继而大量心肌细胞死亡和炎性细胞浸润,导致心肌纤维化并出现心室重构,最终诱发心衰及心脏破裂。因此,有效改善心室重构对AMI 患者的预后至关重要。
黄芪多糖(astragalus polysaccharides,APS)是从豆科植物黄芪干燥根茎中提取的一种水溶性的杂多糖,已被证实具有降血脂、抗炎和抗氧化等作用[3]。同时,研究还发现,APS 可以通过扩张外周血管阻力、增加冠脉血流速度、改善心肌供血供氧、抑制血小板聚集等方面对心肌缺血再灌注损伤发挥治疗作用[4,5]。miR-21 作为一种常见的非编码小分子RNA,已被证实具有调控炎症因子的作用,并在AMI 后的病理过程中起着重要的调节作用[6,7]。因此,本研究拟通过观察APS 对AMI 大鼠心肌组织中miR-21 的表达及其介导的TLR4/MyD88/NFκB 信号通路的影响,以期进一步明确APS 对心室重构的作用。
1 材料与方法
1.1 实验动物
共60 只Sprague Dawley 大鼠购于北京维通利华实验动物技术有限公司,雄性,Specific Pathogen Free 级,体质量(214±11)g,合格证号:SCXK(京):2016-0006。实验大鼠采取分笼饲养模式,自由饮食饮水。实验通过实验动物伦理委员会审查[批号:HB20190117050115DY-A]。
1.2 药品及试剂
APS(含70 %黄芪多糖粉,批准文号:国药准字Z20040085)购于天津赛诺制药有限公司生产;阿托伐他汀片(20 mg/片,国药准字:J20120050)购于辉瑞制药有限公司;Masson 染液及HE 染色、IL-1β、IL-6、TNF-α、IL-10、MMP-2 和TIMP-2 检测试剂盒购自南京建成生物工程研究所;TLR4、MyD88、NF-κB p65、p-NF-κB p65 兔抗鼠单体购自Abcam 公司,GAPDH 兔抗鼠单克隆抗体及辣根过氧化物酶标记山羊抗兔IgG 二抗购自美国CST 公司。Trizol Reagent 试剂盒购自美国Invitrogen 公司。First Strand cDNA Synthesis Kit、Real Time PCR Kit 购自上海碧云天生物科技有限公司。超敏ECL 化学发光试剂盒及BCA 蛋白定量试剂盒购于沈阳万类生物科技公司。
1.3 动物模型的建立及药物干预
大鼠按随机数字表法随机分为假手术组、模型组及APS 低剂量组、中剂量组、高剂量组和阿托伐他汀组。参照文献中方法构建大鼠心肌梗死模型[9],具体方法如下:大鼠予1 %戊巴比妥钠腹腔注射,麻醉后将大鼠置于仰卧位固定,并于手术区将左心前区上至颈前,右至胸骨右侧缘,下至心尖搏动3~4 cm处,剃毛备皮。待麻醉后对大鼠进行12 导心电图监测,观察心电变化,剔除心电异常者;气管插管:将鼠板置于45°~60°倾斜台上,上牙固定鼠板边缘,光源照亮颈喉部利于充分暴露声门,进行无创经口气管插管,当口腔镜内出现雾气,则提示插管成功;左冠状动脉前降支(left anterior descending coronary artery,LAD)结扎:将实验大鼠连接至小动物呼吸机,参数设置为潮气量6 mL,呼吸比1∶2,呼吸频率80 次/min,手术严格按照无菌操作,消毒术区,于左侧第三、四肋间横向剪开皮肤及肌肉,撕开心包膜,使用眼科开睑器扩口,充分暴露心脏,结扎位置平行于心耳,使用5-0 缝合线于心耳下2 mm 处对左冠状动脉进行结扎。结扎成功的标志为结扎部位及以下心肌变白。予2-0 缝合线进行逐层缝合关胸,关胸后脱机,尽快恢复大鼠自主呼吸,假手术组只进行穿线但不予结扎。术后各只大鼠均注射利多卡因0.1 mL以防心律失常。造模后各组给予相应的药物灌胃治疗,其中APS 低、中、高剂量组参照文献及前期预实验结果分别给予200 、400 、800 mg/kg的APS 水溶液灌胃治疗[8]。阿托伐他汀组给予10 mg/kg 阿托伐他汀混悬液灌胃治疗,假手术组和模型组给予等容量生理盐水灌胃,以上各组均灌胃1 次/d,连续4 周。4 周后处死大鼠,留取心肌组织已备检测。
1.4 指标检测
1.4.1 心肌组织病理学 取大鼠左心室组织于4%甲醛固定后制备厚度为4 μm 的石蜡切片。分别进行HE 染色和Masson 染色,具体实验步骤参照试剂盒说明书进行。于光学显微镜下观察心肌细胞排列及胶原染色情况(蓝色),通过Image Pro Plus 6.0软件计算各组胶原染色面积。
1.4.2 ELISA 法检测大鼠心肌组织IL-1β、IL-6、IL-10 和TNF-α 水平 取大鼠心肌组织中加入缓冲液进行研磨,3 000 r/min 离心10 min,提取上清,并按大鼠IL-1β、IL-6、TNF-α、IL-10 试剂盒说明书的方法,对浓度已达到均衡的心肌组织中IL-1β、IL-6、IL-10 和TNF-α 的含量进行检测。
1.4.3 RT-PCR 检测心肌组织中miR-21 及MMP2、TIMP-2、Col-I 和Col-III 基因的表达 采用试剂盒提取心肌组织中总RNA,核酸检测仪测定浓度,并在每个样本中取1 μg 的RNA,分别加入M-MLV 缓冲液4 μL、M-MLV 1 μL、RNasin 0.5 μL、DNTP 2 μL,无RNA酶水加至20 μL,通过逆转录反应进行cDNA的合成。在PCR条件下分别为95 ℃×15 min,95 ℃×10 s,40个周期×54 ℃×20 s,72 ℃×20 s,以U6 作为参照测定miR-21 基因水平,以GAPDH 作为参照测定MMP2、TIMP-2、Col-I、Col-Ⅲ基因水平,用2-ΔΔCt法计算样品中相应基因表达水平的变化。引物序列见表1。

表1 RT-PCR 中的PCR 反应引物Tab 1 Primers for RT-PCR
1.4.4 Western blot 检测TLR4/MyD88/NF-κB 信号通路中相关蛋白的表达情况 取适量心肌组织于冰上裂解后离心取上清,采用BCA 蛋白定量试剂盒测定每个样品的浓度,每组50 μg 上样、聚丙烯酰胺凝胶100 V 恒压电泳90 min 以分离蛋白质、转膜至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、洗膜。加入适量稀释的TLR4、MyD88、p-NF-κB p65、NF-κB p65 及GAPDH 兔抗鼠单克隆抗体(1∶2 000),4 ℃孵育过夜。洗膜后加入稀释的辣根过氧化物酶标记山羊抗兔IgG 二抗(1∶1 000),室温下继续孵育90 min。超敏ECL 化学发光试剂显影后,采用凝胶成像系统分析扫描,以GAPDH 作为内参蛋白,以目的蛋白/GAPDH 的比值代表其相对表达丰度。
1.5 统计学处理
本研究中数据均以SPSS 20.0 软件进行统计学分析,实验数据以均数±标准差(±s)的形式表示。多组间的比较采用单因素方差分析(one-way ANOVA),而组间两两之间的比较采用最小显著性差异法(least significant difference,LSD),以P<0.05 为组间差异具有统计学意义。
2 结果
2.1 黄芪多糖对急性心梗大鼠心肌组织形态的影响
模型组在术后第1、3 天各发生1 只大鼠死亡,故纳入8 只大鼠;APS 低剂量组大鼠于造模第3 天时发生1 只大鼠死亡,故仅纳入9 只大鼠;阿托伐他汀组大鼠在造模第5 天时出现1 只死亡,其余各组未见大鼠死亡现象。
HE 染色结果显示,假手术组心肌组织横纹清晰、排列规则且完整,细胞质均匀丰富,细胞核清晰可见(图1A)。与假手术组比较,模型组可见大范围浅染的心肌梗死区,梗死区坏死肌纤维被疏松的结缔组织代替,组织疏松水肿,毛细血管增生,组织间有充血现象,并且伴有大量炎细胞浸润,梗死区边缘可见心肌肥大(图1B)。与模型组相比,APS 各剂量组及阿托伐他汀组在不同程度上改善了心肌组织病理状态,其作用效果介于假手术组与模型组之间(图1C~1F)。
假手术组大鼠左心室组织中可见极少量的蓝色胶原沉积。与假手术组相比,模型组可见大量的胶原纤维且染色面积明显增加,差异具有统计学意义(P<0.05)。与模型组比较,APS 各剂量组及阿托伐他汀组可能显著抑制心肌组织中胶原沉积,差异均具有统计学意义(P<0.05),见 图2A~2F、表2。
2.2 黄芪多糖对急性心梗大鼠心肌组织中IL-1β、IL-6、TNF-α 和IL-10 水平的影响
与假手术组相比,模型组大鼠心肌组织中IL-10 的水平显著降低,IL-1β、IL-6 和TNF-α 的表达水平均显著增加,差异均具有统计学意义(P<0.05)。与模型组比较,各处理组心肌组织中IL-10 的水平显著增加,IL-1β、IL-6 和TNF-α 的水平均显著降低,差异均具有统计学意义(P<0.05),表明APS 可改善因心肌梗死所造成的心肌组织炎症反应,见表3。
表2 各组大鼠心肌组织胶原染色面积的比较(±s)Tab 2 Comparison of the staining area of collagen in myo⁃cardial tissue of rats(±s)

表2 各组大鼠心肌组织胶原染色面积的比较(±s)Tab 2 Comparison of the staining area of collagen in myo⁃cardial tissue of rats(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
n 组别假手术组模型组APS 低剂量组APS 中剂量组APS 高剂量组阿托伐他汀组10胶原染色面积(%)0.95±0.08 3.82±0.37*2.54±0.28#1.98±0.13#1.17±0.07#1.12±0.09#23.14 0.00 89 10 10 9 FP
2.3 黄芪多糖对急性心梗大鼠心肌组织中MMP2、TIMP-2、Col-I 和Col-ⅢmRNA 表达的影响
RT-PCR 结果显示,与假手术组比较,模型组MMP2、Col-I 和Col- Ⅲ mRNA 的表达水平及MMP2/TIMP-2 的比值显著升高,TIMP-2 mRNA的表达水平显著减少,差异均具有统计学意义(P<0.05)。而与模型组相比,APS 各剂量组和阿托伐他汀组MMP2、Col-I 和Col-ⅢmRNA 的表达水平及MMP2/TIMP-2 的比值显著降低,TIMP-2 mRNA的表达水平显著升高,差异均具有统计学意义(P<0.05)。见表4。

图1 HE 染色观察心肌组织变化(×100)Fig 1 Changes of myocardial tissue by HE staining(×100)

图2 MASSON 染色观察心肌组织变化(×100)Fig 2 Changes of myocardial tissue by Masson staining(×100)
表3 各组大鼠心肌组织中IL-1β、IL-6、TNF-α 和IL-10 水平比较(pg/mL,±s)Tab 3 Levels of IL-1β,IL-6,TNF-α and IL-10 in myocardial tissues of rats(pg/mL,±s)

表3 各组大鼠心肌组织中IL-1β、IL-6、TNF-α 和IL-10 水平比较(pg/mL,±s)Tab 3 Levels of IL-1β,IL-6,TNF-α and IL-10 in myocardial tissues of rats(pg/mL,±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
IL-10 48.29±5.54 17.17±6.89*21.21±5.94#29.26±7.45#34.12±5.87#43.02±4.93#27.94 0.00组别假手术组模型组APS 低剂量组APS 中剂量组APS 高剂量组阿托伐他汀组n 10 89 10 10 9 FP IL-1β 0.19±0.05 0.43±0.26*0.29±0.15#0.26±0.13#0.23±0.09#0.21±0.08#13.94 0.00 IL-6 8.14±2.12 11.83±2.45*10.23±3.12#9.79±2.67#9.12±1.31#8.97±1.26#47.35 0.00 TNF-α 4.21±1.15 17.23±4.98*15.69±3.12#8.31±2.76#6.42±1.98#6.35±1.92#36.51 0.00
表4 各组大鼠心肌组织中MMP2、TIMP-2、Col-I 和Col-ⅢmRNA 表达的比较(±s)Tab 4 mRNA expression of MMP2,TIMP-2,Col-I and Col-Ⅲin myocardial tissues of rats(±s)

表4 各组大鼠心肌组织中MMP2、TIMP-2、Col-I 和Col-ⅢmRNA 表达的比较(±s)Tab 4 mRNA expression of MMP2,TIMP-2,Col-I and Col-Ⅲin myocardial tissues of rats(±s)
注:与假手术组比较,*P<0.0;与模型组比较,#P<0.05。
Col-Ⅲ/GAPDH 1.0 ±0.01 2.59±0.14*2.24±0.08#1.82±0.07#1.31±0.13#1.27±0.09#16.74 0.00组别假手术组模型组APS 低剂量组APS 中剂量组APS 高剂量组阿托伐他汀组n 10 89 10 10 9 FP MMP2/GAPDH 1.0 ±0.01 2.11±0.07*1.64±0.05#1.29±0.07#1.19±0.09#1.15±0.13#21.35 0.00 TIMP-2/GAPDH 1.0 ±0.01 0.25±0.04*0.38±0.06#0.64±0.09#0.75±0.07#0.78±0.08#10.68 0.00 MMP2/TIMP-2 1.0 ±0.01 8.44±1.75*4.32±0.83#2.02±0.78#1.59±1.29#1.84±1.63#26.34 0.00 Col-I/GAPDH 1.0 ±0.01 2.26±0.25*1.97±0.11#1.73±0.09#1.27±0.14#1.18±0.16#15.38 0.00
2.4 黄芪多糖对急性心梗大鼠心肌组织中miR-21表达的影响
与假手术组比较,模型组大鼠心肌组织中miR-21的表达水平显著减少,差异具有统计学意义(P<0.05)。而与模型组相比,各处理组大鼠心肌组织中miR-21的表达均显著增加,差异具有统计学意义(P<0.05)。见表5。
表5 各组大鼠心肌组织中miR-21 表达的比较(±s)Tab 5 miR-21 expression in myocardial tissues of rats(±s)

表5 各组大鼠心肌组织中miR-21 表达的比较(±s)Tab 5 miR-21 expression in myocardial tissues of rats(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
n 组别假手术组模型组APS 低剂量组APS 中剂量组APS 高剂量组阿托伐他汀组10 miR-21/U6 1.0 ±0.01 0.22±0.13*0.48±0.09#0.75±0.07#0.94±0.12#0.96±0.18#17.35 0.00 89 10 10 9 FP
2.5 黄芪多糖对心肌组织中TLR4/MyD88/NFκB 通路的影响
与假手术组比较,模型组心肌组织中TLR4、p-NF-κB p65 和MyD88 蛋白的表达水平显著增加,差异均具有统计学意义(P<0.05),而各组组织中NFκB p65 蛋白的表达无明显变化,差异无统计学意义(P>0.05)。与模型组比较,APS 各剂量组及阿托伐他汀组中TLR4、p-NF-κB p65 和MyD88 蛋白的表达丰度均明显下调,差异均具有统计学意义(P<0.05),见表6和图3。
表6 各组大鼠心肌组织TLR4/MyD88/NF-κB 通路中相关蛋白表达比较(±s)Tab 6 Related protein expression of TLR4/MyD88/NF-κB signaling pathway in myocardial tissues of rats(±s)

表6 各组大鼠心肌组织TLR4/MyD88/NF-κB 通路中相关蛋白表达比较(±s)Tab 6 Related protein expression of TLR4/MyD88/NF-κB signaling pathway in myocardial tissues of rats(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
组别n TLR4/GAPDH MyD88/GAPDH假手术组模型组APS 低剂量组APS 中剂量组APS 高剂量组阿托伐他汀组10 p-NF-κB p65/ NF-κB p65 0.45±0.07 1.11±0.15*0.93±0.16#0.86±0.08#0.62±0.06#0.57±0.11#15.32 0.00 0.47±0.11 1.06±0.14*0.97±0.14#0.86±0.11#0.75±0.07#0.71±0.06#10.36 0.00 89 10 10 9 FP 0.32±0.07 1.46±0.13*1.37±0.08#1.18±0.08#0.98±0.03#0.92±0.05#12.25 0.00
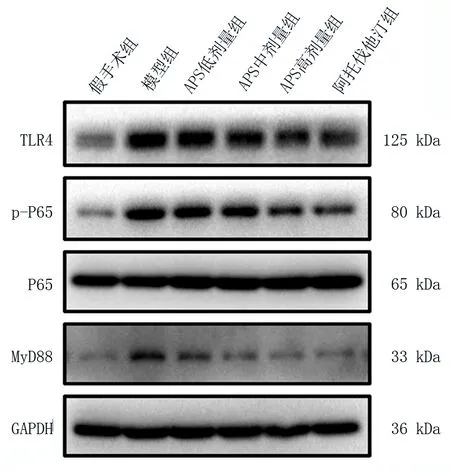
图3 WB检测TLR4/MyD88/NF⁃κB通路相关蛋白的表达Fig 3 Related protein expression of TLR4/MyD88/NFκB signaling pathway by Western blotting
3 讨论
心室重构是指心肌对容量或压力产生的一种适应性或代偿性改变,以左心室功能减退和心室扩张为主要特征并表现为大量心肌细胞受损、坏死,同时出现间质纤维化和心肌肥厚[9]。作为AMI 后导致死亡的主要诱因,尽管对心室重构的预防措施已取得长足进步,但其治疗效果仍不尽人意。因此,提高心肌抗炎性反应和纤维化水平是改善AMI患者心室重构的关键。
心室重构会造成大量成纤维细胞激活并分泌大量的胶原纤维,引起心肌间质纤维化[10]。胶原是心肌细胞外基质的主要成分,其中Col-I 和Col-Ⅲ比例约占90%。MMP2 作为MMPs 家族的重要明胶酶,能够有效降解细胞外基质(extracellular matrix,ECM)中的明胶和间质胶原,从而破坏胶原网的组织结构,使得细胞间失去紧密连接性[11]。在压力的作用下,左心室几何构形出现改变,导致心室重构的出现并影响左心室的功能。TIMPs 作为MMPs的内源性特异抑制剂,与MMPs 共同组成机体调节细胞外基质动态平衡的重要部分[12]。TlMP-2 主要抑制MMP2,因此,MMP2 及TIMP-2 的表达平衡是心肌基质重塑的决定性因素。
炎症反应是AMI 发生后梗死区域的特征性改变,当心肌细胞处于缺血缺氧状态时炎症反应即被激活,通过大量释放IL-1β、IL-6、TNF-α 等内源性细胞因子导致心肌组织结构改变和细胞肥大,从而引起心肌细胞凋亡及心肌重构[13,14]。同时,早期心肌间质纤维化也会释放大量的TNF-α,促进IL-6的释放和炎性细胞浸润[15]。IL-10在免疫反应中起到负调节作用,通过直接抑制免疫细胞功能实现免疫抑制[16]。此外,研究证实,IL-10还可通过抑制IL-1β的表达,避免心肌组织过度损伤[17]。
笔者通过TargetScan 网站预测发现,TLR4 是miR-21的下游靶基因。miR-21的过表达不仅可降低炎症因子IL-6表达,增加抗炎因子IL-10表达,还可以抑制TLR4及其下游NF-κB活化[18]。同时,研究表明AMI患者均不同程度伴有miR-21表达异常,其可通过调控血管内皮细胞及心肌细胞的凋亡、增殖,参与氧化应激抑制细胞损伤[19]。TLR4/MyD88/NF-κB信号通路在机体免疫及炎症反应调节方面具有关键作用,是调控TNF-α、IL-1β、IL-6等炎症因子的中心环节和共同通路,在心肌细胞损伤的过程中起到关键作用[20,21]。因此,通过调控miR-21的水平进而抑制TLR4/MyD88/NF-κB信号通路的活化是抑制AMI后炎症反应的重要途径。
本研究结果显示,APS能够显著降低心肌组织中IL-1β、IL-6和TNF-α 的表达,增加抗炎因子IL-10的水平,从而改善AMI后左心室组织病理学形态,与模型组比较,差异均具有统计学意义(P<0.05)。心室重构过程中导致大量胶原沉积,本研究结果显示,APS 能够显著降低大鼠心肌组织中胶原染色面积、MMP2、Col-I和Col-ⅢmRNA的表达水平及MMP2/TIMP-2的比值,增加TIMP-2 mRNA的表达丰度,与模型组比较差异均具有统计学意义(P<0.05)。与此同时,APS还能显著上调心肌组织中miR-21的表达水平,降低AMI大鼠心肌组织TLR4、p-NF-κB p65和MyD88蛋白的表达,进而抑制TLR4/MyD88/NF-κB信号通路的活化,与模型组相比差异具有统计学意义(P<0.05)。
综上所述,APS可通过上调心肌组织中miR-21的表达水平,抑制TLR4/MyD88/NF-κB通路的激活,从而抑制胶原沉积和炎症反应,起到对心肌梗死后心室重构的治疗作用。

