黄芩苷对低氧诱导的新生大鼠肺损伤的保护作用
黄 芳,孙亚宁,常 克,冯丹丹,王志强
(成都中医药大学1.临床医学院,2.附属医院儿科,四川 成都 610075)
新生儿低氧性肺动脉高压(hypoxia-induced pulmonary hypertension,HPH)是威胁新生儿生命的急危重症之一,疾病早期表现为肺血管痉挛,若治疗不及时则发生不可逆的组织变化,此时期救治困难、死亡率高[1]。低氧是HPH形成的初始原因,低氧诱导的氧化应激及炎症反应和因此造成的血管损伤与肺动脉高压等疾病密切相关[2-4]。此外,新生儿的肺部发育不成熟,暴露于炎症和氧化应激更容易遭受急性肺损伤[5]。黄芩苷(baicalin)是从黄芩的根中提取的一种黄酮类化合物,具有抗炎、抗氧化、抗癌、抗菌和抗病毒等药理活性[6-7]。黄芩苷已被用作抗炎剂,用于治疗多种炎性疾病,如支气管炎、肾炎、肝炎和哮喘[8-9]。前期研究表明,黄芩苷可以抑制巨噬细胞中内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和环氧合酶2(cyclooxygenase-2,COX-2)等炎症因子的分泌水平[10]。黄芩苷可通过抑制蛋白激酶B(protein kinase B,Akt)/NF-κB途径保护大鼠乙醇诱发的慢性胃炎[11]。黄芩苷对低氧导致新生儿肺损伤的影响尚无报道。本研究旨在探究黄芩苷在新生大鼠低氧导致肺损伤模型中的保护作用及其机制。
1 材料与方法
1.1 药物、试剂和主要仪器
黄芩苷(纯度90%)(中国上海源叶生物公司),白细胞介素(interleukin,IL)-4、IL-6、IL-10、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(上海酶联生物公司),兔抗大鼠Bcl-2、Bax、β肌动蛋白、TNF-α和IL-10单抗(均上海艾博抗公司);兔抗大鼠胱天蛋白酶9(ab184786)、磷酸化NF-κB P65(p-NF-κB P65)和NF-κB P65单抗及兔抗大鼠胱天蛋白酶3(#9662)、p-Akt和Akt多抗、辣根过氧化物酶标记山羊抗兔IgG抗体(上海赛信通公司),聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜(上海Millipore公司),ECL化学发光液(上海碧云天公司)。倒置显微镜(日本Olympus公司),低温高速离心机(德国Eppendorf公司),凝胶电泳仪(美国Bio-Rad公司),Nanodrop 2000(美国Thermo公司),Synergy HI多功能酶标仪(美国BioTek公司)。
1.2 动物、模型制备[2]和分组处理
40只健康SPF级雄性3~5 d新生SD大鼠,体质量15~25 g(北京维通利华实验动物技术有限公司),许可证号SCXK(京)2016-0006。保持温度在25℃左右,自由饮水,3 d换1次垫料,保持鼠笼清洁干燥,饲养于成都中医药大学(临床医学院),许可证号为SYXK(川)2017-179。SD大鼠适应性饲养7 d,采用随机数字表法将40只大鼠随机分成5组,每组8只:正常对照组、低氧组、低氧+黄芩苷25,50 和100 mg·kg-1,根据SHEN等[9]和WANG等[11]的研究确定黄芩苷使用剂量。
除正常对照组大鼠外,其余组大鼠置于全自动调节常压低氧舱内(大气压约50 kPa,氧浓度10%),制造间断性低氧环境,以1.5 L·min-1的速度输入含氧10%的氮氧混合气,维持氧浓度在9.5%~10.5%范围内,控制CO2浓度<0.5%。通过放置小风扇维持低氧舱仓内气体均匀,通过减压阀和电磁阀调节舱内压力,予以无水氯化钙、钠石灰吸收箱内的水蒸气与CO2。昼夜为12/12 h,每天低氧8 h,常氧16 h。低氧+黄芩苷各剂量组大鼠自低氧诱导起,按分组ig给药,正常对照组和低氧组给生理盐水,每天1次,连续14 d。低氧期每天用自动血气分析仪监测大鼠动脉血氧合指数(PaO2/FiO2),PaO2/FiO2<300为大鼠发生肺损伤。
1.3 标本收集和处理
所有大鼠饲养至实验结束,用10%水合氯醛腹腔注射麻醉,从腹主动脉中收集血液后立即取肺,取左肺称湿重后烘干,测肺湿/干重比值;血液经2500×g离心15 min,吸取上清液,置离心管于-20℃冰箱备用。右肺一部分置于-80℃冰箱中保存,用于Western印迹法检测;一部分甲醛溶液固定24 h,后续进行HE染色和免疫组织化学染色检查。
1.4 HE染色观察大鼠肺组织的病理变化
取1.3分组制备右肺组织,PBS清洗3次,再用30%,50%和70%乙醇依次脱水。然后进行石蜡包埋,组织切片,二甲苯脱腊,HE染色,二甲苯处理,中性树脂进行封胶固定,烘箱过夜处理,光镜下观察肺组织切片病理学变化。根据BAO等[12]描述标准(肺充血,肺泡水肿,炎症细胞浸润,肺泡间隔增厚等)对肺组织损伤进行评分:0~2分正常组织;2~4分轻度炎症;4~6分中度肺损伤,毛细血管隔膜增厚;6~8分重度肺损伤。
1.5 TUNEL法检测大鼠肺组织细胞凋亡率
按1.3分组制备右肺组织,PBS清洗3次,再用30%,50%和70%乙醇依次脱水。然后进行石蜡包埋,组织切片,二甲苯脱腊,按照TUNEL细胞凋亡试剂盒说明书进行染色,封片后使用光学显微镜观察凋亡细胞。细胞凋亡率(%)=(TUNEL阳性细胞数目/视野内总细胞数目)×100%。
1.6 ELISA检测大鼠血清中IL-4,IL-6,IL-10和TNF- α水平
按1.3分组制备大鼠血清,按照ELISA试剂盒说明书检测IL-4,IL-6,IL-10和TNF-α炎症因子水平,样品加入反应孔后37℃孵育45 min后用洗涤液洗涤4次,然后加入生物素标记的抗体37℃反应30 min,洗涤后加链霉亲和素-HRP混匀37℃反应30 min。最后加入显色剂避光显色15 min后加终止液终止反应,450 nm处检测吸光度(A450nm)值。利用标准品的A450nm值及其对应浓度做标准曲线。将各实验组A450nm值以X值代入公式求出检测因子浓度。
1.7 Western印迹法检测大鼠肺组织Bax、Bcl-2、活化胱天蛋白酶3、活化胱天蛋白酶9、TNF- α和IL-10蛋白表达水平及Akt和NF- κB P65蛋白磷酸化水平
按1.3分组制备、-80℃冰箱保存的大鼠右肺组织,用RIPA裂解缓冲液提取总蛋白,用Nanodrop 2000测量蛋白质浓度并调平后,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,然后将其转移到PVDF膜上。将膜用含有5%脱脂牛奶的TBST缓冲液封闭2 h。然后,将膜与稀释的一抗Bax(1∶1000)、Bcl-2(1∶1000)、β肌动蛋白(1∶1000)、胱天蛋白酶3(1∶1000)、胱天蛋白酶9(1∶1000)、TNF-α(1∶1000)、IL-10(1∶1000)、p-Akt(1∶1000)、Akt(1∶1000)、p-NF-κB P65(1∶1000)和 NF-κB P65(1∶1000)4℃孵育过夜。TBST洗涤3次,并与HRP偶联的二抗(1∶4000)37°C孵育1 h。使用ECL化学发光并用quantity one软件分析蛋白条带的积分吸光度值,以目标蛋白条带积分吸光度值与内参积分吸光度值比值表示蛋白相对表达水平,p-Akt/Akt和p-NF-κB P65/NF-κB P65 积分吸光度比值表示磷酸化水平。
1.8 统计学分析
2 结果
2.1 黄芩苷对低氧导致肺损伤新生大鼠肺组织形态和肺湿/干重比的影响
如图1所示,正常对照组肺组织可见肺泡结构完整,排列规则,肺泡腔壁薄,未见肺水肿和炎症细胞浸润;低氧组大鼠肺组织肺泡数量减少,肺泡腔明显缩小,结构紊乱,肺间质及肺泡腔内有炎症细胞浸润,肺泡间隔增厚。低氧+黄芩苷50和100 mg·kg-1组肺泡结构紊乱,肺间质及肺泡腔内炎症细胞浸润,肺泡间隔增厚症状较低氧组减轻。如表1所示,低氧组大鼠肺湿/干重比及肺损伤评分显著高于正常对照组(P<0.01);与低氧组相比,低氧+黄芩苷50和100 mg·kg-1组大鼠肺湿/干重比及肺损伤评分明显降低(P<0.01),低氧+黄芩苷25 mg·kg-1组无显著差异。

Tab.1 Effect of baicalin on lung tissue wet/dry(W/D)mass ratio and injury score of newborn rats with hypoxia-induced lung injury
2.2 黄芩苷对低氧导致肺损伤新生大鼠肺组织细胞凋亡的影响
如图2所示,与正常对照组相比,低氧组大鼠肺组织细胞凋亡率显著增加(P<0.01);与低氧组相比,低氧+黄芩苷50和100 mg·kg-1组细胞凋亡率随着剂量增加而逐渐下降(P<0.01),低氧+黄芩苷25 mg·kg-1组凋亡率无显著变化。

Fig.1 Effect of baicalin on morphology of lung tissue of newborn rats with hypoxia-induced lung injury by HE staining.The rats were placed in an automatic regulating normal-pressure hypoxia chamber and infused 10% oxygen at a rate of 1.5 L·min-1except those in the nomal control group.The oxygen concentration was within the range of 9.5%-10.5%,and the carbon dioxide concentration was less than 0.5%.Hypoxia for 8 h,normal oxygen 16 h in a day.Rats in each group of hypoxia+baicalin were given the corresponding doses of baicalin by ig,normal control group and hypoxia group were given normal saline by ig.once a day for 14 d.

Fig.2 Effect of baicalin on apoptosis of newborn rats with hypoxia-induced lung injury by TUNEL.See Fig.1 for the rat treatment.B:statistics of the percentage of TUNEL positive cells in the total cell population.±s,n=8.**P<0.01,compared with normal control group;##P<0.01,compared with hypoxia group.
2.3 黄芩苷对低氧导致肺损伤新生大鼠肺组织中凋亡相关蛋白和炎症因子蛋白表达的影响
如图3A所示,与正常对照组相比,低氧组大鼠肺组织中活化胱天蛋白酶3、活化胱天蛋白酶9和Bax的表达显著上调(P<0.01),Bcl-2的表达显著下调(P<0.01);与低氧组相比,低氧+黄芩苷50和100 mg·kg-1组大鼠肺细胞中活化胱天蛋白酶3、活化胱天蛋白酶9和Bax的表达显著下调,Bcl-2的表达显著上调(P<0.01),低氧+黄芩苷25 mg·kg-1组无统计学差异。
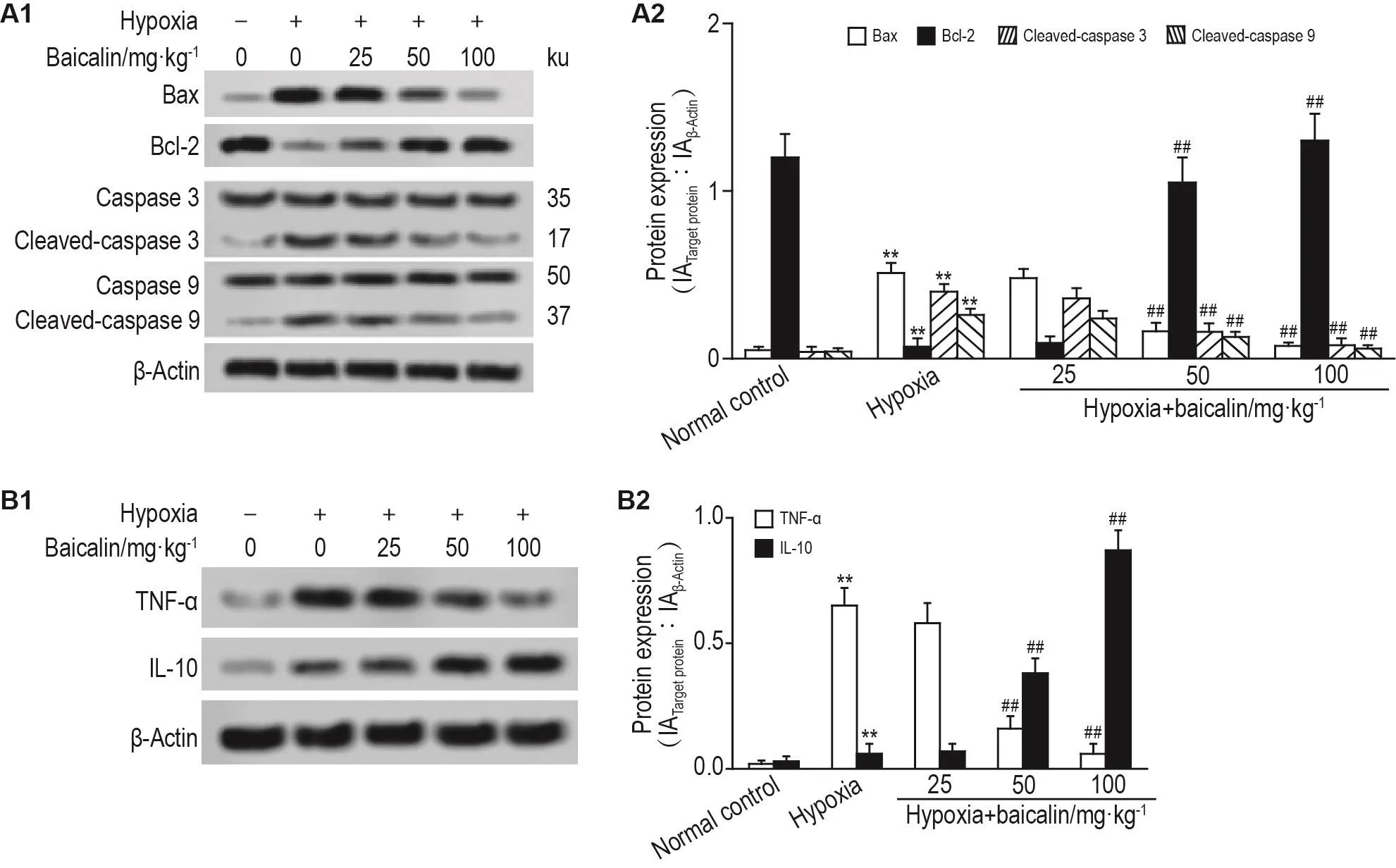
Fig.3 Effect of baicalin on expressions of apoptotic protein(A),TNF- α and IL-10(B)in lung tissue of newborn rats with hypoxia-induced lung injury by Western blotting.See Fig.1 for the rat treatment.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.TNF-α:tumor necrosis factor α;IL:interleukin.±s,n=8.**P<0.01,compared with normal control group;##P<0.01,compared with hypoxia group.
如图3B结果显示,低氧组大鼠肺组织中TNF-α和IL-10蛋白表达明显高于正常对照组(P<0.01);与低氧组相比,低氧+黄芩苷50和100 mg·kg-1组促炎因子TNF-α蛋白表达显著下调,抗炎因子IL-10蛋白表达显著上调(P<0.01),低氧+黄芩苷25mg·kg-1组无统计学差异。
2.4 黄芩苷对低氧导致肺损伤新生大鼠血清和肺组织中炎症因子表达的影响
ELISA结果(表2)显示,与正常对照组比较,低氧组大鼠血清中IL-4,IL-6,IL-10和TNF-α水平均明显升高(P<0.01);与低氧组比较,低氧+黄芩苷50和100 mg·kg-1组促炎因子IL-6和TNF-α水平明显降低,抗炎因子IL-4和IL-10水平明显升高(P<0.01),低氧+黄芩苷25 mg·kg-1组无统计学差异。
2.5 黄芩苷对低氧导致肺损伤新生大鼠肺组织Akt和NF- κB P65蛋白磷酸化水平的影响
如图4所示,与正常对照组相比,低氧组大鼠肺组织Akt和NF-κB P65蛋白磷酸化水平明显升高(P<0.05);与低氧组相比,低氧+黄芩苷50和100 mg·kg-1组随着剂量增加,Akt和NF-κB P65蛋白磷酸化水平呈下降趋势(P<0.01),低氧+黄芩苷25 mg·kg-1组无统计学差异。
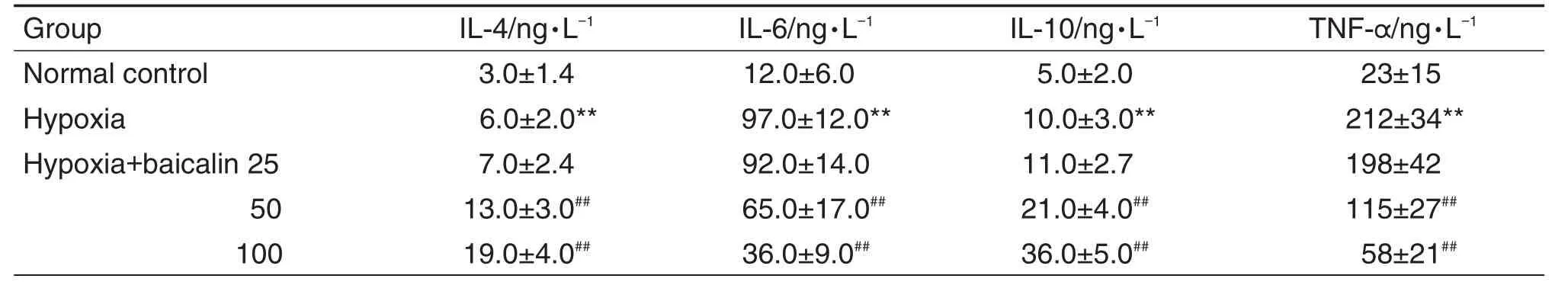
Tab.2 Effect of baicalin on expression of inflammatory factors in serum of newborn rats with hypoxia-induced lung injury
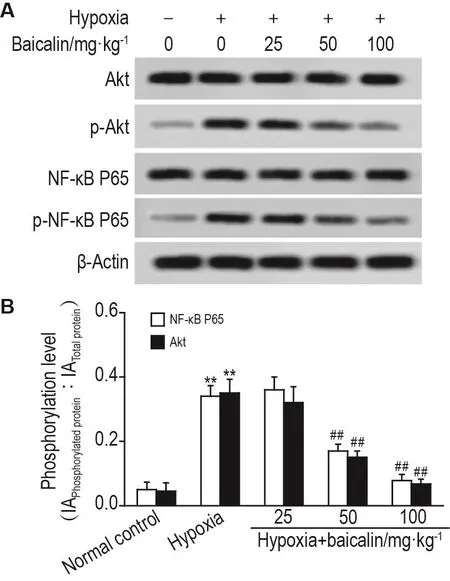
Fig.4 Effect of baicalin on phosphorylation levels of protein kinase B (Akt) and NF- κB P65 proteins in lung tissue of newborn rats with hypoxia-induced lung injury by Western blotting.See Fig.1 for the rat treatment.B was the semi-quantitative result of A.±s,n=8.**P<0.01,compared with normal control group;##P<0.01,compared with hypoxia group.
3 讨论
本研究结果表明,黄芩苷可明显降低肺损伤评分及肺湿/干重比,减轻肺水肿,并明显改善低氧导致的肺组织病变及炎症细胞浸润。因此,黄芩苷对低氧导致的肺损伤具有保护作用。
胱天蛋白酶家族是组织细胞程序性凋亡中的一种蛋白酶,胱天蛋白酶3和胱天蛋白酶9是该过程中关键的蛋白酶,激活后引起细胞皱缩、细胞核碎裂、凋亡小体形成,最终导致细胞凋亡[13]。黄芩苷可通过调节心肌素相关转录因子抑制脑低血/低氧诱导的神经元凋亡[14]。本研究结果表明,黄芩苷可明显降低低氧导致的肺组织细胞凋亡,下调活化胱天蛋白酶3和活化胱天蛋白酶9的表达及Bax/Bcl-2比值。因此,黄芩苷能够抑制低氧导致肺损伤引起的细胞凋亡。
炎症是低氧诱发肺损伤的主要病症之一,IL-6和TNF-α是重要的炎症因子,可加剧炎症细胞的浸润和黏附,并刺激巨噬细胞释放更多促炎因子[15]。IL-10和IL-4能抑制炎症因子IL-6和TNF-α的合成与释放,从而起到抗炎作用[16]。本研究结果表明,低氧诱导的新生大鼠血清中炎症因子TNF-α,IL-6,IL-4和IL-10水平升高,黄芩苷可明显下调促炎因子TNF-α和IL-6的水平,上调抗炎因子IL-4和IL-10的水平。因此,黄芩苷通过抗炎作用对肺损伤起到保护作用。
肺组织中,低氧可选择性地激活NF-κB[17],NF-κB的激活是促炎性介质(包括TNF-α,IL-1β和IL-6)的转录和生成所必需的[9]。研究表明,黄芩苷通过抑制NF-κB活化来减轻脂多糖诱导的小鼠大脑皮质神经炎[18]。黄芩苷通过阻断人骨关节炎软骨细胞中的NF-κB抑制IL-1β诱导的炎症细胞因子的表达,并在小鼠骨关节炎模型中显示出保护作用[19]。本研究结果表明,黄芩苷可逆转低氧导致的Akt和NF-κB P65蛋白磷酸化水平的升高,从而抑制Akt/NF-κB通路激活。因此,黄芩苷调控NF-κB通路对新生大鼠低氧所致的肺损伤起到抗炎保护作用。
综上所述,黄芩苷对低氧诱导的新生大鼠肺损伤具有明显的保护作用,可明显减轻肺损伤的组织形态学改变,并通过抑制Akt和NF-κB P65蛋白磷酸化抑制炎症因子的产生,从而抑制由炎症引发的细胞凋亡。

