芍药苷通过调节MAPK通路减轻高糖诱导的H9c2细胞损伤
王艾青,陈玉芳,申洪娇,杨 卓,田振涛
(1.河南护理职业学院教务处,河南 安阳 455000;濮阳市安阳地区医院 2.全科医疗科,3.中医科,河南 安阳 455000)
糖尿病是一种常见的代谢疾病,可导致高血糖症。全身性高血糖症的发生对心脏造成长期损害,最终可能导致糖尿病性心肌病的发展[1]。据估计,有65%~70%糖尿病患者死于心脏病[2]。高糖(high glucose,HG)诱导的心肌细胞损伤的发病机制复杂且高度多样化,多种危险因素,如活性氧的产生、抗氧化防御系统的下降、促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的激活、促炎性细胞因子等都在高血糖诱导的心肌损伤中起关键作用[3]。已有研究表明,HG显著增加MAPK信号通路的磷酸化,MAPK信号通主要由P38、细胞外信号调节蛋白激酶1/2(extracellular signal-regulated protein kinase 1/2,ERK1/2)和应激活化的蛋白激酶c-Jun N端激酶(c-Jun N-terminal kinase,JNK)组成,这与糖尿病性心脏病的进展密切相关[4]。尽管对糖尿病性心脏病进行了广泛的研究,但对发病机理尚不明确,且无有效的治疗方法。芍药苷(paeoniflorin,PF)是常用中药芍药的主要活性成分。PF具有多种生物学活性,可抑制血小板凝集、血栓形成、动脉粥样硬化和肿瘤形成,扩张冠状血管,增加冠状动脉血流量,改善微循环,保护肝等[5]。研究表明,PF能改善急性心肌梗死大鼠心功能和减少梗死后左室重构不良反应[6]。PF通过抑制转化生长因子β(transforming growth factor-β,TGF-β)/Smad和NF-κB途径减轻压力超载诱导的心肌重构[7];PF通过抑制NF-κB减轻内毒素血症小鼠的心功能障碍[8]。本研究主要探讨PF对HG诱导H9c2细胞损伤的作用及机制。
1 材料与方法
1.1 药物、试剂和主要仪器
PF(HPLC>98%,货号:23180-57-6,上海融禾医药科技发展有限公司),葡萄糖(货号:47829,上海西格玛奥德里奇贸易有限公司),DMEM-F12培养基(货号:C11330500BT,上海慧颖生物科技有限公司),胎牛血清(货号:16000-044,上海素尔生物科技有限公司),CCK-8试剂盒(货号:GK10001,美国GlpBio公司),兔抗大鼠胱天蛋白酶3多克隆抗体、甘油醛-3-磷酸脱氢酶(GAPDH)、ERK1/2(货号:ab17942)、磷酸化ERK1/2(p-ERK1/2)(货号:ab223500)、JNK(货号:ab213521)、p-JNK(货号:ab131499)、P38(货号:ab170099)、p-P38单克隆抗体(货号:ab4822)、辣根过氧化物酶标记的山羊抗兔单克隆IgG抗体(货号:ab6728)、ERK1/2选择性抑制剂U0126(货号:ab120241)、JNK选择性抑制剂SP600125(货号:ab120065)和P38 MAPK选择性抑制剂SB203580(货号:ab120162)(均英国Abcam公司),BCA试剂盒(货号:BC201,上海易色医疗科技有限公司),Annexin V-FITC/PI双染细胞凋亡检测试剂盒(货号:BB4101-3,上海贝博生物科技有限公司)。
1.2 细胞培养和处理[9]
大鼠心肌细胞H9c2细胞(美国模式培养物集存库)。H9c2细胞在含有10%胎牛血清的DMEMF12培养基中,于37℃,5% CO2的培养箱中培养。根据预实验结果选取PF 250,300和350 μmol·L-1处理H9c2细胞3 h。将H9c2细胞随机分为:细胞对照组、PF 350 μmol·L-1组、葡萄糖 35 mmol·L-1组(HG)、HG+PF 250,300,350 μmol·L-1组、SB203580 3 μmol·L-1组、SP600125 10 μmol·L-1组、U0126 15 μmol·L-1组、HG+SB203580 3 μmol·L-1组、HG+SP600125 10 μmol·L-1组、HG+U0126 15 μmol·L-1组、HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1组、HG+PF 350 μmol·L-1+SP600125 10 μmol· L-1组、HG+PF 350 μmol· L-1+U0126 15 μmol· L-1组 、HG+SB203580 3 μmol· L-1+SP600125 10 μmol·L-1+U0126 15 μmol·L-1组。以上分组细胞药物单独或联合预处理3 h,加葡萄糖35 mmol·L-1处理21 h。
1.3 CCK-8法检测H9c2细胞存活率
将H9c2细胞以1×107L-1的密度在96孔板中培养,按1.2分组处理后,加10 μL CCK-8溶液,培养2 h。酶标仪测量450 nm处的吸光度值(A450nm),计算细胞存活率。细胞存活率(%)=药物组A450nm/细胞对照组A450nm×100%。
1.4 流式细胞术检测H9c2细胞凋亡
按1.2分组处理后,用消化液消化H9c2细胞,离心收集。用400 μL Annexin-V结合液按1×109L-1的密度重悬细胞。细胞悬液中加5 μL Annexin-VFITC,于 4℃避光孵育 15 min,加 10 μL PI,于4℃避光孵育5 min,然后用流式细胞仪分析细胞凋亡。
1.5 Western印迹法检测H9c2细胞活化胱天蛋白酶3、Bax和Bcl-2蛋白表达水平及P38 MAPK,ERK1/2和JNK蛋白磷酸化水平
按1.2分组处理后,收集H9c2细胞,在4℃用细胞裂解液裂解30 min,使用BCA蛋白质测定试剂盒定量总蛋白质。将上样缓冲液添加到胞质提取物中并煮沸约5 min,通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离每个样品的等量上清液,然后将总蛋白转移到聚偏二乙烯中二氟化物膜。在室温下,用5%脱脂牛奶在新鲜的封闭缓冲液中将膜封闭1.5 h,然后与兔来源的单克隆一抗(P38 MAPK:1∶1000、p-P38 MAPK:1∶1000、ERK1/2:1∶1000、p-ERK1/2:1∶500、p-JNK:1∶1000、JNK:1∶1000、活化胱天蛋白酶 3:1∶1000、Bax:1∶1000、Bcl-2:1∶1000稀释)在4℃过夜。将膜用TBS-T洗涤3次,然后在室温下与辣根过氧化物酶标记的山羊抗兔单克隆二抗(1∶2500)孵育1.5 h,再将膜用TBS-T洗涤3次,5 min后,滴ECL曝光,以GAPDH为内参,使用Quantity One软件进行分析,目标蛋白质与内参蛋白积分吸光度值比值表示蛋白相对表达水平,磷酸化蛋白与总蛋白积分吸光度比值表示蛋白磷酸化水平。
1.6 统计学分析
2 结果
2.1 PF对HG诱导H9c2细胞存活率的影响
如表1所示,与细胞对照组相比较,PF 350 μmol· L-1组 、SB203580 3 μmol· L-1组 、SP600125 10 μmol·L-1组和U0126 15 μmol·L-1组细胞存活率无明显变化,HG组细胞存活率显著降低(P<0.01);与HG组相比较,HG+PF 250 μmol·L-1组细胞存活率无明显变化,HG+PF 300 μmol·L-1和350 μmol·L-1组、HG+SB203580 3 μmol·L-1组、HG+SP600125 10 μmol· L-1组 、HG+U0126 15 μmol·L-1组细胞存活率显著升高(P<0.05,P<0.01);与HG+PF 350 μmol·L-1组相比较,HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1组、HG+PF 350 μmol·L-1+SP600125 10 μmol·L-1组、HG+PF 350 μmol· L-1+U0126 15 μmol· L-1组 、HG+SB203580 3 μmol·L-1+SP600125 10 μmol·L-1+U0126 15 μmol·L-1组细胞活性显著升高(P<0.05)。

Tab.1 Effect of paeoniflorin(PF)on H9c2 cell viability induced by high glucose(HG)
2.2 PF对HG诱导H9c2细胞凋亡的影响
如图1所示,与细胞对照组相比较,PF 350 μmol· L-1组 、SB203580 3 μmol· L-1组 、SP600125 10 μmol·L-1组和 U0126 15 μmol·L-1组细胞凋亡率无明显变化,HG组细胞凋亡率显著增加(P<0.01);与HG组相比较,HG+PF 250 μmol·L-1组细胞凋亡率无明显变化,HG+PF 300 μmol·L-1,350 μmol·L-1组、HG+SB203580 3 μmol·L-1组、HG+SP60012510 μmol·L-1组、HG+U012615 μmol·L-1组细胞凋亡率显著降低(P<0.05,P<0.01);与HG+PF 350 μmol·L-1组相比较,HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1组、HG+PF 350 μmol·L-1+SP600125 10 μmol·L-1组、HG+PF 350 μmol·L-1+U0126 15 μmol·L-1组 HG+SB203580 3 μmol·L-1+SP600125 10 μmol·L-1+U0126 15 μmol·L-1组细胞凋亡率显著降低(P<0.01)。
2.3 PF对HG诱导H9c2细胞凋亡相关蛋白及MAPK通路蛋白表达和磷酸化的影响
如图2所示,与细胞对照组相比较,PF 350 μmol· L-1组 、SB203580 3 μmol· L-1组 、SP600125 10 μmol·L-1组和U0126 15 μmol·L-1组活化的胱天蛋白酶3、Bax和Bcl-2蛋白表达无明显变化,HG组胱天蛋白酶3和Bax显著上调(P<0.01),Bcl-2蛋白表达显著下调(P<0.05);与HG组相比较,HG+PF 250 μmol·L-1组活化的胱天蛋白酶3、Bax和Bcl-2蛋白表达无明显变化,HG+PF 300 μmol·L-1组,HG+PF 350 μmol·L-1组、HG+SB203580 3 μmol·L-1组、HG+SP600125 10 μmol·L-1组、HG+U0126 15 μmol·L-1组胱天蛋白酶3和Bax显著下调(P<0.05,P<0.01),Bcl-2蛋白表达显著上调(P<0.05);与HG+PF 350 μmol·L-1组相比较,HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1组、HG+PF 350 μmol·L-1+SP600125 10 μmol·L-1组、HG+PF 350 μmol·L-1+U0126 15 μmol·L-1组 HG+SB203580 3 μmol· L-1+SP600125 10 μmol· L-1+U0126 15 μmol·L-1组胱天蛋白酶3和Bax显著下调(P<0.01),Bcl-2蛋白表达显著上调(P<0.05)。
如图2所示,与细胞对照组相比较,PF 350 μmol·L-1组 P38 MAPK、ERK1/2 和 JNK 蛋白磷酸化水平无明显变化,HG组P38 MAPK、ERK1/2和JNK蛋白磷酸化水平显著上调(P<0.01),SB203580 3 μmol·L-1组ERK1/2和JNK蛋白磷酸化水平无明显变化,P38 MAPK蛋白磷酸化水平显著下调(P<0.01),SP600125 10 μmol·L-1组ERK1/2和P38 MAPK蛋白磷酸化水平无明显变化,JNK蛋白磷酸化水平显著下调(P<0.01),U0126 15 μmol·L-1组P38 MAPK和JNK蛋白磷酸化水平无明显变化,ERK1/2蛋白磷酸化水平显著下调(P<0.01);与HG组相比较,HG+PF 250 μmol·L-1组 P38 MAPK、ERK1/2和JNK蛋白磷酸化水平无明显变化,HG+PF 300 μmol·L-1和 350 μmol·L-1组 P38 MAPK、ERK1/2和JNK蛋白磷酸化水平显著下调(P<0.05,P<0.01),HG+SB203580 3 μmol·L-1组磷酸化ERK1/2和JNK蛋白磷酸化水平无明显变化,P38 MAPK蛋白磷酸化水平显著下调(P<0.01),HG+SP600125 10 μmol·L-1组 ERK1/2 和 P38 MAPK蛋白磷酸化水平无明显变化,JNK蛋白磷酸化水平显著下调(P<0.01),HG+U0126 15 μmol·L-1组P38 MAPK和JNK蛋白磷酸化水平无明显变化,ERK1/2蛋白磷酸化水平显著下调(P<0.01);与 HG+PF 350 μmol· L-1组 相 比 较 ,HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1组 ERK1/2 和JNK蛋白磷酸化水平无明显变化,P38 MAPK蛋白磷酸化水平显著下调(P<0.01),HG+PF 350 μmol·L-1+SP600125 10 μmol·L-1组 ERK1/2和P38 MAPK蛋白磷酸化水平表达无明显变化,JNK蛋白磷酸化水平显著下调(P<0.01),HG+PF 350 μmol·L-1+U0126 15 μmol·L-1组P38 MAPK和JNK蛋白磷酸化水平无明显变化,ERK1/2蛋白磷酸化水平显著下调(P<0.01),HG+SB203580 3 μmol· L-1+SP600125 10 μmol· L-1+U0126 15 μmol·L-1组P38 MAPK,ERK1/2和JNK蛋白磷酸化水平显著下调(P<0.01)。
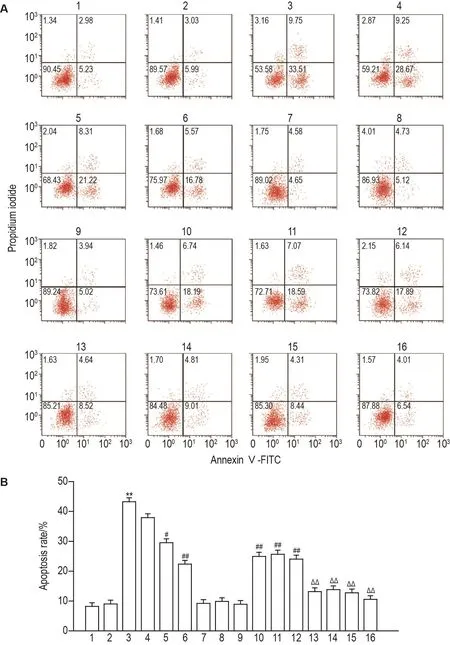
Fig.1 Effect of PF on apoptosis of H9c2 cells induced by HG.See Tab.1 for the cell treatment.B was the quantitative result of A.1:cell control group;2:PF 350 μmol·L-1;3 HG;4:HG+PF 250 μmol·L-1;5:HG+PF 300 μmol·L-1;6:HG+PF 350 μmol·L-1;7:SB203580 3 μmol·L-1;8:SP600125 10 μmol·L-1;9:U0126 15 μmol·L-1;10:HG+SB203580 3 μmol·L-1;11:HG+SP600125 10 μmol·L-1;12:HG+U0126 15 μmol·L-1;HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1;14:HG+PF 350 μmol·L-1+SP600125 10 μmol·L-1;15:HG+PF 350 μmol·L-1+U0126 15 μmol·L-1;16:HG+SB203580 3 μmol·L-1+SP600125 10 μmol·L-1+U0126 15 μmol·L-1.±s,n=9.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with HG group;ΔΔP<0.01,compared with HG+PF 350 μmol·L-1group.
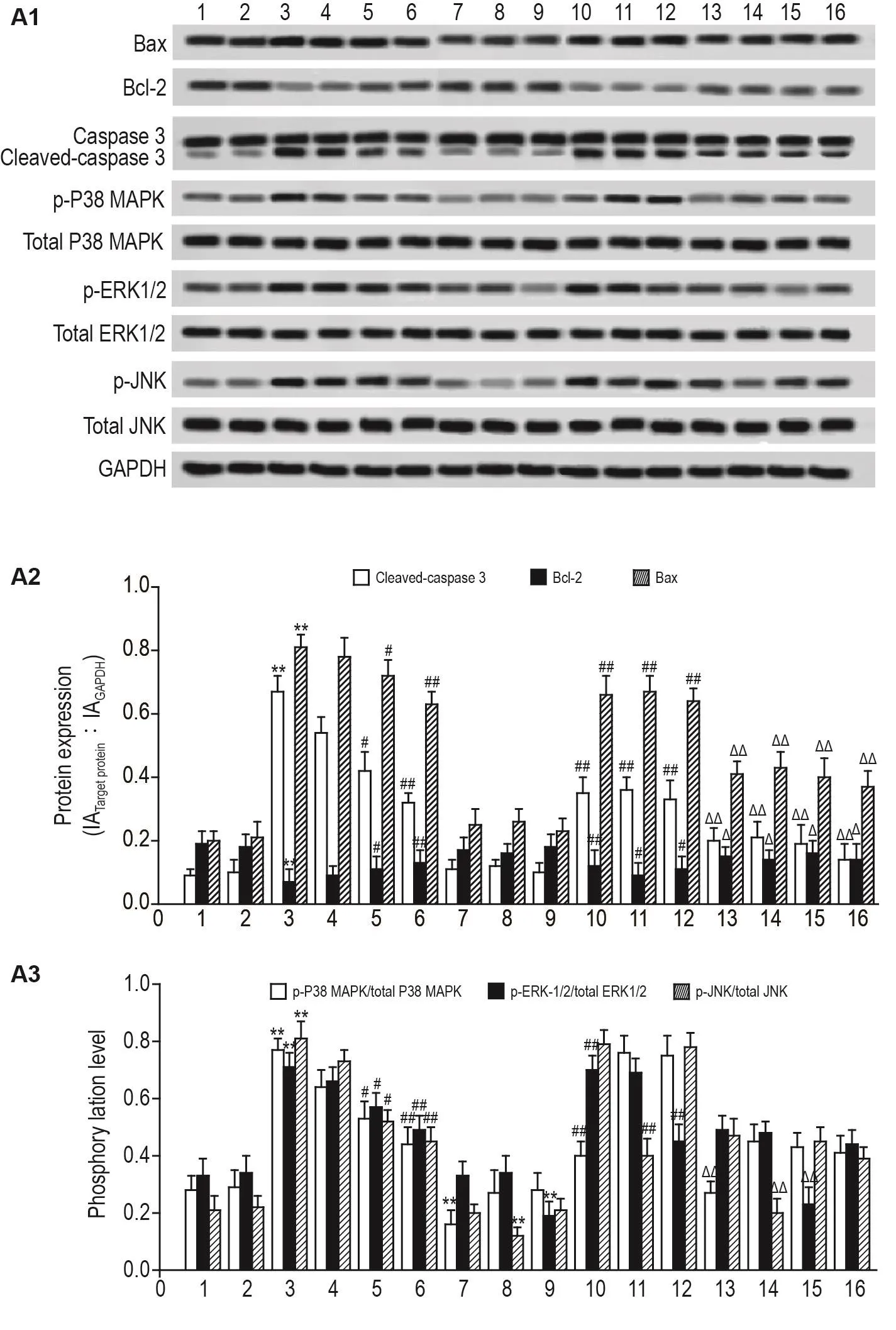
Fig.2 Effect of PF on protein expressions of cleaved-caspase 3,Bax and Bcl-2,and phosphorylation levels of P38 mitogen-activated protein kinase(P38 MAPK),extracellular signal-regulated protein kinase(ERK)1/2 and c-Jun N-terminal kinase(JNK)of H9c2 cells induced by HG detected by Western blotting.See Tab.1 for the cell treatment.A2 and A3 were the semi-quantitative results of A1,respectively.1:cell control;2:PF 350 μmol·L-1;3:HG;4:HG+PF 250 μmol·L-1;5:HG+PF 300 μmol·L-1;6:HG+PF 350 mmol·L-1;7:SB203580 3 mmol·L-1;8:SP600125 10 mmol·L-1;9:U0126 15 μmol·L-1;10:HG+SB203580 3 μmol·L-1;11:HG+SP600125 10 μmol·L-1;12:HG+U0126 15 μmol·L-1;13:HG+PF 350 μmol·L-1+SB203580 3 μmol·L-1;14:HG+PF 350 μmol·L-1+SP600125 10 μmol·L-1;15:HG+PF 350 μmol·L-1+U0126 15 μmol·L-1;16:HG+SB203580 3 μmol·L-1+SP600125 10 μmol·L-1+U0126 15 μmol·L-1.±s,n=9.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with HG group;ΔΔP<0.01,compared with HG+PF 350 mmol·L-1group.
3 讨论
本研究发现,PF 300和350 μmol·L-1显著增强HG诱导的H9c2细胞存活率,降低HG诱导的H9c2细胞凋亡率,下调活化胱天蛋白3蛋白表达水平和Bax/Bcl-2比值,降低P38 MAPK,ERK1/2和JNK蛋白磷酸化水平,但对正常H9c2细胞的细胞活性和凋亡并无影响。单独 SB203580 3 μmol·L-1,SP600125 10 μmol·L-1或 U0126 15 μmol·L-1同样可显著增强HG诱导的H9c2细胞活性,减少HG诱导的H9c2细胞凋亡率,下调活化胱天蛋白酶3蛋白表达水平和Bax/Bcl-2比值,对正常H9c2细胞存活率和凋亡无影响。PF 350 μmol·L-1分别与SB203580 3 μmol·L-1,SP600125 10 μmol·L-1和U0126 15 μmol·L-1联用,可显著增强 HG诱导的H9c2细胞活性,减少HG诱导的H9c2细胞凋亡率,下调蛋白表达水平和Bax/Bcl-2比值。
MAPK是信号从细胞表面传导到细胞核内部的重要传递者,响应各种细胞刺激如细胞因子、神经递质、激素、细胞应激及细胞黏附等调节细胞信号转导[10]。目前,哺乳动物中发现,MAPK信号通路主要分为3类:P38 MAPK,ERK1/2和JNK[11]。据报道,HG可以在人视网膜色素上皮细胞和大鼠系膜细胞中激活MAPK信号通路[12-13]。且已有研究表明,HG激活了H9c2细胞中MAPK信号通路[14]。同前人研究结果相一致,本文研究结果亦显示,HG显著增强了P38 MAPK,ERK1/2和JNK的蛋白磷酸化水平,表明HG激活了H9c2细胞中MAPK信号通路。已有研究表明,PF通过抑制P38 MAPK和JNK信号通路保护胰腺β细胞免受链脲佐菌素诱导的损伤[15],PF通过调节自发性高血压大鼠的MAPK信号通路,改善压力过负荷诱导的心脏重构[16]。故推测PF具有抑制MAPK信号通路激活的作用。本研究结果显示,PF显著下调了P38 MAPK,ERK1/2和JNK的蛋白磷酸化水平,说明PF抑制HG诱导H9c2细胞中MAPK信号通路激活。已有研究表明,外源性HS通过抑制P38 MAPK通路的激活保护H9c2细胞不受HG诱导损伤[17]。为了验证PF对HG诱导H9c2细胞的保护作用与抑制MAPK通路激活可能有关,本研究分别用P38 MAPK的选择性抑制剂SB203580、ERK1/2选择性抑制剂U0126、JNK选择性抑制剂SP600125处理H9c2细胞。结果表明,SB203580 3 μmol·L-1,SP600125 10 μmol·L-1和 U0126 15 μmol·L-1同PF 350 μmol·L-1一样,显著增强HG诱导的H9c2细胞活性,减少HG诱导的H9c2细胞凋亡率,下调活化胱天蛋白酶3及Bax/Bcl-2的表达,但对正常H9c2细胞的细胞活性和凋亡并无影响。PF 350 μmol·L-1与 SB203580 3 μmol·L-1,SP600125 10 μmol·L-1或 U0126 15 μmol·L-1联用后效果更加显著。因此,PF通过抑制MAPK通路活化有效缓解HG诱导的H9c2细胞毒性损伤。
综上所述,PF对HG诱导的H9c2细胞损伤具有保护作用,其机制可能是通过抑制MAPK通路激活来抑制HG诱导的H9C2细胞毒性和细胞凋亡。这为进一步研究PF对糖尿病性心血管并发症的细胞保护作用以及确定高血糖症引起的心肌细胞损伤的新机制提供了重要的基础。本研究为从细胞实验初步探讨PF对HG诱导H9c2心肌细胞损伤作用机制,更为详细的分子通路机制及动物体内实验还待进一步研究。

