交通相关细颗粒物PM2.5诱导大鼠脾细胞凋亡及其机制
王 丹,乔果果,2,张志红
(山西医科大学公共卫生学院1.环境卫生学教研室,2.教学实验中心,山西 太原 030001)
随着城市交通的发展,汽车尾气已成为重要的细颗粒物PM2.5来源之一。流行病学调查显示,PM2.5浓度升高,会增加呼吸系统损伤、心血管疾病和神经系统退化性疾病等发生[1]。研究表明,PM2.5的免疫毒性是造成以上健康问题的重要原因之一[2]。HE等[3]发现,PM2.5可诱导免疫细胞积聚,增加炎症因子的分泌,并通过血液循环加剧免疫反应。本课题组前期研究发现,大鼠肺泡巨噬细胞吞噬功能、脾T淋巴细胞增殖功能和体液免疫水平随着PM2.5暴露水平的增加而下降,表明PM2.5侵入机体后会导致大鼠免疫功能下降[4]。脾是人体最大的外周免疫器官,含有丰富的巨噬细胞及T和B淋巴细胞,直接参与机体免疫反应,可消除病原体并产生抗体,在整个免疫系统中具有至关重要的作用。然而,PM2.5对脾的免疫毒性及潜在机制仍不清楚。
凋亡是在各种生理和病理条件下观察到的一种细胞死亡,参与免疫反应、细胞内环境稳定和炎症反应[5]。免疫细胞凋亡,如脾细胞凋亡,可能会降低机体对病原体的清除能力,导致免疫耐受。此外,凋亡的脾细胞本身也可通过分泌抗炎细胞因子并抑制促炎细胞因子分泌,削弱宿主对感染的反应能力,降低机体免疫力[6]。PM2.5可促进细胞凋亡,柴油废气颗粒物诱导细胞内氧化应激,导致毛细血管内皮细胞凋亡[7]。本课题组前期研究发现,交通相关PM2.5可上调胱天蛋白酶3、细胞色素c(cytochrome c,Cyt-c)和Bcl-2蛋白表达,从线粒体途径诱导大鼠脾细胞凋亡[8]。本研究观察交通相关PM2.5对大鼠脾组织的免疫病理改变,研究其对脾细胞凋亡的影响及其有关调控信号,为进一步研究大气污染的免疫毒性机制提供依据。
1 材料与方法
1.1 试剂和仪器
TUNEL细胞凋亡检测试剂盒和免疫组化试剂盒(美国Cell Signaling Technology公司),TH1000CII型智能大流量颗粒物采样器和PM2.5切割头(武汉天虹公司),玻璃纤维滤膜(泰山公司),DNA Marker(北京天根生化科技有限公司),兔抗大鼠P38 MAPK、JNK单克隆抗体和大鼠抗兔IgG抗体(美国Cell Signaling Technology公司)。
1.2 PM2.5采集和处理
将玻璃纤维滤膜在马弗炉中400℃烘烤6 h后置干燥器中平衡24 h。在太原市城区车流量较大的交通路口,用装有PM2.5切割头的智能大容量空气总悬浮颗粒物采样器采集PM2.5。采样时间为2008年3~4月,时间段为7∶00-19∶00,采样高度为1.5 m。同时记录温度、湿度和采样体积。采样后的滤膜在干燥器中平衡24 h后裁剪成1 cm×1 cm,浸入去离子水中超声振荡3次,每次20 min,洗脱PM2.5,滤液经真空冷冻干燥后获得PM2.5干粉,-20℃保存备用。
1.3 动物、分组和染毒
24只雄性SD大鼠,体质量180~200 g(山西医科大学动物实验中心),按体质量随机分为4组:生理盐水对照组、PM2.51.5,6.0和24.0 mg·kg-1组。大鼠在清洁动物房适应饲养1周后,生理盐水对照组气管滴注0.9%生理盐水,染毒组分别气管滴注PM2.51.5,6.0和24.0 mg·kg-1混悬液,隔天滴注1次,共6次。在最后一次滴注24 h后,乙醚麻醉,腹主动脉放血处死大鼠,取材测定相应指标。
1.4 HE染色观察肺和脾组织病理变化
取1.3分组大鼠部分肺和脾,用10%甲醛固定,石蜡包埋切片(5 μm),常规方法脱蜡,进行HE染色,显微镜下观察肺和脾组织病理改变。
1.5 透射电镜观察脾细胞结构
取1.3分组大鼠部分脾,冰浴上切割成1 mm3,置1.25%戊二醛溶液,4℃固定24 h,经脱水、包埋、切片和染色等步骤制成电镜标本,用透射电子显微镜观察脾细胞凋亡的超微结构。
1.6 脾细胞凋亡检测
1.6.1 琼脂糖凝胶电泳法
取1.3分组大鼠脾组织,参考传统方法提取DNA[9],提取的DNA用1.5%琼脂糖凝胶、30 V电压电泳2 h后,紫外灯下观察DNA条带。
1.6.2 TUNEL法
将1.4脾组织切片经脱蜡、水化,蛋白酶K抗原修复后,按TUNEL试剂盒步骤对切片进行染色,中性树胶封片,显微镜观察、拍照、计算凋亡率。每张切片随机观察6个非重叠视野,采用Image-Pro Plus 6.0分析阳性着色细胞数和细胞总数,细胞凋亡率(%)=阳性细胞数/细胞总数×100%。
1.7 免疫组化测定脾细胞c-Jun N端激酶(c-Jun N-terminal kinase,JNK)和P38促分裂原活化的蛋白激酶(P38 mitogen-activated protein kinase,P38 MAPK)蛋白表达水平
将1.4大鼠脾组织石蜡切片55℃烘烤12 h,经脱蜡和水化后,枸橼酸钠缓冲溶液高温高压修复。PBS洗3次,每次2 min,山羊血清37℃封闭20 min,加一抗(兔抗大鼠JNK和P38 MAPK单抗,1∶25稀释),4℃过夜。37℃复温1 h,PBS洗3次,每次2 min,加二抗(大鼠抗兔IgG抗体,1∶100稀释),37℃孵育40 min,PBS洗4次,每次5 min。DAB显色10 min,流水冲洗终止显色,中性树胶封片,显微镜拍照,Image-Pro Plus 6.0图像分析蛋白相对表达水平。用积分吸光度(integrated absorbance,IA)值表示蛋白相对表达水平。
1.8 统计学分析
2 结果
2.1 交通相关PM2.5暴露对大鼠肺和脾组织的影响
2.1.1 HE染色
图1A显示,生理盐水对照组肺组织支气管和肺泡结构较为完整,充血不明显。PM2.51.5 mg·kg-1组大鼠肺泡扩张,肺泡壁变薄,部分断裂融合造成肺气肿病变。PM2.56.0 mg·kg-1组大鼠肺组织可见支气管上皮细胞排列紊乱,炎症细胞浸润,纤毛坏死脱落,支气管损伤加剧。PM2.524.0 mg·kg-1组大鼠肺组织出现大量炎症细胞浸润,支气管黏膜上皮脱落、管壁平滑肌断裂,肺泡壁充血水肿和肺泡腔萎缩(肺不张)。
图1B显示,生理盐水对照组脾白髓发达,与红髓分界清楚,脾小结呈圆形或椭圆形,散在于红髓中;PM2.5染毒组均出现不同程度红白髓分界不清,结构紊乱呈小团块状,淋巴细胞密度降低等病变,PM2.56.0和24.0 mg·kg-1组可见少量散在固缩核及核碎片。
2.1.2 透射电镜
透射电镜结果显示(图2),生理盐水对照组脾淋巴细胞和巨噬细胞形态正常,线粒体和内质网未见明显改变。PM2.51.5 mg·kg-1组线粒体空泡化,且边缘不光滑;PM2.56.0 mg·kg-1组脾淋巴细胞核膜断裂,胞浆空泡化,内质网断裂,核糖体脱落;PM2.524 mg·kg-1组脾淋巴细胞核内染色质边集,核断裂成碎片,形成大量的凋亡小体,内质网断裂,线粒体空泡化,巨噬细胞增多。
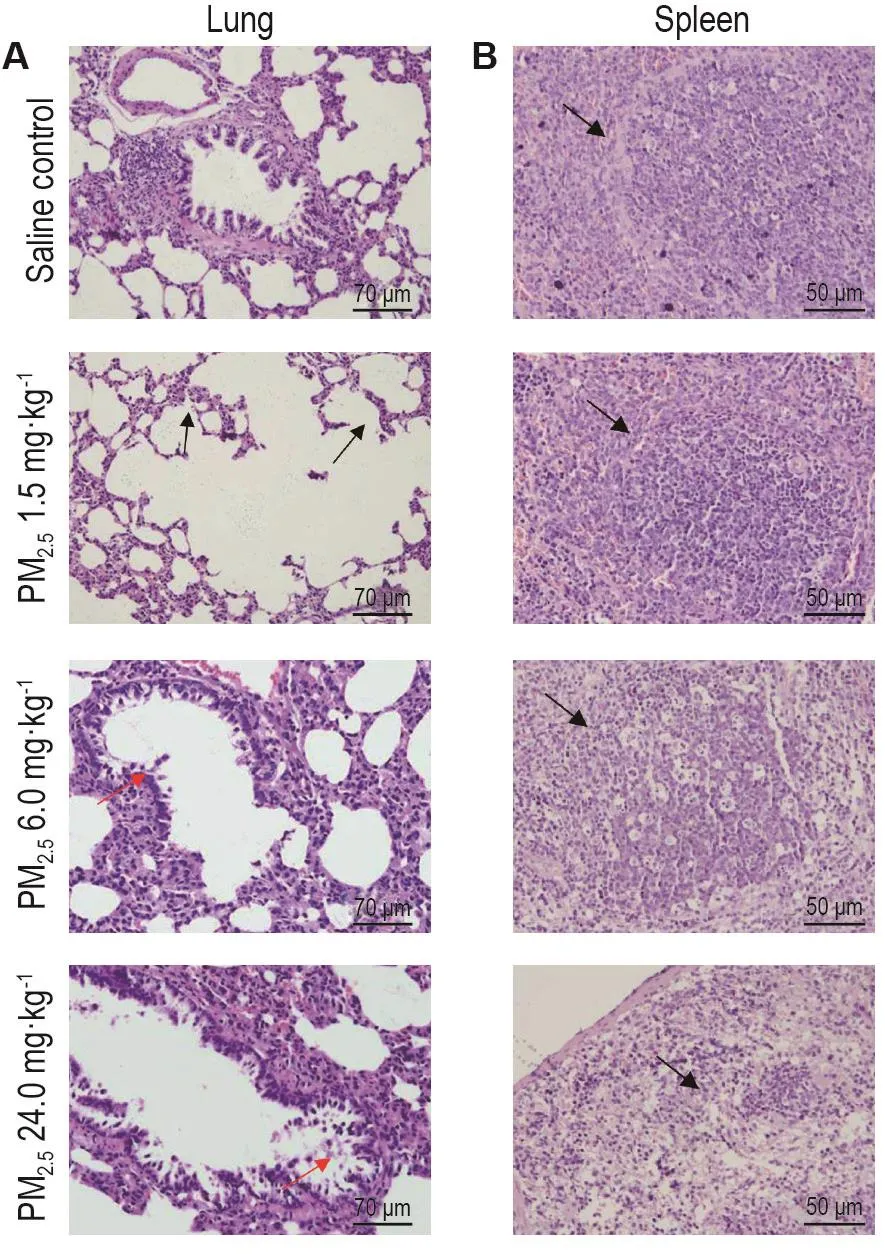
Fig.1 Effect of traffic-related particulate matter 2.5(PM2.5)exposure on histopathological changes in lungs and spleens of rats by HE staining.Rats were exposed to saline or traffic-related PM2.5at dose of 1.5,6.0 and 24.0 mg·kg-1 every other day for six times.A:the black arrows indicate thin and ruptured alveolar walls.Inflammatory infiltration and epithelial cells desquamating in peribronchial areas are represented by red arrows.B:the black arrows show the white pulp in spleen tissue of saline or traffic-related PM2.5treated rats.

Fig.2 Effect of traffic-related PM2.5exposure on ultrastructure of spleenocytes of rats.See Fig.1 for the rat treatment.The spleen tissues were observed under electron microscope.The black arrows show the lymphocyte in spleen tissues.
2.2 交通相关PM2.5暴露对大鼠脾细胞凋亡的影响
2.2.1 琼脂糖凝胶电泳
如图3显示,生理盐水对照组和PM2.51.5 mg·kg-1组脾细胞核DNA未见梯状条带,PM2.56.0 mg·kg-1组有微弱梯状条带,PM2.524.0 mg·kg-1组出现明显梯状条带。表明交通相关PM2.5可诱导大鼠脾细胞凋亡。
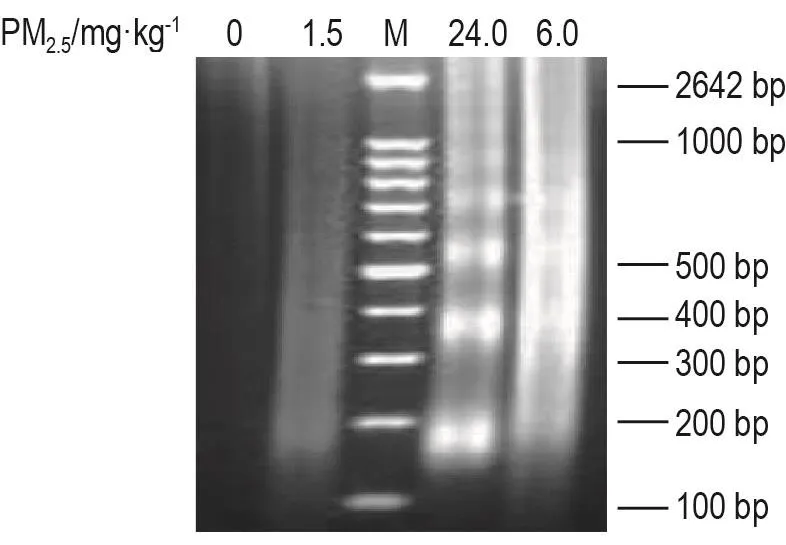
Fig.3 Effect of traffic-related PM2.5exposure on spleenocytes apoptosis of rats by DNA ladder assay.See Fig.1 for the rat treatment.
2.2.2 TUNEL
图4显示,与生理盐水对照组相比,PM2.51.5,6.0和24.0 mg·kg-1组脾细胞凋亡率显著上升。表明PM2.5可显著促进大鼠脾细胞凋亡(P<0.01)。
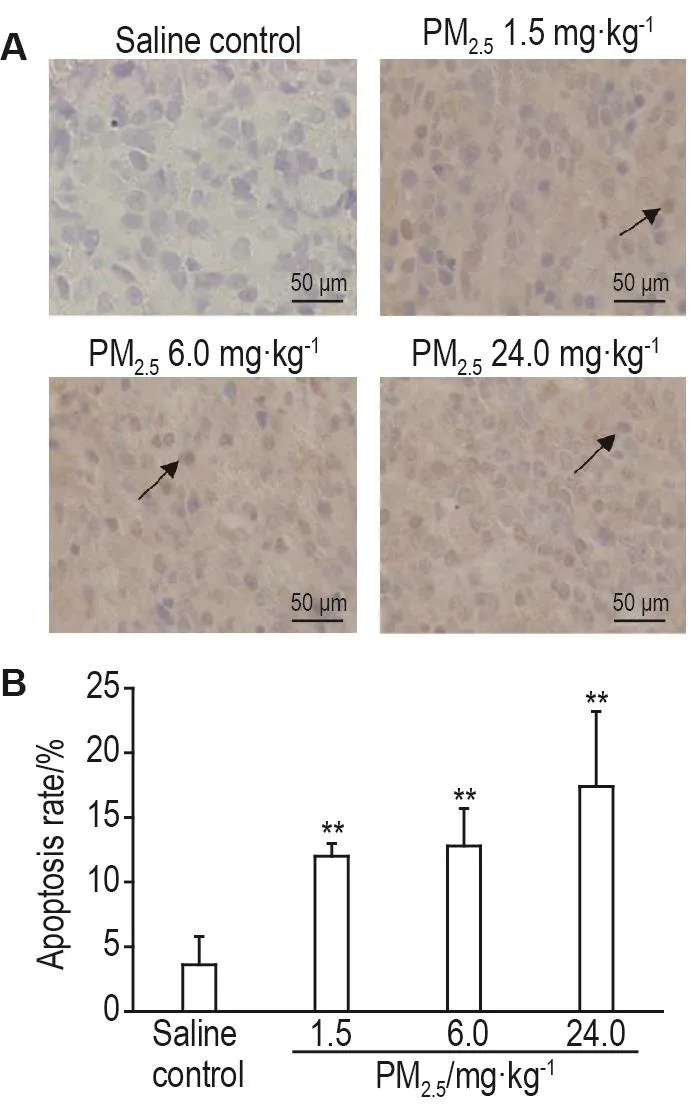
Fig.4 Effect of traffic-related PM2.5exposure on spleenocytes apoptosis of rats.See Fig.1 for the rat treatment.The black arrows indicate apoptosis of spleen cells.B was the semi-quantitative result of A.±s,n=6.**P<0.01,compared with saline control group.
2.3 交通相关PM2.5暴露对大鼠脾细胞JNK和P38 MAPK蛋白表达水平的影响
免疫组化分析结果(图5)显示,与生理盐水对照组相比,PM2.56.0和24.0 mg·kg-1组脾细胞JNK蛋白表达显著增高(P<0.01);与PM2.51.5和6.0 mg·kg-1组相比,PM2.524.0 mg·kg-1组JNK蛋白表达水平明显升高(P<0.01)。与生理盐水对照组相比,PM2.524.0 mg·kg-1组P38 MAPK蛋白表达水平显著升高(P<0.01)。
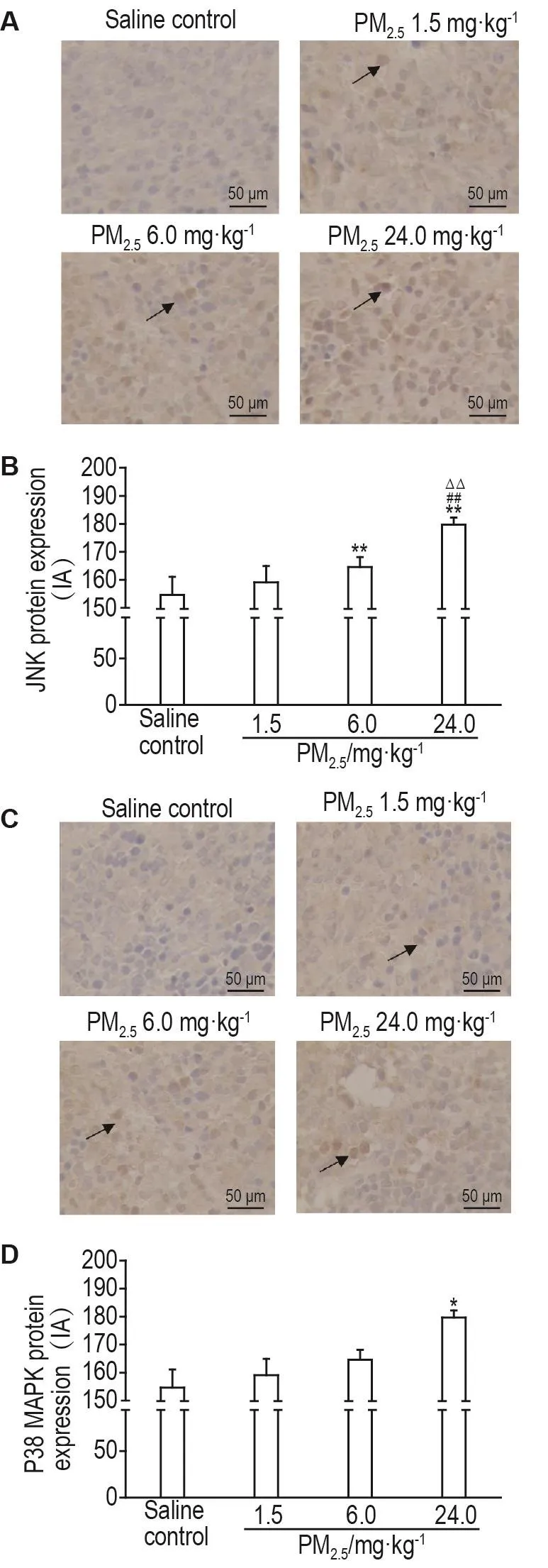
Fig.5 Effect of traffic-related PM2.5exposure on protein expressions of c-Jun N-terminal kinase(JNK)(A,B)and P38 mitogen-activated protein kinase(P38 MAPK)(C,D)in spleenocytes of rats by immunohistochemical analysis.See Fig.1 for the rat treatment.JNK and P38 MAPK positive staining was expressed in the spleen,as indicated by black arrows.B and D were the semi-quantitative results of A and C,respectively.IA:integrated absorbance.±s,n=6.*P<0.05,**P<0.01,compared with saline control group;##P<0.01,compared with PM2.51.5 mg·kg-1group;△△P<0.05,compared with PM2.56.0 mg·kg-1group.
3 讨论
本研究发现,PM2.5亚急性染毒后,大鼠肺部出现支气管炎症、肺气肿、肺泡腔萎陷等病变,表明PM2.5暴露可加剧肺部炎症反应,引起肺损伤。郭翔等[10]研究发现,PM2.5可通过促进炎症因子释放,导致细胞膜损伤,诱导巨噬细胞死亡,进一步证实了PM2.5的炎性损伤作用。同时过量表达的活性氧,也可对巨噬细胞DNA、RNA和蛋白质结构造成损害,破坏正常的细胞周期,引起凋亡,并导致细胞存活率降低[10],大鼠肺泡巨噬细胞的吞噬功能随着PM2.5染毒剂量的增加而降低[4],提示PM2.5对包括巨噬细胞在内的免疫系统造成损伤。
免疫系统在许多病理状态中具有重要的作用。脾是人体最大的外周免疫器官,参与全身免疫反应,被认为是整个免疫系统的重要基础性器官。其与巨噬细胞、T和B淋巴细胞一样,参与病原体的消除和抗体的产生[11]。GUO等[12]发现,PM2.5对脾具有潜在的毒作用,暴露于PM2.5可显著降低大鼠脾系数,导致脾肿大,影响免疫反应。PM2.5可引起脾淋巴鞘萎缩,白髓和红髓分界不清,淋巴细胞形态异常等改变,导致脾功能异常,体液免疫能力下降[13]。本研究结果显示,随着PM2.5染毒剂量增加,大鼠脾白髓减少,结构紊乱,且淋巴细胞密度下降,表明PM2.5可损伤脾组织,影响机体免疫功能。
细胞凋亡在生物体进化、内环境稳定及多个系统的发育中十分重要,且凋亡过程的紊乱与疾病的发生发展具有直接或间接的关联[14]。研究发现,PM2.5可通过诱导氧化应激,激活内质网应激和自噬信号通路,促进脾细胞凋亡,导致脾功能损伤[15]。颗粒物中的炭黑成分可促使脾启动免疫反应,导致胸腺细胞凋亡[16]。交通相关PM2.5可从线粒体途径诱导脾细胞凋亡[8]。本研究结果显示,大鼠脾组织的超微结构出现淋巴细胞核膜断裂、凋亡小体、胞浆空泡化、内质网断裂等病变,提示PM2.5破坏了脾淋巴细胞结构,并引起细胞凋亡。TUNEL结果表明,PM2.51.5,6.0 和24.0 mg·kg-1组脾细胞凋亡率均高于生理盐水对照组。经琼脂糖凝胶电泳,PM2.524.0 mg·kg-1脾细胞DNA断裂,出现180~200 bp整倍数的DNA片断,呈现出凋亡细胞特征性的梯状条带,其与TUNEL结果一致,表明交通相关PM2.5可诱导脾细胞凋亡。
研究报道,JNK/P38 MAPK信号通路与细胞凋亡密切相关,如激活JNK/P38 MAPK信号通路可促进心肌细胞凋亡,抑制JNK/P38 MAPK信号通路可改善心肌细胞凋亡[17]。TIAN 等[18]发现,ERK/P38 MAPK/JNK通路在B[a]P介导的淋巴细胞凋亡和免疫调控中具有重要的作用。本研究发现,JNK和P38 MAPK蛋白表达水平随着PM2.5染毒剂量的增加而增加,推测JNK/P38 MAPK信号通路可能与PM2.5诱导脾细胞凋亡有关。
综上所述,交通相关PM2.5可引起脾细胞凋亡,JNK/P38 MAPK信号通路可能与诱导脾细胞凋亡相关,参与免疫系统的损伤。

