硝酸镧诱导SK-N-SH细胞氧化应激和自噬的作用
来丽叶,智翠娜,傅娟玲,赵 鹏,姚碧云
(北京大学公共卫生学院毒理学系,食品安全毒理学研究与评价北京市重点实验室,北京 100191)
稀土因其独特的理化性质,被广泛应用于畜牧业,工业,电子和医药等行业,致使土壤、饮用水和食物中均可检出较高含量的稀土元素,最终通过皮肤、消化道和呼吸道等多种途径进入人体,并通过血液分布于多种组织器官内[1]。流行病学研究发现,高暴露稀土矿区儿童的学习认知能力显著下降,其神经毒性及其机制得到人们的普遍关注[2-3]。镧(lanthanum,La)作为轻稀土元素的代表,化学性质活泼,具有较强的生物活性,从而广泛应用于各领域,同时稀土元素盐类中硝酸盐类毒性最强,因此硝酸镧〔La(NO3)3〕是研究稀土毒作用的代表物质[4-5]。有研究表明,稀土镧可通过血脑屏障使动物海马功能受损,并诱导神经元产生氧化应激及凋亡等,表明La可以在脑中蓄积并发挥毒性作用[6]。
有研究发现,稀土元素所致中枢神经系统损伤可能与氧化应激有关[7]。正常情况下,活性氧(reactive oxygen species,ROS)的生成速度受线粒体膜电位的控制,当ROS产生过多时,可氧化线粒体通透性转化孔(mitochondrial permeability transition pore,MPTP)上相应的氧化还原敏感位点,导致线粒体膜电位下降及线粒体膜通透性的增加,从而引起线粒体功能障碍[8]。细胞自噬是真核生物中依赖溶酶体对错误折叠的蛋白和细胞器进行降解的重要途径,以维持细胞结构、代谢和功能的稳定[9-10]。根据自噬对底物的选择可分为选择性和非选择性自噬,线粒体自噬是特异性清除受损线粒体的过程。有研究发现,细胞自噬和PTEN诱导的假定激酶1(PTEN-induced putative kinase 1,PINK1)/Parkin介导的线粒体自噬在多种神经疾病中发挥重要作用,其早期可能具有保护效应,而晚期可能引起神经细胞损伤及凋亡[11]。本研究以人神经母细胞瘤(SK-N-SH)细胞为研究对象,观察La(NO3)3对神经细胞氧化应激、线粒体膜电位和自噬的影响以及镧的神经毒性机制。
1 材料与方法
1.1 试剂和主要仪器
La(NO3)3·6H2O、胰蛋白酶和二甲亚砜(DMSO)(美国Sigma公司),DMEM培养基和胎牛血清(美国Gibco公司),噻唑蓝(MTT)和质粒DNA小量提取试剂盒(美国Genview公司),过氧化氢(H2O2)、碳酰氰基-对-氯苯腙(carbonyl cyanide m-chlorophenylhydrazone,CCCP)、ROS 检测试剂盒和JC-1线粒体膜电位检测试剂盒(北京鼎国昌盛生物有限公司),兔抗人微管相关蛋白1轻链3(micro-tubule associated protein 1 light chain 3,LC3)和P62单抗(美国Abcam公司),兔抗人Parkin单抗和小鼠抗人PINK1单抗(美国Cell Signaling Technology公司),小鼠抗人β肌动蛋白单抗、辣根过氧化物酶标记的山羊抗兔IgG和山羊抗小鼠IgG抗体(北京中杉金桥生物技术有限公司)。
MCo-15AC CO2培养箱(日本Sanyo公司),FACS Calibur双激光流式细胞仪(美国BD公司),TCS SP8 MP FLIM激光共聚焦显微镜系统(德国Leica公司),垂直板蛋白电泳及转印装置(北京六一仪器),Tanon 4500数码凝胶图像处理系统(上海天能公司)。
1.2 SK-N-SH细胞培养
SK-N-SH细胞(中国医学科学院基础医学研究所基础医学细胞中心)在37℃,5% CO2饱和湿度条件下,培养于含10%胎牛血清的DMEM培养液中,观察细胞生长情况,并定期按比例传代。
1.3 MTT法检测SK-N-SH细胞存活率
将SK-N-SH细胞以8×107L-1密度接种于96孔板中,每孔100 μL。La(NO3)30.125,0.25,0.5,1.0,2.0和4.0 mmol·L-1处理细胞24 h,同时设细胞对照组。每孔加MTT 1.0 mmol·L-1溶液100 μL,培养4 h后形成蓝紫色结晶,弃上清并加DMSO 100 μL,置摇床上振荡5 min使结晶完全溶解。在酶标仪570 nm波长处检测各孔吸光度(A570nm)值。细胞存活率(%)=处理组A570nm/细胞对照组A570nm×100%。
1.4 细胞分组
将生长状态良好的对数期细胞消化成单细胞悬液,以3×108L-1密度接种于6孔板中,每孔2 mL。结合 1.3 实验结果,选取 La(NO3)30.5,1.0 和2.0 mmol·L-1处理SK-N-SH细胞24 h,同时设细胞对照组,进行后续指标的检测。
1.5 流式细胞术检测SK-N-SH细胞内活性氧含量
细胞处理同1.4,同时设阳性对照H2O2600 μmol·L-1组,处理30 min。胰酶消化收集细胞,预冷PBS清洗2次后,加DCFH-DA 10 μmol·L-1的无血清培养液2 mL,恒温箱中培养30 min后将细胞重悬于300 μL PBS,转移至流式专用测定管,在激发波长502 nm,发射波长530 nm附近,流式细胞仪检测细胞内荧光强度以表示ROS相对含量,每组至少收取10 000个细胞。
1.6 流式细胞术检测SK-N-SH细胞线粒体膜电位
细胞处理同1.4,同时设阳性对照CCCP 10 μmol·L-1组,处理 30 min。胰酶消化并收集细胞,预冷PBS清洗2次,每组重悬于0.5 mL细胞培养液中(含血清和酚红),再加入0.5mL JC-1工作液(1×),37℃恒温箱内孵育30 min。JC-1染色缓冲液(1×)洗涤细胞2次后,300 μL JC-1染色缓冲液(1×)重悬细胞,流式细胞仪检测结果中,横坐标代表绿色荧光强度,纵坐标代表红色荧光强度。发出绿色荧光的细胞所占比例表示相对线粒体膜电位,同时两者成反比。每组至少收取10 000个细胞。
1.7 激光共聚焦显微镜下观察自噬体
无菌环境下,绿色荧光标记的LC3质粒转化复苏后的DH5α感受态细胞,LB培养基过夜振荡培养,质粒DNA提取试剂盒提取细菌培养液中的高纯度质粒DNA。将细胞以3×108L-1密度接种于激光共聚焦皿中培养24 h,将2 μg质粒DNA稀释于100 μL Opti-MEM中,充分混匀后制成DNA稀释液,然后加2 μL NeofectTM,混匀并静止30 min,最终将转染复合物加入细胞培养液中混匀培养24 h。细胞分组处理见1.4,激光共聚焦显微镜下每组别至少选取50个细胞,观察细胞内自噬体数量。
1.8 Western印迹法检测自噬相关蛋白表达水平
细胞处理同1.4,采用RIPA裂解液提取细胞全蛋白,Bradford法测定各蛋白样品的浓度,与5×SDS加样缓冲液以4∶1混合后,水浴煮沸5 min变性。取等量蛋白样品(30 μg)经12% SDS-PAGE凝胶电泳分离,湿式电转法将蛋白转移至硝酸纤维素膜(NC膜),丽春红染色后根据分子marker准确切取所需条带。室温封闭2 h后,依次加LC3,P62,Parkin和PINK1一抗(1∶500),4℃过夜。TBST清洗后加入二抗(1∶1000)室温孵育2 h,ECL化学发光后于暗室内依次曝光、显影及定影。Image J软件分析各条带积分吸光度值,以目的蛋白与内参蛋白的积分吸光度值比值表示蛋白表达水平。
1.9 统计学分析
2 结果
2.1 硝酸镧对SK-N-SH细胞存活率的影响
MTT结果显示(表1),与细胞对照组相比,La(NO3)3≤0.5 mmol·L-1组细胞存活率无明显改变,La(NO3)31.0,2.0和4.0 mmol·L-1组细胞存活率均显著低于细胞对照组(P<0.05,P<0.01)。La(NO3)3的半数抑制浓度(half inhibitory concentration,IC50)为(2.54±0.37)mmol·L-1,本研究最终选取La(NO3)30.5,1.0和2.0 mmol·L-1进行后续实验。
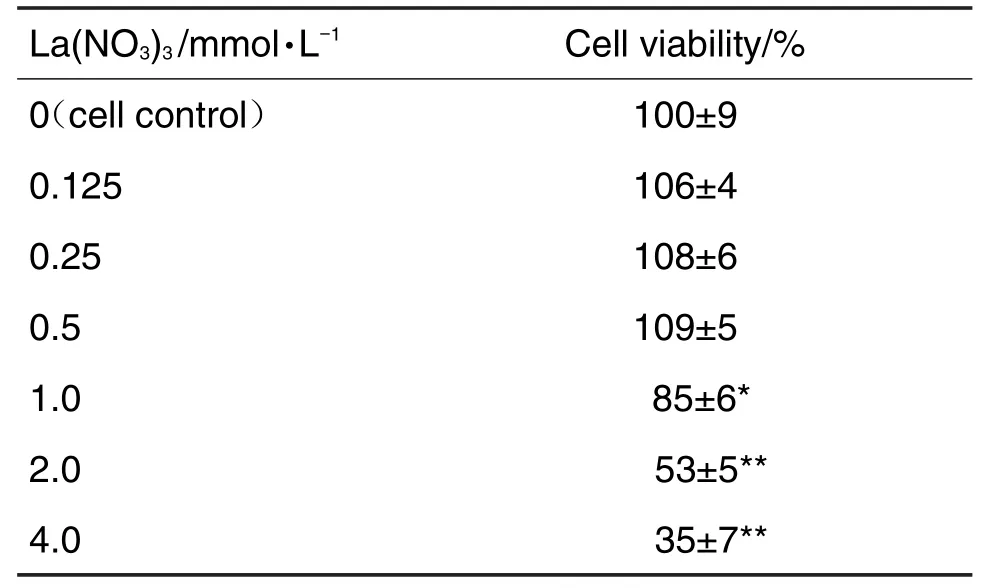
Tab.1 Effect of lanthanum nitrate〔La(NO3)3〕on cell viability of SK-N-SH cells by MTT assay
2.2 硝酸镧对SK-N-SH细胞内ROS含量的影响
流式细胞术结果显示(图1),与细胞对照组相比,La(NO3)30.5 mmol·L-1组ROS含量无显著改变,La(NO3)31.0和2.0 mmol·L-1组及H2O2阳性对照组SK-N-SH细胞内ROS含量均显著升高(P<0.05,P<0.01)。
2.3 硝酸镧对SK-N-SH细胞线粒体膜电位的影响
流式细胞术结果显示(图2),与细胞对照组(10±4)%相比,La(NO3)30.5,1.0和2.0 mmol·L-1组及阳性对照CCCP 10 μmol·L-1组呈绿色荧光的细胞比例分别为(15±4)%,(23±4)%,(24±3)%和(30±6)%,表明各处理组细胞膜电位均显著降低(P<0.05,P<0.01)。
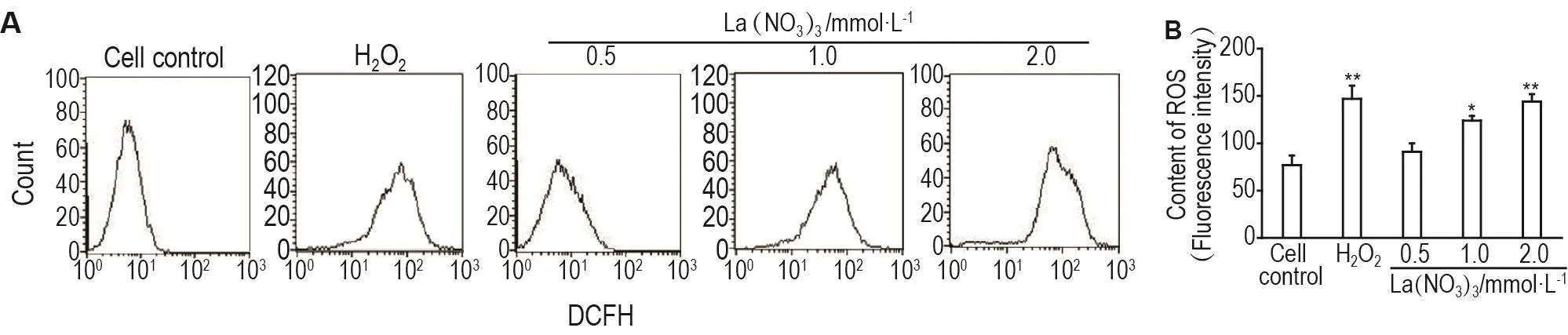
Fig.1 Effect of La(NO3)3on content of reactive oxygen species(ROS)in SK-N-SH cells by flow cytometry(FCM).The cells were treated with La(NO3)30.5,1.0 and 2.0 mmol·L-1for 24 h and also treated with H2O2600 μmol·L-1for 30 min as positive control.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.

Fig.2 Effect of La(NO3)3on mitochondrial membrane potential in SK-N-SH cells by FCM.The cells were treated with La(NO3)30.5,1.0 and 2.0 mmol·L-1for 24 h and also treated with carbonyl cyanide m-chlorophenylhydrazone(CCCP)10 μmol·L-1 for 30 min as positive control,then cells were analyzed by FCM after being stained with JC-1.The proportion of cells emitting green fluorescence was inversely proportional to the relative mitochondrial membrane potential.x ± s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.4 硝酸镧对SK-N-SH细胞自噬体数量的影响
激光共聚焦结果显示(图3),细胞对照组绿色荧光多呈弥散分布,自噬体数量较少,为(11±5)%,而La(NO3)30.5,1.0和2.0 mmol·L-1处理组细胞内自噬体数量明显增加,数量分别为(31±7),(38±5)和(42±4),均显著高于细胞对照组(P<0.05,P<0.01)。

Fig.3 Effect of La(NO3)3on number of autophagosomes in SK-N-SH cells by laser scanning confocal microscope.The cells were transfected with green fluorescent protein-labeled micro-tubule associated protein 1 light chain 3(LC3)plasmid for 24 h,then cells were treated with La(NO3)3 0.5,1.0 and 2.0 mmol·L-1for 24 h.Arrows show the autophagosomes.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.5 硝酸镧对自噬相关蛋白LC3,P62,Parkin和PlNK1蛋白表达水平的影响
Western印迹结果显示(图4),与细胞对照组相比,La(NO3)30.5,1.0和2.0 mmol·L-1处理组细胞内LC3-Ⅱ/Ⅰ比值、Parkin和PINK1蛋白表达明显升高(P<0.05),P62蛋白表达显著降低(P<0.05)。
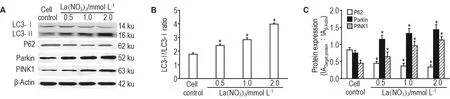
Fig.4 Effect of La(NO3)3on protein expressions of LC3,P62,Parkin and PTEN-induced putative kinase 1(PlNK1)and ration LC3-Ⅱ/LC3Ⅰ in SK-N-SH cells by Western blotting.The cells were treated with La(NO3)30.5,1.0 and 2.0 mmol·L-1for 24 h.B and C were the semi-quantitative results of A.±s,n=3.*P<0.05,compared with cell control group.
3 讨论
本研究结果显示,La(NO3)3≥1.0 mmol·L-1时,SK-N-SH细胞存活率显著降低,存在明显的细胞毒性。La(NO3)3可诱导细胞内ROS水平升高从而导致多巴胺能神经元的氧化损伤,并通过线粒体膜电位的降低从而诱导线粒体功能障碍,同时可增强SK-N-SH细胞自噬和线粒体自噬水平。
氧化应激是La致神经细胞功能受损的重要因素,La可使大脑皮质神经元内活性氧水平升高并导致严重的细胞形态损伤,同时可降低超氧化物歧化酶活力[12-13]。ROS可诱导MPTP由周期性开放变为持续性开放,从而导致线粒体膜电位下降及线粒体膜通透性的增加,最终诱导胱天蛋白酶级联反应和不可逆的细胞凋亡,线粒体通透性孔道的开放可进一步释放出大量ROS,加剧孔道的打开从而导致细胞和线粒体的损伤[14]。本研究结果显示,La(NO3)30.5,1.0 和2.0 mmol·L-1可诱导SK-N-SH细胞内ROS含量升高,线粒体膜电位降低,从而导致氧化应激和线粒体功能障碍。线粒体膜电位降低可进一步激活PINK1/Parkin介导的线粒体自噬,PINK1可选择性募集至损伤的线粒体表面,通过其激酶活性磷酸化下游的Parkin,损伤的线粒体被特异性包裹进自噬体中,并与溶酶体融合以完成线粒体降解的过程[15-16]。本研究结果显示,一定浓度La(NO3)3可诱导PINK1/Parkin介导的线粒体自噬的发生,从而特异性清除功能受损的线粒体。
La具有促进神经元自噬的能力,同时La能引起大鼠海马神经细胞发生过度氧化应激,产生大量ROS,从而激活相应的信号转导通路,引起下游自噬相关基因转录水平升高并增加自噬流强度[17-18]。本研究结果显示,一定浓度的La(NO3)3可诱导SK-NSH细胞自噬体数目的明显增多。但绿色自噬体斑点增多并不一定代表自噬活性增强,也有可能是自噬溶酶体降解途径受阻,可通过LC3与P62验证。自噬过程中,LC3分子构象改变,由胞浆型LC3-Ⅰ进而转变为自噬体膜型LC3-Ⅱ,P62在自噬溶酶体通路中,作为特异性底物被降解。当LC3-Ⅱ/Ⅰ升高,P62同时降低,表明自噬流通畅,当LC3-Ⅱ/Ⅰ升高,P62升高,表明自噬起始正常,但下游不通,吞噬体与溶酶体不能融合,因此LC3-Ⅱ/Ⅰ的比值及P62蛋白的表达水平可表征及衡量自噬的发生及水平[19]。本研究结果显示,一定浓度的La(NO3)3能增高SK-N-SH细胞中LC3-Ⅱ/Ⅰ比值并降低P62蛋白的表达,表明细胞自噬流通畅,La(NO3)3可增强细胞的自噬水平。
综上所述,La(NO3)3可一定程度地诱导多巴胺能神经元的氧化损伤和线粒体功能障碍并增强细胞自噬和线粒体自噬水平。确切机制及自噬对细胞作用有待进一步探讨。

