p53在低氧调控人牙周膜成纤维细胞增殖与凋亡中的作用*
王 勤 庄秀妹 何杰玉 张 叶 彭雪珍
牙周膜成纤维细胞(periodontal ligament cells,PDLCs)是牙周韧带的主要功能细胞,PDLCs数量减少与结构破坏导致牙周支持组织损伤,诱导或加重牙周组织疾病[1,2]。厌氧菌、咬合创伤、炎症以及吸烟均可造成牙周微环境的局部缺血和低氧状态,低氧可抑制人PDLCs增殖并促进其凋亡[3]。牙周炎患者牙周组织中的低氧标志蛋白——低氧诱导因子 -1α(Hypoxia inducible factor-1α,HIF-1α)水平相比正常人显著升高[4]。我们前期研究已证实,低氧可以通过激活HIF-1α调控PDLCs的增殖与凋亡[5]。
p53是关键的肿瘤抑制基因,能够抑制肿瘤细胞的增殖[6]。最新研究发现,p53在牙周炎组织中升高,并与局部组织的低氧状态相关[7]。然而,p53是否参与低氧抑制PDLCs增殖并促进其凋亡?p53与HIF-1α作用关系如何?这些均不清楚?本研究分析常氧和低氧(1%O2)下PDLCs中p53与HIF-1α表达,通过小干扰RNA敲低技术探讨p53在低氧环境下PDLCs增殖及凋亡的作用。
1.材料与方法
1.1 主要试剂及仪器 FBS、胰酶、DMEM培养基均购自Gibco公司。小鼠抗人HIF-1α、p53、GAPDH单克隆抗体、HRP标记的山羊抗小鼠二抗购于Proteintech公司;反转录试剂盒、荧光定量PCR试剂盒购自Takara公司;四甲基偶氮唑盐(MTT)购自Sigma-Aldrich公司;细胞凋亡试剂盒购自联科生物;其余化学试剂为国产分析纯产品。常氧组CO2细胞培养箱(5%CO2)购自Thermo,低氧组CO2细胞培养箱(5%CO2、1%O2)为英国New Brunswick生产的GALAXY 48R型号CO2培养箱。
1.2 PDLCs的原代培养 选择15~22岁患者因正畸需要拔出的前磨牙,拔出时牙根完整,且无牙周、牙体、牙髓、根尖病变,取得患者知情同意。具体方法如下:去除根端血迹,刮取根中1/3牙周膜组织,采用组织块法以含20%胎牛血清(FBS)、1∶100双抗的DMEM培养基原代培养PDLCs。约第6天细胞生长达80%,胰酶消化传代,后继续在含10%FBS、1∶100双抗的DMEM培养基中培养,前5代PDLCs用于实验。
1.3 四甲基偶氮唑盐(MTT)细胞活性检测 将5×103个PDLCs接种于96孔板中,按实验分组分别于常氧或低氧培养,加入20μL/孔MTT溶液继续孵育4h,去除培养液,加入150μL/孔DMSO后低速振荡10 min使结晶物充分溶解。在酶联免疫检测仪OD 490nm处测量各孔的吸光值。该实验重复三次。
1.4 细胞凋亡实验 收集经低氧及siRNA处理后PDLCs上清液及细胞,PBS洗2次,用1×binding buffer调整细胞浓度为1×106-7个/mL,取200μL细胞悬液,加入5μL Annexin V-APC后避光孵育15 min,再加入10μL PI,混匀后上机检测。
1.5 Western免疫印迹 按分组收集PDLCs裂解蛋白进行抽提并定量。取等量总蛋白沸水中煮7min,8%SDS-PAGE电泳分离后,将凝胶上蛋白经转至PVDF膜上,5%脱脂奶粉2h,加入一抗4℃孵育过夜,之后转入HRP标记的二抗室温孵育2h,ECL化学发光显影扫描。
1.6 实时定量PCR 收集的细胞用Trizol裂解,提取总RNA,紫外分光光度计测量RNA含量。取 1μg RNA合成 cDNA,按 Takara公司Quant SYBR Green PCR kit试剂操作说明进行扩增。应用Primer Premier 5.0软件设计Real-time PCR引物,HIF-1α引物序列为:Forward 5’-GTGCCACATCATCACCATA-3’,Reverse 5’-CAAAGCGACAGATAACACG-3’;p53 引物序列为:Forward 5’-CAGCACATGACGGAGGTTGT-3’,Reverse 5’-TCATCCAAATACTCCACACGC-3’;内参GAPDH序列为:Forw ard 5’-ACCCAGAAGACTGTGGATGG-3’,Reverse 5’-CTGGACTGGACGGCAGATCT-3’。按公式计算求得各样品基因相对表达量。对照组基因相对表达量为1。
1.7 细胞转染 HIF1α-siRNA、p53、NC-siRNA均购自上海吉玛生物科技公司,HIF1α-Si1 靶序列为 5’-CTGATGACCAGCA ACTTGA-3’,HIF1α-Si2 靶序列为:5’-GGAAATGAGAGA AATGCTTAC-3’,p53-Si1 靶序列为5’-CCACUΜGAΜGGAGAGUAUU-3’,p53-Si2靶序列为:5’-TGCGTGTGGAGTATTTGGAT-3’,NC-siRNA 靶序列为:5’-AATTCTCCGAACGTGTCACGT-3’。
根据说明在六孔板中使用Lipofectamine RNAiMAX Transfection Reagent 转染 PDLCs,并设计阴性对照siRNA为NC-Si组,终浓度为50nM,培养48h,提取蛋白、RNA并进行后续研究。
1.8 统计学处理 数据以表示。各实验至少重复3次,采用SPSS13.0软件包分析结果。对两组实验数据进行校正t检验,若P<0.05则差异被视为有统计学意义。
2.结果
2.1 低氧促进PDLCs中p53表达 在本研究中,Western免疫印迹证实低氧培养48h后PDLCs的HIF-1α相较常氧组显著上调(灰度值:常氧组(56.65±4.35);低氧组(101.63±10.98);t=3.888,P=0.018),与此同时,低氧组PDLCs的p53表达也明显升高(灰度值:常氧组(81.36±10.93);低氧组(142.52±7.784);t=4.561,P=0.011);此外,实时定量PCR也在mRNA水平进一步证实低氧状态下PDLCs中HIF-1α表达上升3.89倍(t=6.260,P=0.003),p53表达上升3.07倍(t=6.963,P=0.002)(图 1)。

图1 低氧培养48h后PDLCs中HIF-1α与p53蛋白和mRNA水平变化(*:P<0.05)
2.2 敲低HIF-1α可下调低氧下PDLCs中p53表达 w estern免疫印迹证实PDLCs中HIF1α-Si1、Si2转染组相比NC-Si阴性组中HIF-1α分别下降 51.86%(t=4.747,P=0.009)与 53.81%(t=5.355,P=0.006),而 p53表达分别下降28.54%(t=2.849,P=0.046)与 34.01%(t=3.105,P=0.036)(图 2)。
2.3 敲低p53不影响低氧下PDLCs中HIF-1α表达 为进一步探讨p53是否为HIF-1α的下游因子,PDLCs转染p53-siRNA,w estern免疫印迹证实PDLCs中p53-Si1、Si2组相比NC-Si阴性组中p53表达分别下降66.52%(t=10.69,P=0.0004)与 71.84%(t=10.79,P=0.0004),差异具有统计学意义;然而,HIF-1α表达均无明显变化(t-Si1=0.1793,P=0.866;t-Si2=0.4364,P=0.685),无统计学差异(图3)。
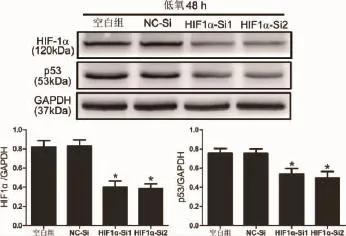
图2 敲低HIF-1α后低氧下PDLCs中HIF-1α与p53蛋白水平变化(*:P<0.05,与NC-Si组比较)

图3 敲低p53后低氧下PDLCs中HIF-1α与p53蛋白水平变化(*:P<0.05)
2.4 敲低p53促进PDLCs增殖 将各转染组细胞在低氧下培养48h,MTT检测发现p53-Si1、Si2组PDLCs吸光度值较NC-Si组分别升高2.04倍(t=5.138,P=0.0068)与 1.87 倍(t=4.112,P=0.0147),差异具有统计学意义(图4)。

图4 敲低p53后低氧对PDLCs细胞活性的影响(*:P< 0.05)
2.5敲低p53后可抑制PDLCs凋亡 流式细胞凋亡检测结果显示,将各转染组细胞在低氧下培养48h后,p53-Si1、Si2组PDLCs凋亡细胞数目比NC-Si组分别减少57.53%(t=12.58,P=0.0002)与54.72%(t=9.798,P=0.0006),具有统计学差异(图 5)。

图5 敲低p53后低氧对PDLCs细胞凋亡的影响(*:P< 0.05)
3.讨论
PDLCs是牙周组织中含量最丰富的间质细胞,对牙周组织的形成与再生有重要影响。慢性牙周炎组织中毒性物质堆积、毛细血管供血不足,造成牙周微环境中局部低氧状态[9,10]。一般情况下,低氧诱导细胞内血管内皮生长因子上升、同时进行无氧代谢,可增加局部氧供给并降低氧消耗,产生适应性调节[11,12]。然而,持续性低氧可导致PDLCs数量减少和结构破坏,引起牙周组织损伤,诱导或加重牙周组织疾病[13]。
研究发现,牙周炎患者的牙周组织中低氧标志蛋白——HIF-1α较正常人显著升高,提示低氧局部牙周微环境可能与牙周炎的发生和发展密切相关[4]。我们前期研究已证实,低氧可以通过激活HIF-1α 调控 PDLCs的增殖和凋亡[5,14]。Song 等[3]通过铁螯合剂氯化钴阻断氧信号传递,建立低氧模型,证实氯化钴化学建立的低氧环境可抑制人PDLCs增殖并促进其凋亡。我们前期研究直接通过低氧培养箱建立低氧微环境,发现PDLC在低氧下培养48h、72h时细胞增殖活力下降、凋亡增加,随着低氧处理时间的增加,细胞存活率逐渐降低,进一步提示了长时间低氧环境是慢性牙周炎发展的重要原因。此外,低氧促进PDLC中HIF-1α的表达上升,小干扰RNA敲低HIF-1α可逆转低氧抑制PDLCs增殖与促进其凋亡,说明低氧通过HIF-1α 对 PDLCs的增殖和凋亡起作用[5,14]。
p53是关键的肿瘤抑制基因,其编码的p53蛋白主要分布于细胞核浆,与DNA特异结合,其活性受磷酸化、乙酰化、甲基化以及泛素化等翻译后修饰调控。p53好似“基因组卫士”,在G1期检查DNA损伤点,监视基因组的完整性,能够抑制肿瘤细胞的增殖[6]。研究证实,p53在牙周炎组织中升高,并与局部组织的低氧状态相关[7]。本研究发现,PDLCs在低氧培养后p53协同HIF-1α一起表达升高,通过小干扰RNA敲低HIF-1α后发现p53表达也随之降低,提示p53可能是受低氧与HIF-1α调控表达;进一步敲低p53表达发现HIF-1水平无明显变化,再次说明p53可能是HIF-1α的下游基因。此外,敲低PDLCs中p53表达后,低氧环境中PDLCs的增殖能力增强、凋亡比例降低,进一步说明p53是低氧抑制PDLCs增殖、促进其凋亡的重要节点,并受HIF-1α调控。还研究发现,低氧可通过HIF-1α介导BNIP与mTOR表达,促进PDLCs发生自吞噬与凋亡[3]。因此,p53与HIF-1α介导低氧促PDLCs凋亡与牙周炎进展的具体机制仍有待进一步探讨。
综上,本研究在PDLCs中证实低氧能通过上调p53抑制PDLCs增殖并促进其凋亡,并且p53受HIF-1α调控。低氧是促进牙周炎发生与发展的重要因素,靶向降低PDLCs中HIF-1α和p53表达可能是防治牙周炎的研究重点。

