丹参酮ⅡA亚微乳逆转肿瘤多药耐药的研究
冯 欣
(南阳医学高等专科学校,河南 南阳 473000)
近年来,随着我国肿瘤的发病率和死亡率不断提升,肿瘤防治研究是当前医学的重要研究内容[1]。肿瘤临床治疗失败的主要原因可能是肿瘤细胞对化疗药物产生广泛的耐药作用,致使肿瘤细胞逐渐丧失对结构与药理作用机制完全不同的化疗药物的敏感性。寻找多药耐药逆转剂是克服肿瘤临床耐药、提高肿瘤化疗敏感性的关键。我国中药资源丰富,其中可能的肿瘤多药耐药逆转剂具有多靶点、疗效高、不良反应少等独有的特点,引起研究者的广泛关注。丹参酮ⅡA具有广泛的抗肿瘤活性,参与抑制血管生成、抑制肿瘤侵袭和转移、逆转肿瘤多药耐药等多个环节[2]。研究[3]证明,丹参酮ⅡA亚微乳在体外能够部分逆转SMMC-7721/VCR的多药耐药性,但是其作用机制尚不清楚,本文模拟临床常用紫杉醇联合5-氟尿嘧啶及顺铂方案,观察了丹参酮ⅡA亚微乳对小鼠S180多药耐药腹水癌多药耐药相关耐药蛋白表达或活性的影响,以探讨其干预化疗多药耐药的作用和具体机制。
1 材料与方法
1.1 药品与试剂丹参酮ⅡA原料药(含量:98%,批号20140227),四川省广汉市世享原料药业有限公司;丹参酮ⅡA亚微乳,由丹参酮ⅡA、豆卵磷脂(上海太伟药业有限公司,药用口服级)、玉米油、吐温80和适量纯水制成,丹参酮ⅡA浓度100 mg/mL。DMEM培养基,北京Solarbio科技责任有限公司;胎牛血清,杭州四季青生物工程材料有限公司;Anne xin V-FITC凋亡检测试剂盒,南京凯基生物科技有限公司;流式细胞仪,美国BD Biosciences公司;注射用顺铂(批号:01611611),山东齐鲁制药厂;5-氟尿嘧啶(批号:100112),天津金耀氨基酸有限公司;注射用环磷酰胺(批号:080503),上海华联制药有限公司。
1.2 实验动物昆明种小鼠,体质量19~24 g,由河南医药科学研究所提供;小鼠S180腹水癌模型,由河南医药科学研究所提供。
1.3 仪器CO2培养箱,法国Forme公司;680型全自动酶标仪、DK-8D型电热恒温水槽,上海晶宏实验设备有限公司;倒置显微镜,德国Leica公司;1-15PK型台式高温冰冻离心机,美国Sigma公司。
1.4 实验方法
1.4.1 小鼠S180多药耐药腹水癌模型的建立[4]在无菌条件下,抽取3只小鼠S180的腹水,置于离心管中,采用无菌生理盐水将含瘤细胞密度稀释至1×107个/mL,混匀,分别腹腔接种至10只昆明种小鼠(雌雄各5只),接种体积为0.2 mL。接种24 h后,除正常对照组外,腹腔注射或灌胃给予多种化疗药物,具体如下:顺铂3 mg/kg,腹腔注射,每周1次;环磷酰胺(cyclophosphamide,CTX)和5-氟尿嘧啶各3 mg/kg灌胃,每天1次。待接种第15天,无菌条件下抽取存活小鼠的腹水,进行一对一传代接种至新的昆明种小鼠腹腔,建立小鼠S180多药耐药腹水癌模型。
1.4.2 丹参酮ⅡA亚微乳抑瘤率观察 1)造模:抽取已建立的小鼠S180多药耐药腹水癌模型腹水,采用无菌生理盐水将含瘤细胞密度稀释至1×107个/mL备用。取40只19~24 g昆明种小鼠,雌雄各20只,将稀释好的腹水接种于每只小鼠左腋皮下,接种体积为0.2 mL,建立小鼠S180多药耐药实体瘤模型;2)小鼠分组及给药:随机将已建模成功小鼠分为4组,每组10只,即阳性对照组(经腹腔注射CTX 20 mg/kg),阴性对照组(经腹腔注射无菌生理盐水0.2 mL/10 g),丹参酮ⅡA亚微乳大、小剂量组。丹参酮ⅡA亚微乳大、小剂量组给予相应浓度的丹参酮ⅡA亚微乳0.2 mL/10 g、0.1 mL/10 g,腹腔注射,每天给1次,共2周;3)计算丹参酮ⅡA亚微乳抑瘤率:末次给药24 h之后,将小鼠实施安乐死,剥离肿瘤组织,称其体质量,记录瘤质量,按照以下公式计算抑瘤率:(对照组瘤质量-药物组瘤质量)/对照组瘤质量×100%;药物对抑瘤作用的提高率按照以下公式进行计划:(药物组抑瘤率-对照组抑瘤率)/对照组抑瘤率×100%。
1.4.3 流式细胞仪检测丹参酮ⅡA亚微乳对SMMC-7721/VCR细胞凋亡的影响 选取无细胞毒性作用的0.5 μg/mL丹参酮ⅡA亚微乳分别作用于SMMC-7721/VCR细胞24 h、48 h、72 h,每组均设有阴性对照。药物处理结束后,用不含乙二胺四乙酸的质量分数0.25%预冷胰酶消化各组细胞,并将其转移至15 mL离心管中,800 r/min,离心5 min,弃上清液留细胞。向离心管中加入约5 mL预冷的磷酸盐缓冲液(phosphate buffered saline,PBS),反复轻柔吹打,混匀,800 r/min,离心5 min,重复2次,弃去上清液留取底部细胞。按照Annexin V-FITC细胞凋亡检测试剂盒说明书进行流式细胞仪上机前处理:将收集得到的药物处理后的细胞,加入适量Binding Buffer液,轻柔吹打,制成细胞悬液,调整细胞浓度凋整至(1~5)×106个/mL。取500 μL细胞悬液至EP管中,分别依次加入Annexin V-FITC和PI各5 μL轻柔吹打,混匀,置于室温,避光反应15 min。将获得的细胞悬液于200目尼龙网过滤,转移至流式检测管中,1 h内上流式细胞仪,检测各组细胞不同时期的细胞凋亡率,记录丹参酮ⅡA亚微乳作用下早期细胞凋亡率。采用以下条件进行检测:激发波长=488 nm,发射波长=525 nm,通过BD FACSDiva软件进行参数获取和数据分析,实验重复3次。
1.4.4 流式细胞仪检测丹参酮ⅡA亚微乳对耐药细胞膜表面耐药相关蛋白P-gp表达的影响 将SMMC-7721、SMMC-7721/VCR细胞接种至6孔板,接种密度为2×105个/孔,24 h后待细胞贴壁后,于SMMC-7721/VCR细胞中加入0.5 μg/mL丹参酮ⅡA,以不加丹参酮ⅡA的SMMC-7721、SMMC-7721/VCR细胞作为阴性对照。作用48 h后,按照2.3中流式细胞仪检测处理方法收集消化细胞、离心、预冷PBS洗2遍,弃上清留细胞,用含体积分数10%胎牛血清的预冷PBS将细胞浓度调整至(1~5)×105个/mL,轻柔吹打混匀,取细胞悬液90 μL,加入10 μL鼠抗人P-gp抗体,反复轻柔吹打,使细胞充分混匀,置于 4 ℃冰箱孵育30 min。取出细胞,离心,弃上清,用含体积分数10%胎牛血清的预冷PBS反复洗3次,从而除去未与蛋白结合的游离抗体。离心,弃上清,500 μL预冷PBS重悬细胞,细胞处理整个过程应于冰上进行。取200目尼龙网过滤的细胞悬液置于流式检测管中,按照2.3中条件设置流式细胞仪参数,并进行数据分析,检测到的P-gp荧光强度反应细胞内P-gp含量,实验重复3次。
1.4.5 罗丹明外排实验 罗丹明作为P-gp的转运底物能较好代表其转运功能[5-6],因此,为了检测丹参酮ⅡA对SMMC-7721/VCR细胞P-gp的影响是否与转运功能相关,我们进行了罗丹明外排实验。将SMMC-7721/VCR细胞以2×105个/孔接种于24孔培养板,24 h待细胞贴壁后,吸弃上清液,PBS洗2次,加入终浓度为5 μg/mL的罗丹明于37 ℃孵育30 min,弃去上清,加入丹参酮ⅡA亚微乳至终浓度为0.5 μg/mL,对照组更换成新鲜培养基,分别于0、0.5、1、2 h收取细胞。收集方法参照2.3,离心后弃上清,加入500 μL预冷PBS重悬细胞,于流式细胞仪检测,激发波长480 nm,发射波长540~660 nm,细胞内罗丹明浓度以荧光强度平均值表示。
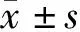
2 结果
2.1 丹参酮ⅡA亚微乳对小鼠多药耐药模型抑瘤率的影响与阴性对照组及阳性对照CTX组比较,丹参酮ⅡA亚微乳作用后,实体瘤质量显著降低,抑瘤率明显提高(P均<0.05)。见表1。
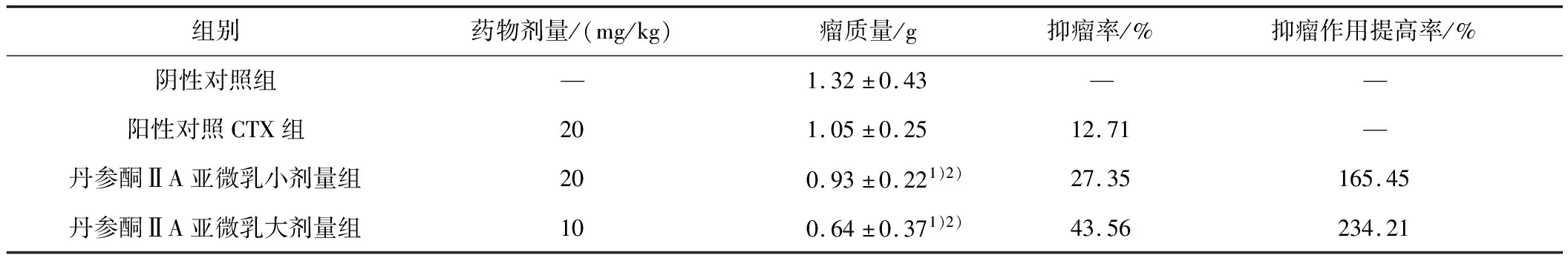
表1 丹参酮ⅡA亚微乳对小鼠多药耐药模型抑瘤率的影响
2.2 丹参酮ⅡA亚微乳诱导发生早期细胞凋亡情况0.5 μg/mL丹参酮ⅡA亚微乳作用SMMC-7721/VCR细胞24、48、72 h后,早期细胞凋亡率随丹参酮ⅡA亚微乳作用时间的延长而增加,且实验组较阴性对照组明显(P均<0.05)。见表2。

表2 丹参酮ⅡA亚微乳作用不同时间段SMMC-7721/VCR早期细胞凋亡率 %
2.3 丹参酮ⅡA亚微乳抑制多药耐药细胞膜表面P-gp情况SMMC-7721细胞P-gp相对含量明显低于SMMC-7721/VCR细胞,SMMC-7721/VCR+丹参酮ⅡA亚微乳细胞(0.5 μg/mL丹参酮ⅡA亚微乳作用48 h后),细胞膜表面P-gp相对表达量与SMMC-7721/VCR细胞比较,有一定程度的降低,但仍高于SMMC-7721细胞(P均<0.05)。见表3。

表3 各组细胞膜表面P-gp相对量比较
2.4 丹参酮ⅡA抑制SMMC-7721/VCR细胞内罗丹明外排情况丹参酮ⅡA亚微乳组罗丹明浓度在每个时间段均显著高于丹参酮ⅡA组,提示丹参酮ⅡA亚微乳可以明显抑制细胞内罗丹明的外排(P均<0.05)。见图1。
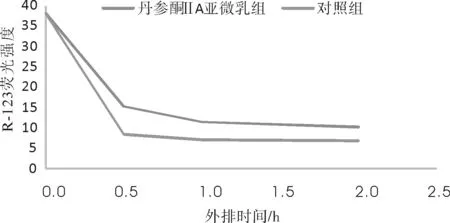
图1 罗丹明外排实验结果
3 讨论
本研究结果表明,丹参酮ⅡA亚微乳能提高对小鼠S180多药耐药实体瘤的抑瘤率,并且随着浓度的升高,抑瘤率有所提高,这说明丹参酮ⅡA亚微乳能逆转小鼠S180肿瘤获得性多药耐药。目前,已知肿瘤细胞多药耐药的机制多样且复杂,P-gp具有转运蛋白表达增高、功能活跃的特点,是化疗耐药的经典机制[7]。P-gp具有生物膜泵功能,可以将细胞内药物泵至细胞膜外,从而降低细胞内的药物浓度[8-9]。通过检测丹参酮ⅡA亚微乳对P-gp表达的影响以及罗丹明外排的研究发现,抑制P-gp的外泵功能是其机制之一[10]。除此之外,流式细胞仪检测丹参酮ⅡA亚微乳对SMMC-7721/VCR细胞凋亡的实验表明逆转肿瘤多药耐药机制可能与其提高耐药细胞早期细胞凋亡率有关。通过本研究可以看出,运用丹参酮ⅡA亚微乳逆转多药耐药有广泛应用前景。我们由此推测出,丹参酮ⅡA亚微乳可以使细胞膜表面P-gp的含量降低,P-gp的转运功能下降,肿瘤细胞对相关化疗药物的外排作用明显减少,细胞内化疗药物浓度提高,可以部分逆转SMMC-7721/VCR的多药耐药性。本实验仅初步研究了丹参酮ⅡA亚微乳对P-gp表达的影响及多药耐药对耐药细胞早期凋亡的影响,下一步我们将继续探索丹参酮ⅡA亚微乳逆转肿瘤多药耐药的作用及具体机制。

