下调miR-454增强食管鳞癌细胞对顺铂敏感性的作用及机制
吴 恺,何宏博,张 澎,曾 诚,刘东雷,赵 松
(郑州大学第一附属医院胸外科,河南 郑州 450052)
食管癌作为中国最常见的、最具侵袭性的消化系统恶性肿瘤,具有发病率、致死率高、预后差等特点[1]。据世界癌症报告统计,食管鳞状细胞癌为食管癌的主要病理类型[2]。此外,食管癌的耐药、转移和复发等均严重限制了患者的化疗成功率。目前,以顺铂为基础的化疗仍是食管鳞癌患者最为常见的化疗方案,但部分食管癌患者连续治疗一段时间后对顺铂的敏感性较差,导致耐药的产生,引起食管癌的复发和转移,严重影响患者的治疗[3-4]。因此,了解食管鳞癌的耐药机制,筛选与耐药相关的新靶点,可显著提高临床精准治疗,提高患者的合理用药,改善预后。
微小RNAs(micro RNAs, miR)是一种存在于生物体内的、高度保守的、长度约为21~25 nt的非编码内源性单链小RNA,其可通过与靶基因mRNA的3’非编码区域结合降解/抑制靶基因mRNA的表达发挥转录后调节作用,进而影响肿瘤的发生、发展及对药物的敏感性[5-6]。据研究[7]报道,骨肉瘤中miR-454的表达显著降低,且过表达miR-454可抑制骨肉瘤的生长和侵袭。而miR-454高表达的肝癌患者具有更短的生存期和更差的预后[8]。此外,miR-454在肺癌和结肠癌中可作为一种促癌基因,下调miR-454可降低降低癌细胞的增殖、侵袭和迁移,促进其凋亡[9-10]。这些研究结果均提示miR-454在不同肿瘤中的功能具有多样性。但目前有关miR-454在食管鳞癌化疗敏感性中的功能及调控机制仍无报道。基于此,阐明miR-454在顺铂耐药的食管鳞癌中的生物特性、对顺铂化疗敏感性的影响及分子机制,可为其作为靶点应用于食管鳞癌的综合治疗奠定理论基础。
1 材料与方法
1.1 材料与试剂食管鳞癌细胞EC109购自上海生物科学院细胞库;顺铂、二甲基亚砜、噻唑蓝(MTT)购自美国Sigma公司;RPMI-1640、胎牛血清购自美国Gibco公司;TRIzol试剂及RNA提取试剂盒均购自北京索莱宝科技有限公司;miRNeasy®Mini Kit购自德国Qiagen公司;实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)试剂盒均购自美国Thermo公司;Lipofectamine 2000购自Invitrogen 公司;过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)γ、AKT、鼠抗人血管内皮生长因子抗体购自美国Abcam公司;鼠抗人甘油醛-3-磷酸脱氢酶抗体购自武汉博士德生物工程有限公司;miR-454模拟物及其相应的阴性对照mimic miR-454 control均购自上海生工生物工程有限公司;miR-454 inhibitor、内参基因U6购自上海吉玛有限公司。本实验中涉及的基因及引物序列见表1。
1.2 细胞系及培养采用体积分数10%胎牛血清、质量分数1%双抗(青霉素/链霉素)的RPMI-1640完全培养基培养EC109细胞,在37 ℃恒温、体积分数5% CO2培养箱中培养,取对数期状态良好的细胞用于实验。
1.3 耐药细胞株的构建及培养采用递增药物浓度-间歇冲击作用的方法构建顺铂食管鳞癌耐药细胞株EC109/DPP。取状态良好并处于对数生长期的EC109细胞,最开始加入顺铂(1 μmol/L)开始培养,24 h后更换全新的新鲜RPMI-1640完全培养基,待EC109细胞再次正常生长后再次加入顺铂(1 μmol/L)培养基培养EC109细胞。直到EC109细胞稳定生长且传代3次以上,测定IC50。在培养基中反复加入逐渐递增浓度的顺铂一直到EC109细胞能在Cisplatin(10 μmol/L)的培养基中稳定生长且传代代3 次以上,测定IC50。
1.4 miRNA转染选取处于对数期且生长良好的EC109/DPP细胞用于后续实验。将EC109/DPP细胞进行6孔板铺板,铺板的密度为3×105个细胞/孔,铺板后进行培养,过夜。按照Lipofectamine 2000的说明书,首先调整脂质体与miR的比例,选取细胞生长最好的最佳比例,进行miR转染。转染后,将EC109/DPP细胞置于恒温培养箱中,每4~6 h的培养期间更换新鲜的含血清培养基。转染实验设计的基因序列见表1。转染24 h后收集细胞进行后续实验。
1.5 qRT-PCR检测miR-454表达采用miRNeasy®Mini Kit提取试剂盒提取EC109/DPP细胞的miRNA。分别检测各组细胞中RNA浓度和纯度,逆转录RNA,采用U6作为内参(内参引物见表1)。qRT-PCR实验选用miScript SYBR Green PCR Kit试剂盒,平行实验每组均重复3次,计算平均Ct值,根据2-ΔΔCt相对定量计算公式计算miR-454在各组细胞中的相对表达水平。
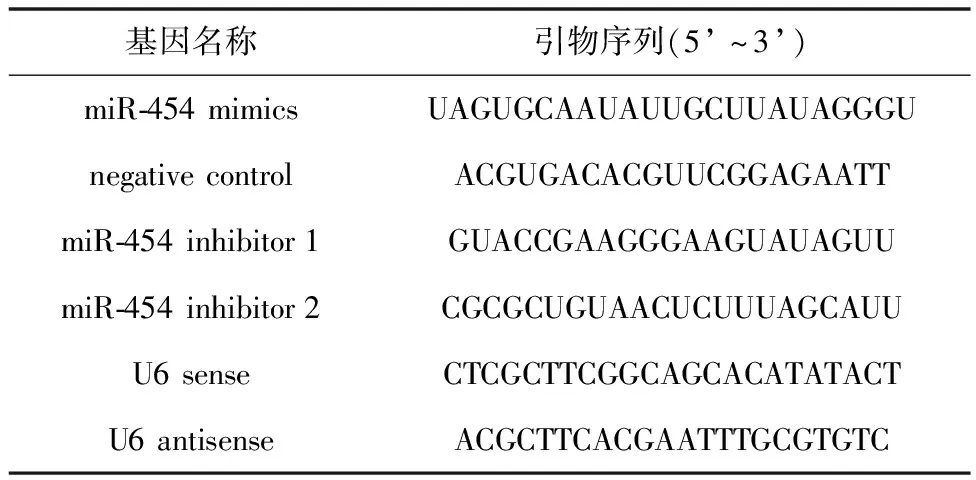
表1 基因及引物序列
1.6 MTT法检测细胞增殖采用MTT法检测各种细胞的增殖情况。将各组细胞接种于细胞培养板中,设置接种的密度约为1×104个细胞/孔(96孔板,每孔100 μL),将各组细胞接种后置于恒温箱连续培养24 h,随后将培养基更换为含顺铂培养基,设置顺铂的梯度浓度,使其分别为2、4、8、16、32 μmol/L。同时,根据相同的条件培养空白组、阴性对照组细胞(仅含培养基)。将各组细胞分别培养48 h后进行收集,再加入MTT避光培养,4 h后弃掉培养基加入二甲基亚砜,振荡、静置一定时间后,采用酶标仪测定吸光度值(波长为570 nm)。根据每组细胞的吸光度计算存活率(各组重复3次)。
1.7 Western blot法检测PPARγ、AKT蛋白表达水平消化收集细胞,提取细胞总蛋白,BCA测定蛋白浓度。以体积分数10%分离胶的十二烷基硫酸钠-聚丙烯酰胺凝胶凝胶法跑电泳,蛋白转至聚二偏氟乙烯膜,体积分数5%胎牛血清封闭2 h后孵育一抗(1600)、β-actin(13 000),4 ℃孵育过夜。摇床室温孵育二抗2 h。将聚二偏氟乙烯膜洗涤3次,每次20 min,加入ECL显色剂。采用Bio-Rad凝胶成像系统获取图像,分析各组条带的相对表达量。
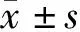
2 结果
2.1 EC109、EC109/DPP细胞耐药性比较与EC109细胞比较,EC109/DPP细胞在经过不同浓度顺铂处理后,细胞增殖显著受抑制;EC109、EC109/DPP细胞的IC50值分别为(3.53±0.23)μmol/L和(23.61±1.48)μmol/L,差异有统计学意义(t=23.179,P<0.001)。结果表明,EC109/DPP细胞耐药株构建成功。见图1。
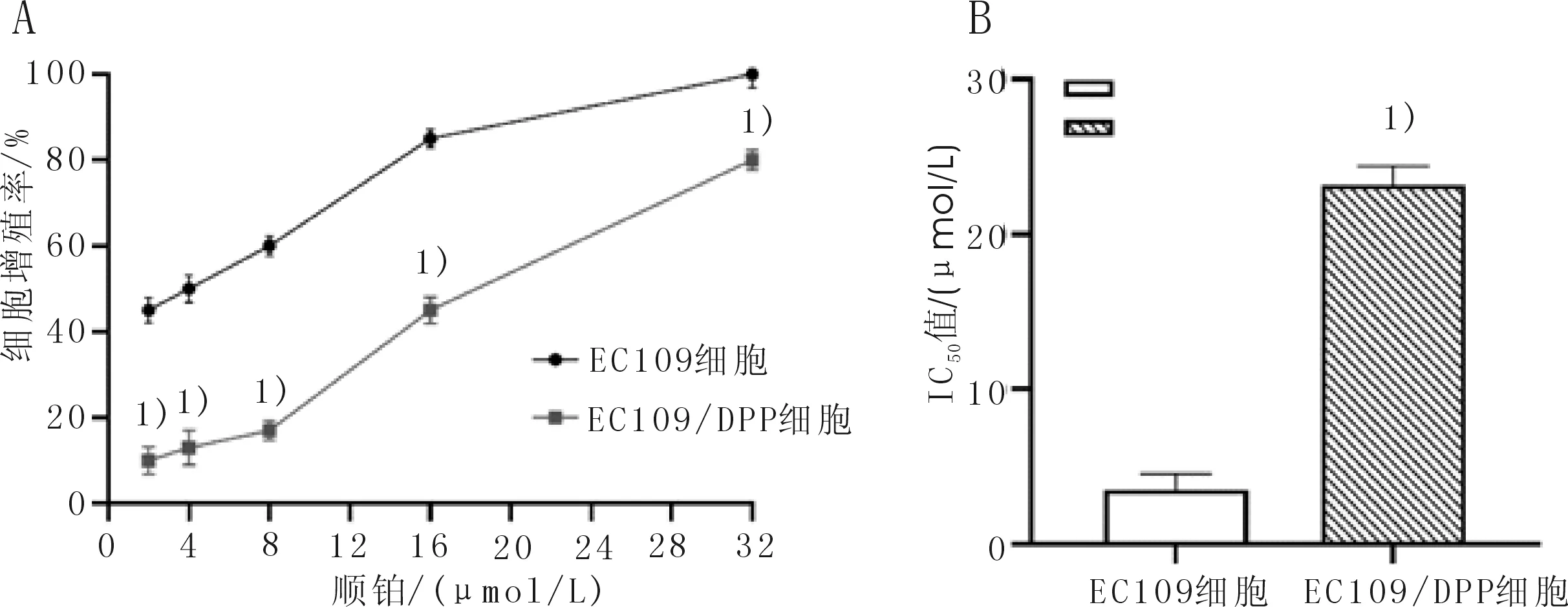
图1 顺铂对EC109、EC109/DPP细胞的增殖抑制效应比较
2.2 EC109、EC109/DPP细胞中miR-454表达水平比较利用qRT-PCR检测EC109、EC109/DPP细胞中miR-454表达。EC109/DPP细胞中miR-454的相对表达量显著高于EC109细胞中的相对表达量(t=18.931,P<0.001)。此外,与空白组比较,转染miR-454抑制剂下调miR-454后EC109/DPP细胞miR-454相对表达量明显降低(t=3.986,P=0.016)。结果表明miR-454抑制剂可抑制miR-454表达。见图2。
2.3 下调miR-454增加EC109/DPP细胞对顺铂的敏感性随加入顺铂浓度的增加,与EC109/DPP细胞比较,顺铂+下调miR-454组显著增加了EC109/DPP细胞对顺铂的敏感性。IC50值分别为(21.01±1.91)μmol/L和(12.43±2.40)μmol/L,差异有统计学意义(t=4.843,P=0.008)。这提示随加入顺铂浓度的增加,与EC109/DPP细胞比较,顺铂+下调miR-454组显著增加了EC109/DPP细胞对顺铂的敏感性。见图3。
2.4 下调miR-454对PPAR-γ和AKT蛋白表达的影响采用Western Blot法检测转染前后的EC109/DPP细胞中PPAR-γ和AKT蛋白表达。下调miR-454组的EC109/DPP细胞可显著上调PPAR-γ,下调AKT蛋白(P均<0.05)。结果提示下调miR-454增加EC109/DPP细胞顺铂敏感性的机制可能与调控PPAR-γ和AKT蛋白有关。见图4。
图2 EC109、EC109/DPP细胞中miR-454表达水平比较
A:EC109、EC109/DPP细胞中miR-454表达;B:EC109/DPP细胞中是否转染miR-454抑制剂后miR-454表达。与EC109细胞比较,1)P<0.05;与空白组比较;2)P<0.05
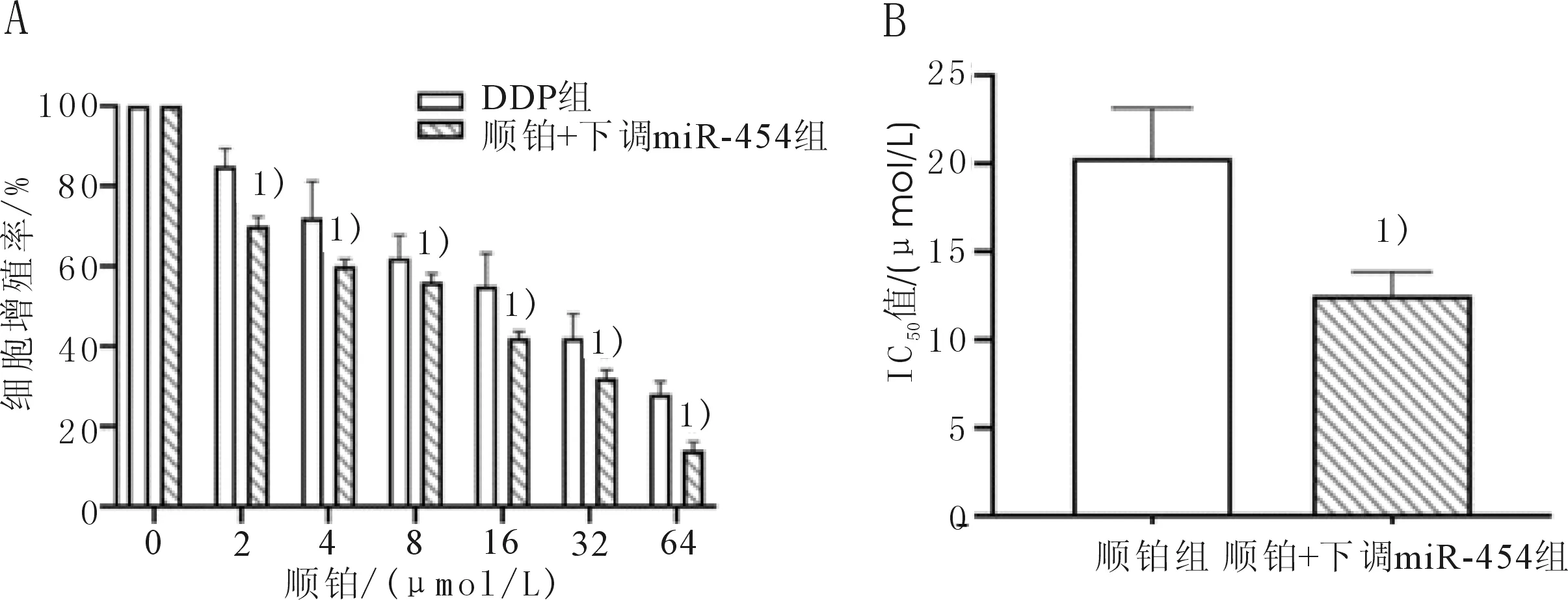
图3 下调miR-454对EC109/DPP细胞顺铂敏感性的影响
3 讨论
食管鳞癌是最为常见的消化系统恶性肿瘤之一,为河南省较为特异性高发的肿瘤。许多患者确诊时已为中期或晚期,进展较快,预后极差,严重威胁患者的生命健康[2]。以顺铂为基础的传统化疗方案目前仍为食管癌治疗的常规治疗方案,在食管癌患者中广泛应用。但许多患者在应用此化疗方案一段时间后对顺铂产生了耐药,化疗过程中产生的耐药、转移和复发进一步造成食管鳞癌患者的化疗失败和死亡[3]。食管癌的耐药机制是一个多因素、多机制参与的复杂过程,主要与多药耐药转运蛋白的表达、细胞内生物活性酶活性的改变、p53及微管蛋白改变、热休克蛋白改变等密切相关[4]。但食管鳞癌耐药的机制仍未完全阐释清楚。
近年来,许多研究报道miR可与相应靶基因mRNA的非编码区域结合,进而影响肿瘤细胞的增殖、凋亡、侵袭和迁移[5]。miR在许多恶性肿瘤中异常表达,作为癌基因或抑癌基因在肿瘤的发生、进展及耐药过程中发挥着重要的作用。关于miR-454调控恶性肿瘤细胞的生长相关研究受到广泛关注。miR-454在不同肿瘤中发挥着不同的作用。如过表达miR-454可抑制骨肉瘤、肝癌等的生长和侵袭;下调miR-454可降低肿瘤细胞的增殖、侵袭和迁移,促进其凋亡。但目前仍未有miR-454在食管鳞癌化疗敏感性中的作用及机制等相关报道。
本课题组前期基因芯片结果发现,miR-454在顺铂耐药的EC109细胞中特异性高表达。结果表明miR-454可能参与EC109/DPP细胞的调控。黄云龙等[11]发现过表达miR-218有助于增加食管鳞癌细胞对顺铂的敏感性,给对顺铂耐药的食管鳞癌患者提供潜在的基因治疗靶点;而马鸣等[12]研究发现miR-429可通过抑制Bmi-1表达提高食管鳞癌细胞的化疗敏感性。以上结果说明miR可调控食管鳞癌细胞的化疗敏感性。因此,本研究拟进一步探究miR-454在EC109/DPP细胞中的作用及相关机制。
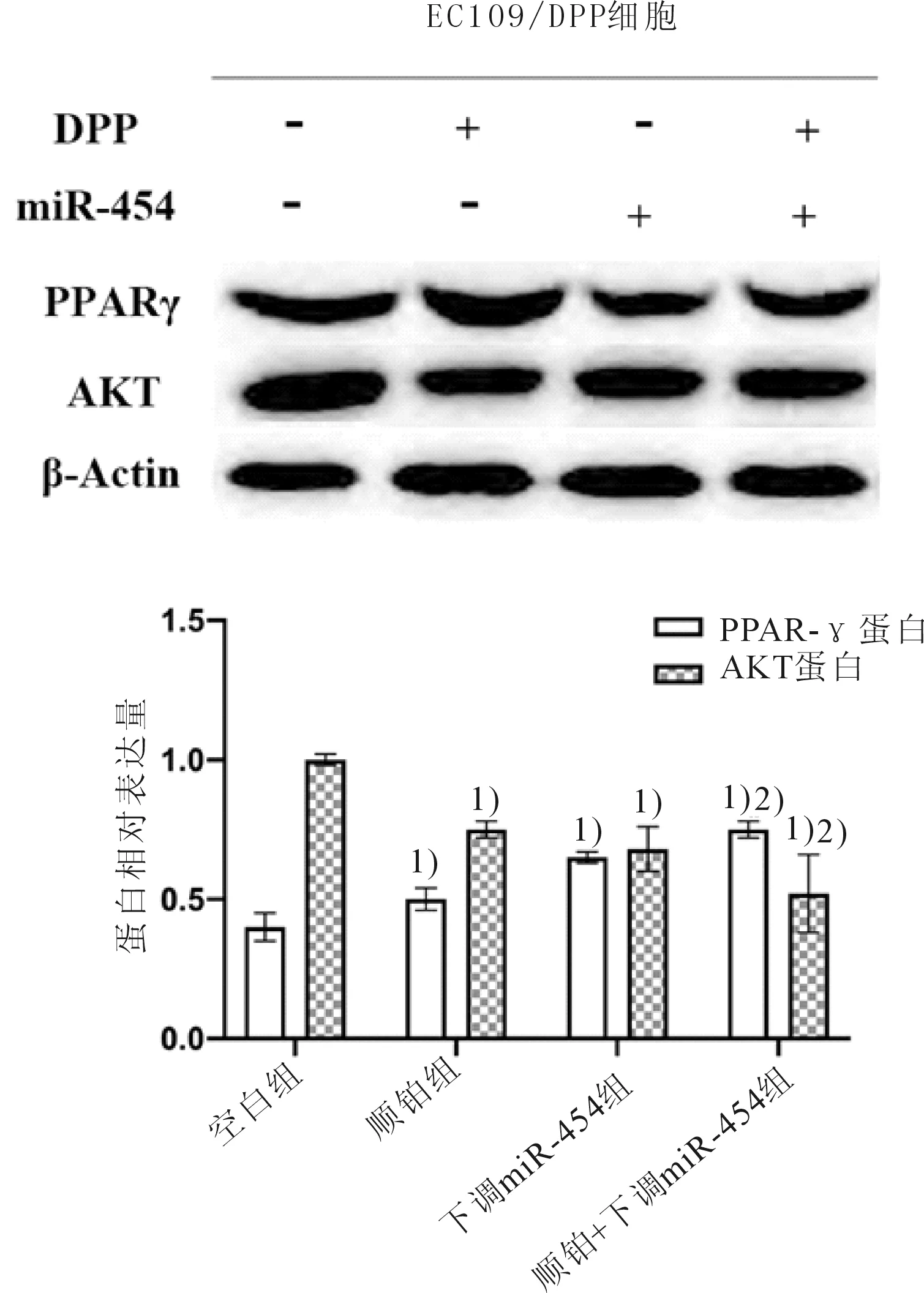
图4 miR-454对EC109/DPP细胞中PPAR-γ和AKT蛋白表达的影响
本研究采用递增药物浓度-间歇冲击结合的方法诱导EC109/DPP细胞,此方法已被广泛应用[13-14],本研究在以上研究的基础上进一步改进了方法。结果发现,与EC109细胞比较,EC109/DPP细胞在经过不同浓度顺铂处理后,细胞增殖显著受到抑制;EC109细胞、EC109/DPP细胞的IC50值分别为(3.49±1.05)μmol/L和(23.18±1.22)μmol/L。结果表明,EC109/DPP细胞耐药株构建成功。
qRT-PCR结果进一步证实,与EC109细胞比较,EC109/DPP细胞中miR-454的相对表达量显著升高。EC109/DPP细胞转染miR-454抑制剂后可显著下调miR-454的表达。而miR-454可能在EC109/DPP细胞中发挥一定的作用。本文结果显示,随加入顺铂浓度的增加,与EC109/DPP细胞比较,下调miR-454显著增加了EC109/DPP细胞对顺铂的敏感性。上述结果进一步验证了miR-454可调控EC109细胞对顺铂的耐药性。
PPAR-γ作为PPARs家族的一种核转录因子,与相应配体结合后可诱导或抑制靶基因的表达[15]。据研究[16]报道,PPAR-γ表达于肺癌、结肠癌、乳腺癌等多种肿瘤细胞中。高表达PPAR-γ的乳腺癌患者疾病无进展生存期更长[17]。而在非小细胞肺癌细胞系中,PPAR-γ活化可致肿瘤细胞分化并诱导其凋亡[18]。但PPAR-γ在食管癌耐药中的作用报道极少。根据上述结果我们可推测,PPAR-γ下调可能为肿瘤细胞耐药的机制之一。本研究结果发现,与空白组和顺铂组比较,下调miR-454组和顺铂+下调miR-454组的EC109/DPP细胞可显著上调PPAR-γ。此外,EC109/DPP细胞中AKT的磷酸化水平降低,这说明AKT的活化也参与到食管癌细胞对顺铂的耐药中,但PPAR-γ如何与AKT相互影响尚不清楚,仍值得深入研究。
综上所述,本研究首次证实了下调miR-454表达可增强EC109/DPP细胞对顺铂的敏感性,其作用机制可能与上调PPARγ蛋白、下调AKT蛋白表达有关。本研究可为提高食管癌的临床精准治疗奠定一定的理论基础。

