DEAD盒多肽43在肺腺癌组织中的表达
崔 黎,崔 莹,赵 娜,陈奎生
(1.郑州大学第一附属医院病理科,河南 郑州 450052;2.郑州卫生健康职业学院病理教研室,河南 郑州 450199;3.郑州市中心医院病理科,河南 郑州 450007)
世界范围内肿瘤死亡原因中,肺癌居首位,每年有180万新发病例,其中有80%~85%属于非小细胞肺癌(non small cell lung adenocarcinoma,NSCLC)。在我国,NSCLC的发病率也呈逐年升高。肺腺癌是NSCLC的一种,其发生率约占所有肺癌的50%,是肺肿瘤中最常见的组织学类型[1]。目前,化疗、靶向治疗是治疗中晚期肺腺癌的重要治疗办法,诊疗中发现众多中晚期患者化疗疗效不理想,关键驱动基因(如表皮生长因子受体、KRAS、MET)的突变是主要原因。KRAS是NSCLC患者常见的突变致癌基因[2],伴有KRAS基因突变的肺腺癌,其复发、转移风险更高[3]。突变的KRAS基因会降低三磷酸鸟苷 (guanosinetriphosphate,GTP)酶的活性,保持和GTP结合状态,使下游信号通路保持激活状态,持续并无限制地向细胞发送信号,这些信号不符合细胞自然的生长特性,可刺激细胞持续生长,减少细胞死亡,进而导致肿瘤的发生。DEAD盒多肽43(DEAD box polypeptide 43,DDX43)是一种肿瘤特异性基因,在人横纹肌肉瘤LB23-SAR细胞株中最早被鉴定。DDX43基因由648个氨基酸组成,位于染色体6q12~13,全长2 300 bp,主要定位于细胞质内[4]。DDX43基因与肿瘤细胞的恶性增殖、化疗药物耐药、肿瘤免疫有着重要的相关性。多种实体肿瘤中均可见DDX43的高水平表达[5]。KRAS信号转导通路中DDX43起到调节作用,促进肿瘤细胞的增殖、恶性转化,并在增强肿瘤侵袭、肿瘤免疫及耐药等方面都能起到关键作用。本研究应用免疫组化、荧光原位杂交技术,观察正常肺组织、肺泡上皮非典型腺瘤样增生、肺腺癌组织中DDX43蛋白、mRNA的表达情况,对其结果进行分析,探讨肺腺癌组织中DDX43蛋白和mRNA表达与肺腺癌临床病理参数的关系,为伴有KRAS基因突变肺腺癌患者的治疗,寻找理想靶点,提供理论依据。
1 资料与方法
1.1 标本来源62例肺腺癌标本、31例肺泡上皮非典型腺瘤样增生标本均收集于2015年1月至2017年9月郑州大学第一附属医院的手术标本,正常肺组织取自肺腺癌患者手术切缘处。术前,所有患者均经穿刺活检明确诊断。离体0.5~1 h分离出正常肺组织、腺癌组织、肺泡上皮非典型腺瘤样增生组织;固定于中性多聚甲醛液体中,用于后续HE染色、免疫组化及荧光原位杂交的实验。
1.2 患者临床病理资料62例肺腺癌患者:男36例,女26例;年龄≥60岁33例,<60岁29例; 52例混合型,4例腺泡型,3例实体型,3例乳头型;20例有淋巴结转移,42例无淋巴结转移;55例有胸膜侵犯,7例无胸膜侵犯;有脉管侵犯47例,无脉管侵犯15例。
1.3 实验方法
1.3.1 免疫组化 严格参照免疫组化试剂盒说明书进行操作。以浓度为1∶100的一抗(兔抗人DDX43多克隆抗体)滴加入切片。阳性对照:用DDX43阳性表达的食管鳞癌组织代替,结果阳性;阴性对照:用正常羊血清代替一抗,结果阴性;空白对照:以PBS代替一抗,结果阴性。
1.3.2 荧光原位杂交 探针由上海生物有限公司合成;阴性对照:选用无探针的杂交液孵育组织切片,结果阴性;阳性对照:用DDX43 mRNA阳性表达的食管鳞癌组织代替,结果阳性。
1.4 观察指标
1.4.1 DDX43蛋白 阳性信号显色呈现浅黄至深黄色颗粒,主要定位于细胞质。参照文献[6],采用双盲法,观察10个视野/每张切片(×200),根据染色强度和染色数量,记录平均数。
1.4.2 DDX43 mRNA 阳性表达显色呈现绿色荧光信号标记,主要位于细胞质。参照文献[7],制定荧光原位杂交判读方法:每张切片随机选取200个细胞进行计数,重叠的细胞不参与计数,计算阳性细胞数和阳性细胞率。
2 结果
2.1 不同肺组织中DDX43蛋白表达的比较正常肺组织、肺泡上皮非典型腺瘤样增生、肺腺癌组织中DDX43蛋白的阳性表达率分别为0.00%、38.71%、88.71%,总体比较差异有统计学意义(χ2=63.150,P<0.001);三者两两比较差异均有统计学意义(P<0.001)。见表1、图1。

表1 不同肺组织中DDX43蛋白表达的比较
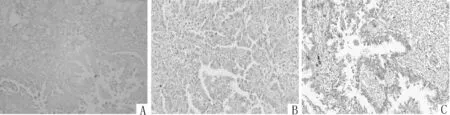
图1 不同肺组织中DDX43蛋白免疫组化染色图片比较(IHC,×200)
2.2 不同肺组织中DDX43 mRNA表达的比较正常肺组织、肺泡上皮非典型腺瘤样增生、肺腺癌组织中DDX43 mRNA的阳性表达率分别为8.06%、38.71%、82.26%,总体比较差异有统计学意义(χ2=53.124,P<0.001);三者两两比较差异均有统计学意义(P<0.001)。见表2、图2。

表2 不同肺组织中DDX43 mRNA表达的比较

图2 不同肺组织中DDX43 mRNA表达的荧光原位杂交检测情况比较(×200)
2.3 肺腺癌组织中DDX43蛋白和mRNA表达与肺腺癌临床病理参数的关系肺腺癌组织中DDX43蛋白和mRNA的表达均与其有无淋巴结转移、胸膜侵犯、脉管侵犯有关(蛋白:χ2=3.214,P=0.040;χ2=14.230,P=0.001;χ2=10.400,P=0.001;mRNA:χ2=4.590,P=0.030;χ2=6.223,P=0.008;χ2=10.400,P=0.001)。见表3。
3 讨论
DDX43属于DEAD盒家族成员,是三磷酸腺苷依赖性RNA解螺旋酶,又被称为解旋酶抗原[8]。DDX43基因位于人第6号染色体,编码一个由648个氨基酸组成的蛋白质,全长2 300 bp,主要定位于细胞质中。虽然目前DDX43的生理功能还没有完全明确,但作为RNA解螺旋酶,在RNA代谢的诸多环节都可发挥作用,是RNA代谢过程中不可或缺的驱动力,对于多种肿瘤细胞的生长、增殖都发挥非常重要的作用。
相较于肺癌的其他组织学类型,腺癌的驱动基因更为明确[9]。80%以上的肺腺癌有明确的驱动基因,KRAS作为肺腺癌的驱动基因之一,可催化其下游效应底物,对细胞生长、分化、凋亡等环节起到调节作用。人体正常生理细胞增殖与KRAS蛋白相关,KRAS蛋白可使细胞增殖失控,从而导致肿瘤细胞形成。研究[10]揭示,突变KRAS基因可作为NSCLC生存的不利影响因素。在肿瘤的发生、发展中,突变KRAS基因发挥着关键作用[11],RAS/RAF/MEK/MAPK通路在肺癌信号转导级联中起核心作用,其中以KRAS突变最常见[12]。

表3 肺腺癌组织中DDX43蛋白和mRNA表达与肺腺癌临床病理参数的关系
DDX43作为一种免疫原性肿瘤相关抗原,对肿瘤的增殖不可或缺,在很多肿瘤中过度表达[13]。DDX43表达与肿瘤的恶性增殖、转移及肿瘤细胞的耐药有关。DDX43在肿瘤组织中表达下调,引起KRAS通路中NRAS蛋白的表达明显下降,同时降低了转导通路下游的ERK信号通路,因此导致降低AKT的活性[14]。
本研究表明,DDX43蛋白和mRNA在伴有KRAS基因突变的肺腺癌组织中高表达,肺腺癌的临床病理参数与DDX43蛋白和mRNA的表达有明显的相关性[15]。这一研究有助于KRAS基因突变肺腺癌患者的治疗寻找理性靶点,也为临床治疗肺腺癌奠定了理论基础。

