胃癌患者血清miR-22、miR-20a的水平变化及意义
杨焕丽,贾泽博,梁晓萍,王菲,张瑞
1咸阳市中心医院,陕西咸阳 712000;2西安医学院
目前胃癌的发病率居恶性肿瘤第5位,病死率居第3位,严重影响人们的生命健康[1]。早期胃癌患者的预后较好,且治愈率较高[2]。而中晚期胃癌患者预后较差,易发生远端转移和复发,导致患者的生存期缩短,因此提高早期胃癌的检出率对于胃癌患者的治疗及预后改善尤为重要[3]。目前对胃癌的发病机制仍缺乏了解,已有研究显示,在胃癌发病过程中多种微小RNA(miRNA)表达异常[4]。miRNA是在细胞内广泛存在的微小RNA分子,通过碱基互补配对与基因的mRNA结合并促进其降解,从而导致基因表达下降[5]。微小RNA-20a(miR-20a)在细胞核和细胞质中均有分布,在乳腺癌和肺癌中表达上调,与肿瘤细胞的增殖和细胞周期进程密切相关[6,7]。miR-22主要分布于细胞核中,在肠癌和宫颈癌中表达下调,与肿瘤侵袭和转移联系密切[8,9]。研究显示,乳腺癌中miR-20a和miR-22表达有一定关系,并在乳腺癌手术患者的预后诊断中有重要意义[6]。但两者在胃癌中的研究较少。2018年2月—2019年2月,我们观察了血清miR-22、miR-20a在胃癌中的水平变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选择2018年2月—2019年2月我院诊治的90例胃癌患者(胃癌组)。纳入标准:均为首次发病;病理学确诊为胃癌;入院前未接受过放化疗治疗和抗炎治疗。排除标准:合并存在其他类型肿瘤;存在全身性炎症反应;肝肾功能异常;存在自身免疫性疾病。同时选择同期在我院进行体检的90例健康者作为对照组。胃癌组男50例、女40例,年龄34~78(61.73±11.24)岁。对照组男51例、女39例,年龄33~79(61.29±10.87)岁。两组性别比例、年龄比较差异无统计学意义,具有可比性。胃癌组肿瘤直径≤5 cm 48例,>5 cm 42例;浸润深度达黏膜层54例,黏膜下层36例;低分化31例,中分化35例,高分化24例;28例有淋巴结转移,62例无淋巴结转移;TNM分期为Ⅰ期34例,Ⅱ期30例,Ⅲ期16例,Ⅳ期10例。本研究通过咸阳市中心医院伦理委员会批准。入组人员均与院方签署知情同意书。
1.2 血清miR-20a、miR-22水平检测 于清晨抽取两组空腹肘静脉血5 mL,室温静置30 min,5 000 r/min离心30 min,保留上清液并将其冻存于-80 ℃保存,待所有血清样本收集结束后进行统一检测。血清miRNA提取采用血清miRNA提取试剂盒(新海基因检测有限公司),按照试剂盒说明书完成操作。miR-20a、miR-22水平检测采用RT-PCR法,使用逆转录试剂盒(美国赛默飞世尔生物科技有限公司)将提取得到的miRNA逆转录生成cDNA,用实时荧光定量PCR试剂盒(美国赛默飞世尔生物科技有限公司)对miR-20a和miR-22的表达量进行检测,配套使用荧光定量PCR仪(美国伯乐科技有限公司)进行检测,操作方法严格按照试剂盒说明书和仪器说明书进行操作。采用mirVana miRNA分离试剂盒提取血清中的miRNA,使用miRNA cDNA合成试剂盒对提取获得的miRNA进行逆转录。逆转录体系:miRNA 5 μL,反转录缓冲液5 μL,10×miRNA反转录引物2 μL,水8 μL。反转录条件:37 ℃ 60 min;95 ℃ 5 min。使用mirVana qRT-PCR miRNA检测试剂盒对cDNA进行定量检测,反应体系25 μL,包括水16.5 μL,5×PCR buffer 5 μL,50×ROX溶液0.5 μL,DNA聚合酶1 μL,PCR上游引物1 μL,PCR下游引物1 μL。反应条件:95 ℃ 15 s;60 ℃ 30 s,进行35个循环。miR-20a正向引物:5′-GCGGCGGTAAAGTGCTTATAGTG-3′,反向引物:5′-TGCAGGGTCCGAGGTAT-3′。miR-22正向引物:5′-AAGCTGCCAGTTGAAGAACTGTA-3′,反向引物:5′-AGTTGCTAAGATATGCGACAC-3′。以U6作为内参基因,U6正向引物:5′-CCCTCCAGAGAGCGTTATGTGA-3′,反向引物:5′-GTTTCTGAAAATTACAGGGTCATTTGTG-3′。以2-ΔΔCt法计算miR-20a和miR-22的相对表达量。
2 结果
2.1 两组血清miR-20a、miR-22水平比较 胃癌组、对照组血清miR-20a水平分别为7.09±1.97、4.12±1.33,两组比较差异有统计学意义(t=11.854,P<0.01);血清miR-22水平分别为4.61±1.28、10.69±3.45,两组比较差异有统计学意义(t=15.675,P<0.01)。
2.2 血清miR-20a、miR-22水平与胃癌患者临床病理特征的关系 见表1。
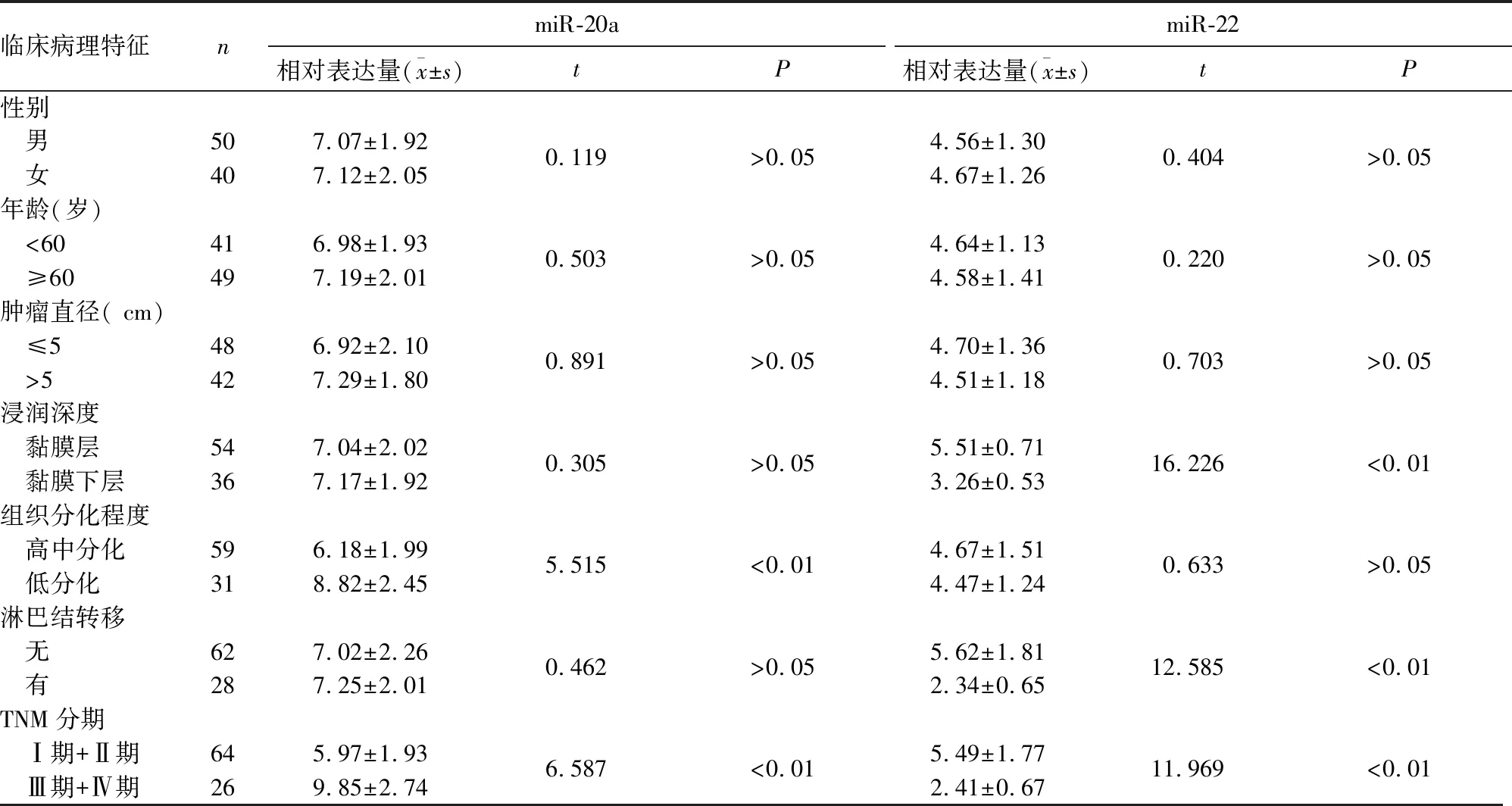
表1 血清miR-20a、miR-22水平与胃癌患者临床病理特征的关系
2.3 胃癌患者血清miR-20a与miR-22的关系 胃癌患者血清miR-20a水平与miR-22水平呈负相关(r=-0.864,P<0.01)。
2.4 血清miR-20a与miR-22对胃癌的诊断价值 以胃癌组(n=90)为阳性样本,以对照组(n=90)为阴性样本,再将miR-20a与miR-22两指标水平划分成7~10个组段,建立ROC曲线诊断分析模型。发现两指标对胃癌具有较高的诊断价值,见表2。

表2 血清miR-20a与miR-22对胃癌的诊断价值
3 讨论
miRNA是目前肿瘤领域新兴的研究热点之一,在胃癌发病过程中一系列miRNA表达发生异常,具有作为胃癌诊断和治疗靶点的潜力[10]。miR-20a在前列腺癌等肿瘤中表达上调,并能促进肿瘤细胞增殖[11]。本研究发现,胃癌患者血清miR-20a水平上调,并且血清miR-20a水平与胃癌患者组织分化程度和TNM分期有关。Yuan等[12]发现,在多发性骨肉瘤中蛋白酪氨酸磷酸酶基因(PTEN)是miR-20a的直接下游靶点,miR-20a能抑制PTEN表达,从而促进多发性骨肉瘤细胞增殖,抑制肿瘤细胞凋亡。Gao等[13]发现,在乳腺癌细胞中PTEN同源物假基因1(PTENP1)与PTEN能竞争性结合miR-20a,乳腺癌细胞中PTENP1表达量上调促使更多的miR-20a与PTENP1结合,从而解除miR-20a对PTEN表达抑制效应。同时PTEN能够通过抑制磷脂酰肌醇-3-羟激酶(PI3K)/丝苏氨酸蛋白激酶(AKT)信号通路抑制乳腺癌细胞增殖。胃癌中miR-20a表达上调能促进miR-20a与PTEN等抑癌基因mRNA的结合并促进其降解,从而导致PTEN等抑癌基因表达下降,使得PTEN对PI3K/AKT信号通路的抑制效应解除,从而激活肿瘤细胞中的PI3K/AKT信号通路,促进肿瘤细胞增殖。另外,miR-20a亦能直接促进TAK1等癌基因的转录,使得TAK1等癌基因表达上调,进而促进肿瘤细胞增殖。
miR-22在乳腺癌等肿瘤中表达下调,在肿瘤侵袭和转移中发挥重要作用[14]。本研究发现,胃癌患者血清miR-22水平下调,并且血清miR-22水平与浸润深度、淋巴结转移和TNM分期有关。Wongjampa等[15]发现,宫颈癌中组蛋白脱乙酰基酶(HDAC6)是miR-22直接下游靶点,miR-22与HDAC6基因mRNA的3′-UTR区域结合而抑制HDAC6的反应,从而抑制肿瘤细胞的转移。Zhang等[16]发现Snail基因是miR-22的作用靶点,miR-22与Snail基因mRNA结合促使Snail的mRNA大量降解,从而导致Snail表达下调。Snail是肿瘤相关转录因子,下游靶基因多参与肿瘤间充质转化,Snail表达与肿瘤间充质转化和肿瘤转移密切相关,Snail表达下调会导致肿瘤细胞转移和侵袭能力下降。Xu等[17]发现,miR-22能下调膀胱癌中丝裂原激活的蛋白激酶1(MAPK1)基因表达,从而抑制MAPK信号通路的活化,导致肿瘤转移能力下降。胃癌中miR-22表达下降能够促进HDAC6、Snail和MAPK1等肿瘤转移相关基因的表达,促进MAPK等肿瘤转移相关信号通路的活化和肿瘤上皮间充质转化的发生,从而导致肿瘤转移能力增强。
本研究进一步发现,胃癌患者血清miR-20a与miR-22呈负相关。这主要是由于胃癌中miR-20a主要起癌基因的作用,而miR-22主要起抑癌基因的作用,二者可能存在相互拮抗。而Li等[18]研究显示,长链非编码RNA MALAT1能激活T细胞受体信号通路,进而上调miR-20a表达。在胃癌中,长链非编码RNA MALAT1能与miR-22结合并促进miR-22降解,导致患者miR-22水平下降,同时激活T细胞受体信号通路而上调miR-20a表达,从而导致患者血清miR-20a水平升高。本研究发现,相较单项诊断,血清miR-20a与血清miR-22联合诊断的灵敏度和特异度更高,表明血清miR-20a和miR-22检测在胃癌诊断中具有一定临床意义。
综上所述,胃癌患者血清miR-20a水平升高,而血清miR-22水平降低,二者表达呈负相关;联合检测二者水平有助于胃癌诊断。

