SM22α在肿瘤发生发展中作用的研究进展
郭惠珊,宋楠,席豪,王榕,陈宁,吕品
1河北医科大学医学与健康研究院心血管医学研究中心,石家庄050017;2河北医科大学基础医学院细胞生物学教研室
平滑肌22 alpha蛋白(SM22α)又称转凝蛋白(transgelin),于1987年从鸡胃平滑肌中分离得到,因其相对分子质量为22 kD而得名,其cDNA和蛋白质的一级结构在进化上高度保守。小鼠SM22α基因定位于9号染色体,全长6 271 bp,由5个外显子和4个内含子组成,编码一个由201个氨基酸残基组成的蛋白质分子。SM22α是钙调蛋白家族的一种肌动蛋白结合蛋白,包含一个氨基末端CH结构域和一个羧基末端钙调蛋白样重复基序(CLR),通过直接结合肌动蛋白微丝结构影响细胞骨架的重塑。以往研究主要集中于SM22α在血管重构中的作用,生理水平的SM22α通过调控血管平滑肌细胞(VSMC)表型转化[1~3]、增殖、迁移、氧化应激[4]、炎症[5, 6]和糖代谢[7]等,在维持血管稳态中起关键作用。现就SM22α的结构特征及其在肿瘤发生发展中的作用进行综述。
1 SM22α的表达特点
1.1 SM22α的表达具有时空和组织特异性 SM22α在脊椎动物胚胎发育阶段即在平滑肌组织(E9.5)中开始表达,并在心肌(E8.5~E12.5)和骨骼肌(E9.5~E12.5)组织中出现一过性表达。胚胎后期及出生后成熟组织中SM22α主要在平滑肌组织特异性表达,如子宫、膀胱、胃、前列腺等,是一种重要的平滑肌标志物。此外,SM22α亦可在血管内皮、心脏、脊髓、肾上腺等非平滑肌组织表达。
1.2 SM22α表达具有细胞表型特异性 已知SM22α在收缩型VSMC高表达,而在合成型VSMC中表达急剧下降,故其具有分化表型特异性[1,8]。在肿瘤细胞去分化过程中,SM22α表达亦发生显著变化,但与平滑肌细胞不同的是,不同类型肿瘤细胞SM22α表达变化有差异。如SM22α在前列腺癌[9]、结肠癌[10~12]、宫颈癌、非小细胞肺癌和膀胱癌[13]等肿瘤中低表达甚至不表达,而在胃癌、食管癌、胰腺癌、肾细胞癌等组织中高表达,在乳腺癌[14,15]中有双重作用。Li等[16]指出,高表达的SM22α主要见于富含平滑肌的组织而非肿瘤细胞层,这可能与胃的解剖学结构有关。基于食管与胃的结构和功能密切相关,食管鳞癌与胃癌可能有相似的SM22α表达特点。SM22α在间充质细胞中表达,而在上皮细胞的表达量极低,当肿瘤细胞经历上皮细胞向细胞间充质转化(EMT)时,也就意味着SM22α在间充质细胞的重新表达。
2 SM22α在肿瘤发生发展中的作用
SM22α的发现已有30余年历史,但直到2000年左右,人们才对其功能有初步认识。其首要功能是肌动蛋白结合蛋白,这一特性赋予了它在个体发育、细胞黏附、运动等方面强大的生物学功能[17],其介导的细胞骨架调控网络为细胞的稳态调节和损伤后修复提供了不可或缺的微环境(图1)。生理条件下,SM22α缺失并不影响血管等平滑肌组织的正常发育和功能,这就意味着SM22α功能可能被其同源蛋白Calponin或平滑肌22β(SM22β)所补偿。然而,病理状态时,SM22α的功能是不可替代的。SM22α在动脉粥样硬化斑块[6, 18]、血管成形术后再狭窄[6]、血管钙化[19]、主动脉夹层[20]和主动脉瘤[21]等血管损伤性疾病中表达急剧下调,且下调水平与血管损伤程度呈正相关。因此,SM22α表达降低不仅是鉴定平滑肌细胞去分化的一个特异性标志物[1],还直接参与血管损伤。近年来,有关SM22α在血管损伤修复中的作用,国内外实验室展开了大量研究。SM22α可作为伴侣分子或支架蛋白,以actin结合依赖或非依赖的方式,于不同的亚细胞间隔区募集或整合信号分子,决定信号转导方向和应答性质,参与调控VSMC表型转化[1]、增殖、迁移、氧化应激[4]、炎症[5]、收缩[22]、葡萄糖代谢[7]和转运[3]、血管新生内膜形成[4]、血管肥厚[4]、平滑肌细胞向成骨细胞转化等生物学过程,维持血管稳态。此外,衰老的哺乳动物细胞中,SM22α表达上调,且慢性氧化应激状态下,过表达SM22α诱导人成纤维细胞复制性衰老,提示高水平SM22α在衰老中的潜在作用。成年大鼠肾小球肾炎发生时,足细胞持续高表达SM22α可加重肾小球硬化病变的进程。这些发现启示我们,SM22α可在特定的病理条件下发挥作用,适宜的SM22α表达水平/模式有助于损伤修复微环境的构建。但目前的主要研究对象仍然是血管,SM22α在肿瘤发生发展中的作用,特别是机制研究,仍处于起步阶段。
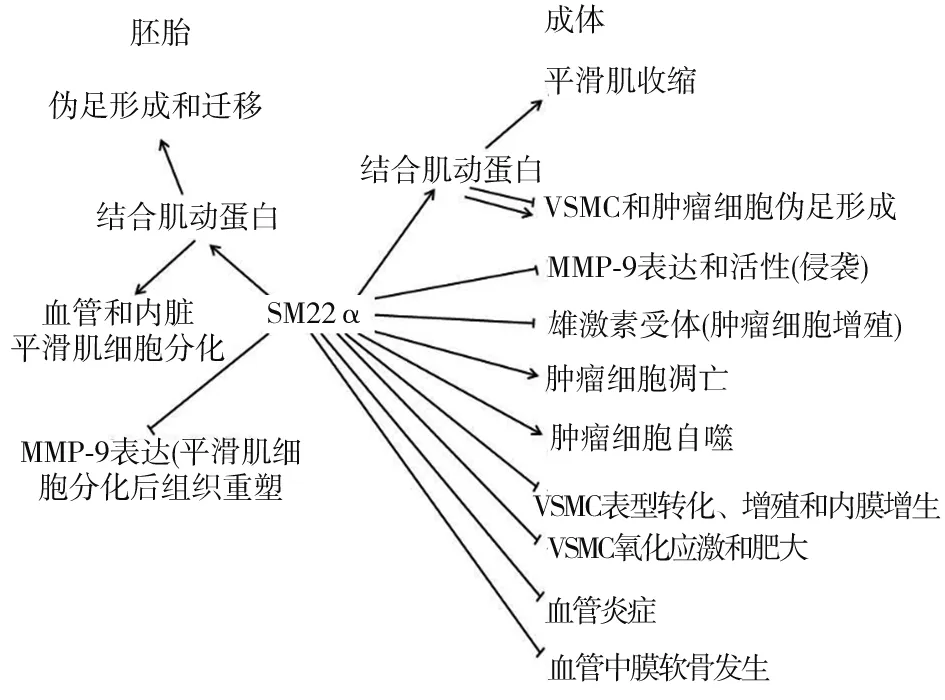
图1 SM22α的生物学功能
2.1 SM22α在肿瘤细胞骨架动力学中的作用 以细胞骨架重塑为基础的细胞增殖、迁移、趋化和黏附等生命活动是肿瘤发生发展的重要病理生理学基础。国内外大量研究表明,作为细胞骨架相关蛋白,SM22α可通过CLR基序直接或间接与肌动蛋白结合,参与VSMC F-actin的聚合/解聚,且该过程与SM22α的表达和表观遗传学修饰有关[3]。Matsui等[23]研究表明,在A7r5平滑肌细胞中,SM22α通过CH结构域和EF-hand参与肌动蛋白复合物的形成,间接作用于肌动蛋白和伪足形成,而CLR基序与肌动蛋白相互作用不显著。Prasad等[24]通过基因芯片GO分析发现,SM22α在前列腺癌组织中表达下调,并且SM22α在调节其他actin结合蛋白基因(tropomyosin、smoothelin、dystonin、actinin和vinculin)表达活性中起关键作用。Thompson等[25]指出,在REF52成纤维细胞中,应用小干扰RNA(siRNA)敲低SM22α,可见SM22α敲低组在血清饥饿的刺激下,更易引发细胞伪足形成、运动和侵袭;在人前列腺癌细胞PC3中,过表达SM22α,细胞的运动和侵袭能力显著下降,进一步印证了SM22α功能的特异性和重要性。这些结果提示,SM22α表达下调影响细胞骨架动力学和调控网络,导致细胞内外环境失衡和细胞功能紊乱,是肿瘤细胞恶性发展的关键环节。
2.2 SM22α在细胞侵袭和转移中的作用 肿瘤的侵袭和转移是治疗失败的主要原因。Yang等[15]指出,在两种乳腺癌细胞(BT-549, MDAMB-231)、Ⅰ~Ⅲ期原发性乳腺癌及无转移的临床标本中,SM22α具有抑癌作用,低表达的SM22α促进人乳腺癌细胞迁移能力,而过表达SM22α抑制乳腺癌细胞的肺转移。低表达SM22α使线粒体质量新分布,过氧化物还原酶表达下调,促进活性氧(ROS)生成和核因子-κB (NF-κB)活化,进而导致转移相关基因如趋化因子受体4(CXCR4)、基质金属蛋白酶-1 (MMP-1)和MMP-2表达上调,提示SM22α可能通过激活ROS/NF-κB信号通路促进乳腺癌转移。Sayar等[26]研究亦证实,与非致瘤性乳腺细胞相比,乳腺癌细胞中SM22α基因启动子区高度甲基化导致其表达下调,敲低SM22α增加细胞的侵袭与迁移能力。然而,Liu等[27]发现,在乳腺癌细胞MCF-7/S和MDA-MB-231中,高表达SM22α可增强乳腺癌细胞的迁移能力,促进裸鼠体内肿瘤形成及肺部转移。进一步研究表明,过表达SM22α通过下调人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(PTEN)表达,激活PI3K/Akt/GSK-3通路,调控细胞周期、迁移、分化、凋亡等。Aikins等[14]在研究SM22α与血管生成拟态(VM)关系时亦发现,在人乳腺癌细胞MDA-MB-231中敲低SM22α,细胞增殖和VM形成受抑,IL-8和CXCR2的表达下调[28]。SM22α对乳腺癌细胞系侵袭和转移作用的差异可能与这些细胞系不同核型、突变状态和蛋白质组特征等有关[29]。Zhao等[12]发现,过表达SM22α削弱了人结直肠癌细胞HCTL16的侵袭和转移能力。进一步研究表明,过表达SM22α抑制细胞外信号调节激酶(ERK)的磷酸化和MMP-9的表达,可能通过ERK/MMP-9信号通路调节结直肠癌侵袭和迁移能力。此外,SM22α还参与膀胱癌、食管鳞癌等多种肿瘤的侵袭和转移,具体发挥抑癌作用还是促癌作用与激活不同信号通路及不同调控分子参与有关。
2.3 SM22α在肿瘤细胞增殖和凋亡中的作用 肿瘤的发生与细胞的无限增殖和异常凋亡有关,是两者平衡失调的结果。本课题组的研究表明,过表达SM22α抑制VSMC增殖和血管新生内膜形成,但对VSMC凋亡几乎无影响。然而,SM22α参与结直肠癌[12]、膀胱癌[13]、前列腺癌[9]等肿瘤细胞增殖和凋亡的调控,且具有不同的调控模式。Tsui等[13]发现,在人膀胱癌细胞HT1376和人膀胱癌组织中,敲低SM22α可促进膀胱癌细胞增殖,而过表达SM22α抑制膀胱癌细胞增殖,该过程与p53和PTEN有关。Zhang等[9]研究发现,SM22α以p53依赖的方式诱导细胞凋亡,过表达SM22α促进人前列腺癌细胞LNCaP中p53表达及p53从胞核向胞质转位,胞质中积累的p53引发凋亡相关基因B细胞淋巴瘤/白血病-2蛋白(Bcl-2)表达下调,Bcl-2相关X蛋白(Bax)表达上调,进而触发Caspase-3表达诱导细胞凋亡。
微小RNA(miRNA)通过调控靶基因表达发挥癌基因或抑癌基因的功能,参与肿瘤的发生、发展、侵袭和转移过程。Tang等[30]发现,食管鳞癌组织和细胞中miR-133b表达低于癌旁组织,经TargetScan和miRDB在线软件预测和双荧光素酶报告基因证实,SM22α是miR-133b的靶基因,过表达miR-133b使SM22α表达显著下调。miR-133b通过调控SM22α表达,在食管鳞癌细胞增殖中发挥重要作用。
2.4 SM22α在细胞外基质(ECM)降解中的作用 ECM是肿瘤细胞侵袭和转移过程中的天然组织屏障,而MMP是降解ECM的一种重要的蛋白水解酶,几乎能降解多糖以外的所有ECM成分,增强癌细胞的侵袭能力。SM22α是一个新型的MMP-9基因抑制因子。在人纤维肉瘤细胞HT1080中,过表达SM22α显著抑制MMP-9表达,反之,敲低SM22α显著增强MMP-9的表达活性。免疫组化结果同样显示,与野生型相比,SM22α基因敲除鼠子宫MMP-9水平明显升高。进一步研究结果表明,SM22α的CH结构域通过靶向ERK信号通路,抑制癌基因蛋白c-Fos与MMP-9启动子区AP-1结合位点的相互作用,进而抑制MMP-9的表达活性,该结果为其他恶性肿瘤组织中SM22α和MMP-9表达的负相关性提供了进一步证据,同时也提示SM22α能以actin结合非依赖的方式调控基因表达,进一步丰富了SM22α的生物学功能,体现了其功能的多样性。
2.5 SM22α在细胞自噬中的作用 自噬是将细胞内受损、变性或衰老的蛋白质和细胞器运输到溶酶体进行消化降解的过程。自噬和肿瘤的关系复杂,在肿瘤发生的早期阶段,自噬可抑制肿瘤细胞形成;在肿瘤的发展阶段,细胞可通过适度的自噬促进肿瘤存活,过度的自噬亦可诱导肿瘤细胞自噬性死亡。Xie等[11]研究发现,SM22α在结直肠癌组织和结肠癌细胞(HCT116、HT29)中表达急剧下调,且与结直肠癌低自噬活性相关。在SM22α低表达的恶性结肠癌样本中,p62表达均升高,而过表达SM22α显著抑制结直肠癌细胞株p62表达,该结果初步证实SM22α可能参与肿瘤细胞自噬活性的调节。
2.6 SM22 α在肿瘤耐药中的作用 肿瘤耐药是恶性肿瘤化疗失败的主要原因。体内外研究发现,肿瘤耐药与靶基因突变、靶基因扩增、DNA损伤修复能力、药物进入肿瘤细胞内浓度减少等诸多因素有关,提示肿瘤耐药分子机制的复杂性。SM22α在以紫杉醇为诱导剂的人乳腺癌耐药细胞MCF-7/PTX中异常高表达,促进MCF-7/PTX发生EMT,使细胞间连接缺失,增加肿瘤细胞的增殖和侵袭能力。siRNA敲低SM22α,改变MCF-7/PTX中EMT标志因子表达,进而抑制MCF-7/PTX细胞耐药和侵袭转移。另有研究表明,SM22α通过增加Akt、GSK-3β磷酸化水平和减少PTEN的表达,激活GSK-3β/PI3K/Akt通路,参与紫杉醇耐药,其中PI3K/Akt通路参与乳腺癌细胞的迁移和侵袭[27]。
综上所述,SM22α主要表达于成体平滑肌细胞,虽然在其他特定组织表达量低,但对细胞功能和状态的维持必不可少,其表达的时空秩序性和表型特异性更提示了该蛋白功能的复杂性。目前,对SM22α与肿瘤关系的研究,主要侧重于SM22α的表达与肿瘤发生的相关性,表达与肿瘤病理分型分期及预后的关系尚不明确,作用机制的研究亦鲜有报道。深入探寻细胞骨架相关蛋白在恶性肿瘤发生发展中的作用和分子机制,将对恶性肿瘤的精准医疗和个体化医疗产生深远影响。

