大肠杆菌鞭毛蛋白不同结构域与F4 菌毛主要结构亚单位FaeG 嵌合基因的构建及其表达蛋白的功能研究
吴文文,庞胜美,丁雪燕,刘思国,王晓钧,段强德*,朱国强*
(1. 扬州大学 兽医学院,江苏 扬州 225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心/教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009;3. 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
由FliC 基因编码的鞭毛素蛋白是大肠杆菌鞭毛的主要结构蛋白,由高度保守的氨基端(N-terminal domain)、羧基端(C-terminal domain)和中间的可变区(Hypervariable region)3 个结构域组成。鞭毛蛋白的N 端和C 端通过α螺旋结构组成D0 和D1 区的高度保守区域,与鞭毛蛋白介导的促炎性信号传导相关。鞭毛蛋白的可变区形成β折叠结构,组成了位于鞭毛丝外表面的D2 和D3 结构域,与鞭毛蛋白抗原多样性相关[1-2]。鞭毛除了作为细菌的运动器官和一些病原菌的重要毒力因子外,鞭毛蛋白还具有很强的免疫佐剂活性。鞭毛蛋白是一种重要的病原体相关分子模式(Pathogen-associated molecular patterns,PAMPs),能激活细胞表面的TLR5 或者胞内的NLRC4(NLR family CARD domain-containing protein 4)和NAIP5(NLR family,neuronal apoptosis inhibitory protein 5)信号通道,诱导机体促炎性因子的产生,激发机体的先天性免疫反应,从而发挥其免疫佐剂活性的作用[3-6]。与传统的铝胶佐剂相比,鞭毛蛋白能同时诱导体液免疫和细胞免疫,并且副作用少。
近年来,鞭毛蛋白的免疫佐剂活性越来越受到国内、外学者的关注,具有潜在的应用前景。研究认为鞭毛免疫佐剂活性的发挥主要是通过其N 端的保守区与TLR5 的结合来实现的[7],但是最新的研究发现将重组的HIV-1 p24 重组蛋白作为模型抗原,与沙门氏菌鞭毛蛋白FliC、FliC-L3A(缺乏NLRC4 活性)、FliCΔ90-97(缺乏TLR5 活性)和FliCΔ90-97:L3A(既无TLR5 活性,也无NLRC4 活性)混合免疫小鼠,研究结果表明无NLRC4 活性的FliC-L3A 反而具有更强的免疫佐剂活性,能诱导更高滴度的p24 特异性抗体[8]。因此,鞭毛蛋白最佳免疫活性的发挥是否需要鞭毛素整个完整的结构域,以及不同结构域在其中发挥多大的作用仍存在争议。为了更好的认识和充分发挥鞭毛素的免疫佐剂活性,本研究以产肠毒素性大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)F4菌毛主要结构亚基FaeG为模型抗原,分别构建了鞭毛蛋白不同结构域与其串联表达的FliC-FaeG、FliCN-FaeG、FliCNV-FaeG 嵌合基因,并对其进行原核表达、纯化和鉴定,为下一步阐明深入鞭毛蛋白的免疫佐剂活性机制提供了实验依据。
1 材料与方法
1.1 质粒、菌株、细胞株与载体F4ac+ETEC 国内标准株(O8∶K87∶H19)、出血性大肠杆菌EDL933(O157∶H7)、大肠杆菌DH5α和BL21(DE3)、原核表达载体pET-28a(+)和人结直肠腺癌细胞Caco-2均由本实验室保存。
1.2 主要试剂T4 DNA 连接酶和Phusion High-Fidelity DNA 聚合酶购自Thermo Scientific 公司;限制性内切酶BamHI 和SalI-HF(High fidelity enzyme)均购自NEB 公司;Protino®Ni-TED 2000 Packed Columns 纯化试剂盒购自Macherey-Nagel 公司;抗FaeG 蛋白单克隆抗体(MAb)由本实验室制备;抗大肠杆菌FliCH7的多抗血清购自天津生物芯片技术有限公司;山羊抗兔IgG-HRP 和山羊抗鼠IgG-HRP 购自Sigma 公司;引物由南京擎科生物科技公司合成;IL-8 和TNF-α ELISA试剂盒购自欣博盛生物科技有限公司。
1.3FliC-FaeG、FliCN-FaeG和FliCNV-FaeG嵌合基因的构建根据GenBank 中已登录的大肠杆菌O157∶H7 中FliC 基因(AY249992)及F4ac+ETEC 参考菌株的FaeG 基因序列(AJ616236.1),分别设计引物P1~P8(表1)。采用煮沸裂解法制备大肠杆菌O157∶H7和F4ac+ETEC DNA 模板,利用含有FaeG 同源臂的P1/P3 引物扩增FliC 基因片段、含有FaeG 同源臂的P1/P5 引物扩增FliCN 基因片段,含有FaeG 同源臂的P1/P7 引物扩增FliCNV 基因片段,反应条件为:95 ℃3 min;94 ℃30 s、55 ℃30 s、72 ℃3 min,45 个循环;72 ℃7 min,4 ℃终止。其中利用含有和FliC、FliCN、FliCNV 基因同源臂的P2、P4、P6 引物分别与P8 引物扩增FaeG 基因片段。反应条件为:95 ℃3 min;94 ℃30 s、48 ℃30 s、72 ℃2 min,45 个循环;72 ℃7 min,4 ℃终止。将FliC、FliCN、FliCNV基因分别与FaeG 基因等比例混合作为模板,然后共同利用引物P1/P8 进行重叠延伸PCR 扩增获得融合基因FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG,反应条件为:95 ℃3 min;94 ℃30 s、51 ℃30 s、72 ℃3 min,45 个循环;72 ℃7 min,4 ℃终止。

表1 PCR 引物Table 1 Primers used in this study
1.4 各融合蛋白的二级结构预测通过Phyre 和Py-MOL[9]软件对FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG融合蛋白进行二级结构分析,3 种嵌合基因中间用GPVDLinker[10]连接。
1.5 重组质粒的构建与鉴定利用BamHⅠ和SalⅠ分别双酶切FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG嵌合基因及原核表达载体pET-28a(+)后,用T4 DNA连接酶连接,构建的重组质粒经PCR 鉴定正确后,由南京擎科生物科技公司测序鉴定,将测序正确的重组质粒分别命名为pET-FliC-FaeG、pET-FliCNFaeG、pET-FliCNV-FaeG。
1.6 重组蛋白的表达纯化与鉴定将测序正确的重组质粒分别电转化至大肠杆菌BL21(DE3)感受态细胞中,培养至对数生长期(OD600nm=0.4~0.5 时),经IPTG(终浓度1 mmol/L)诱导表达4 h 后离心收集细菌沉淀经超声破碎后,12 000 r/min 离心15 min,分别收集上清和沉淀。SDS-PAGE 检测重组蛋白FliCFaeG、FliCN-FaeG 和FliCNV-FaeG 的表达,将包涵体按照Ni2+螯合亲和层析试剂盒说明书进行纯化与复性。纯化的蛋白样品经SDS-PAGE 电泳后电转至硝酸纤维素膜上,以小鼠抗FaeG MAb(1∶1 000)为一抗,山羊抗鼠IgG-HRP(1∶5 000)为二抗,对重组蛋白FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG 进行western blot 鉴定,以大肠杆菌FliCH7 阳性血清(1∶7 500)为一抗,山羊抗兔IgG-HRP(1∶10 000)为二抗,western blot 检 测 重 组 蛋 白FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG 的反应原性。
1.7 TLR5 生物活性检测根据Huleatt 等的方法[11],利用表达TLR5 的Caco-2 细胞检测融合蛋白的TLR5受体活性:接种Caco-2 细胞至96 孔细胞培养板中,待细胞形成80%单层时,加入终浓度为5 μg/mL 纯化的FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG 重组蛋白,其中,用未处理的Caco-2 细胞作为阴性对照,刺激Caco-2 细胞6 h 后,收集细胞上清液,采用IL-8 和TNF-α ELISA 试剂盒进行检测。
1.8 统计分析试验在同一批次细胞内重复至少3次,数据采用SPSS18.0 统计分析软件对试验结果进行t-test 检验,p<0.05 认定为差异显著,采用Graph-Pad Prism 软件绘图。
2 结 果
2.1FliC-FaeG、FliCN-FaeG和FliCNV-FaeG融合片段的构建及重组质粒的鉴定以大肠杆菌O157∶H7 基因组为模板,分别利用P1/P3、P1/P5、P1/P7 引物扩增FliC、FliCN、FliCNV 基因片段,利用P8 引物与P2、P4、P6 引物扩增FaeG 基因片段。结果显示在约1 700 bp、500 bp、1 500 bp 和800 bp处出现各目的片段,与预期大小一致(图1)。PCR产物经胶回收,将FliC、FliCN、FliCNV 基因分别与FaeG 基因等比例混合作为模板,利用P1/P8 引物经PCR 扩增融合片段,结果显示分别在约2 600 bp、1 300 bp 和2 300 bp 出现目的条带,与预期大小一致(图1)。进一步将融合片段产物克隆至pET-28a(+)载体中,经PCR(图2)和测序鉴定,结果表明各重组质粒均构建正确。

图1 FliC-FaeG、FliCN-FaeG、FliCNV-FaeG 基因的融合PCR 扩增结果Fig.1 FliC-FaeG,FliCN-FaeG,FliCNV-FaeG fusion gene PCR amplification results

图2 重组质粒pET-FliC-FaeG、pET-FliCN-FaeG、pET-FliCNV-FaeG 的PCR 结果Fig. 2 PCR product of the recombinant plasmid pET-FliC-FaeG,pET-FliCN-FaeG and pET-FliCNV-FaeG
2.2 融合蛋白的二级结构预测通过PyMOL[9]对FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG 融合蛋白的二级结构预测,结果显示融合蛋白中FaeG 抗原(红色)与鞭毛蛋白不同结构域(绿色)紧密结合(图3)。表明在融合蛋白中FaeG 和FliC 蛋白不同结构域融合后仍能保持各自独立的空间结构。
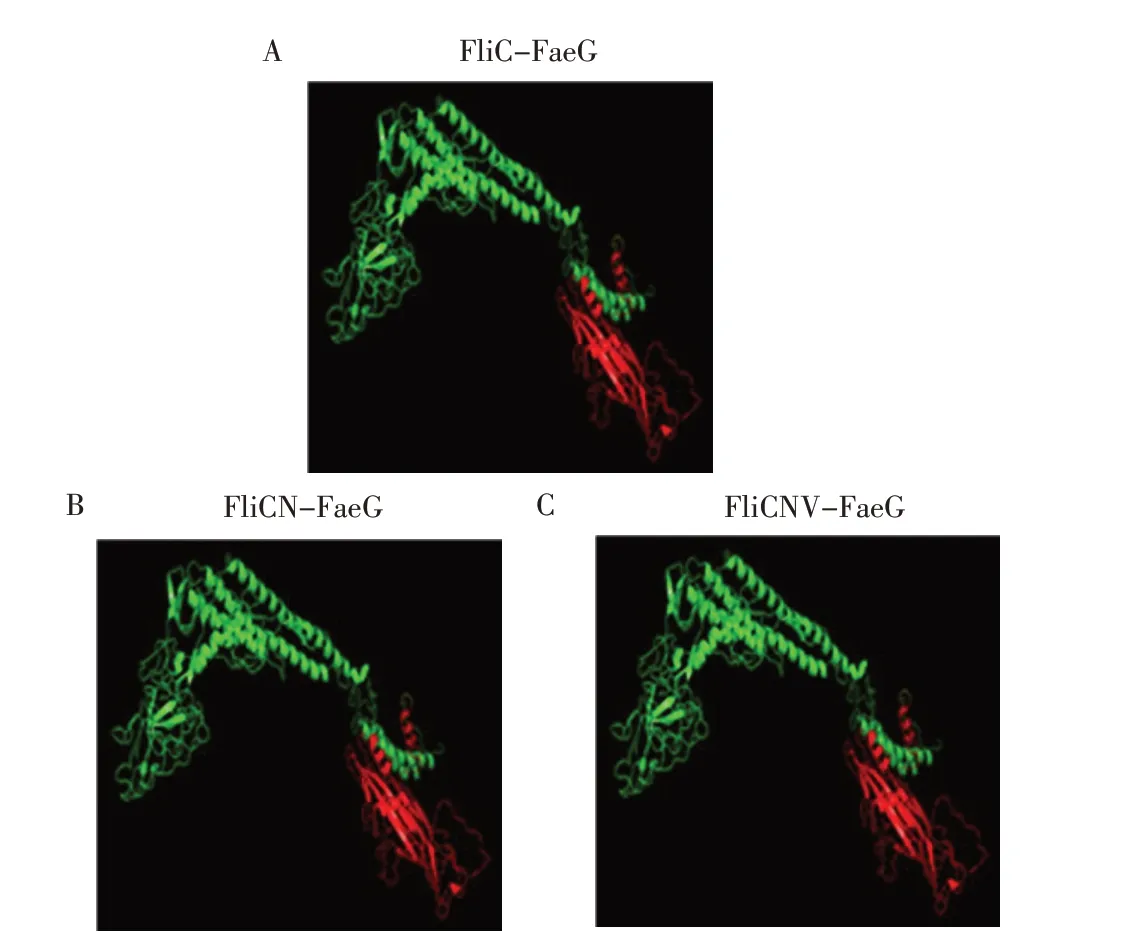
图3 融合蛋白二级结构模型Fig.3 The secondary structure model of fusion proteins
2.3 重组蛋白的表达与纯化各重组菌经IPTG 诱导后经SDS-PAGE 检测,结果显示分别在约90 ku、48 ku、80 ku 处出现目的条带,与预期结果相符(图4A)。Western blot 检测结果显示包含FliCH7 鞭毛蛋白高变区的FliC-FaeG 和FliCNV-FaeG 融合蛋白能够被抗FliCH7 的多克隆抗体识别,FliCN-FaeG 融合蛋白由于不含鞭毛蛋白中间的高变区,因此不能被识别(图4B),表明融合后FliCH7 仍具有生物学活性。3 种融合蛋白均能够被抗FaeG 的MAb 识别(图4C),而pET-28a(+)/BL21 诱导后菌体蛋白(阴性对照)无此目的条带。表明3 个融合蛋白均获得了正确的表达,并且具有良好的反应原性。

图4 重组蛋白的SDS-PAGE检测(A)及western blot鉴定(B和C)Fig.4 Analysis of purified FliC-FaeG,FliCN-FaeG,FliCNVFaeG protein by SDS-PAGE(A)and western blot(B and C)
2.4 TLR5 活性检测为了评估FliC-FaeG、FliCNFaeG 和FliCNV-FaeG 重组蛋白的TLR5 受体活性,将Caco-2 细胞与5 μg/mL 浓度的蛋白质一起孵育,测定6 h 后细胞上清中的IL-8 和TNF-α水平。结果显示,FliC-FaeG 组产生的IL-8 和TNF-α水平显著高于对照组、FliCN-FaeG 和FliCNV-FaeG 组(p<0.05)(图5),FliCN-FaeG 和FliCNV-FaeG 组无TLR5 受体活性,不能刺激IL-8 和TNF-α炎性因子的产生。表明完整的鞭毛蛋白结构是其激活TLR5 受体活性所必需的。

图5 融合蛋白TLR5 活性检测Fig.5 Detection of TLR5 activity of fusion proteins
3 讨 论
鞭毛蛋白具有很强的免疫佐剂活性,其发挥免疫佐剂活性的机制目前认为是通过其保守结构域与宿主细胞的TLR5 和NLRC4 受体结合[8],激活机体先天性免疫反应而发挥作用。但是目前对鞭毛蛋白免疫佐剂活性的充分发挥是否需要完整的结构仍存在争议[12-14],另外对其免疫佐剂活性机制和应用的研究都主要集中在鼠伤寒沙门氏菌的鞭毛蛋白[15-16]。为探讨大肠杆菌鞭毛蛋白是否具有同样的免疫佐剂活性,以及不同结构域的免疫佐剂活性是否具有差异性,本研究以ETEC 表达的F4 菌毛的主要结构亚单位FaeG 为模型抗原,构建了大肠杆菌FliCH7 鞭毛蛋白的不同结构域FliC、FliCN、FliCNV 与FaeG的融合蛋白。通过对融合蛋白的结构进行分析,表明在融合蛋白中FaeG 和FliCH7 蛋白不同结构域融合后仍能维持各自独立的结构。进一步的western blot 鉴定结果证明,FliC-FaeG、FliCN-FaeG 和FliCNV-FaeG 均可被抗FaeG 的抗体识别,包含FliCH7 鞭毛蛋白高变区的FliC-FaeG 和FliCNV-FaeG 融合蛋白可被抗FliCH7 的抗体识别,这表明融合后FliCH7 和FaeG 仍具有生物学活性。Vida 等发现鞭毛蛋白C 末端D0 区与TLR5 胞外域进行额外的相互作用,通过促进受体二聚化在TLR5 激活中发挥作用,完整的鞭毛蛋白能更好的激活TLR5 受体,促进IL-8 和TNF-α炎性因子的分泌[17]。本实验TLR5 受体活性检测结果表明,仅FliC-FaeG 重组蛋白能激活TLR5,促进IL-8、TNF-α等细胞因子的产生,表明完整的鞭毛蛋白结构是其激活TLR5 受体活性所必需的。
本研究为下一步研究鞭毛蛋白不同结构域在免疫佐剂活性中的作用奠定了基础。另外,鉴于鞭毛蛋白具有强的免疫佐剂活性,为下一步评估将鞭毛蛋白作为F4+ETEC 疫苗新型的免疫佐剂和融合蛋白作为预防F4+ETEC 引起断奶仔猪腹泻疫苗候选抗原提供了研究基础。
——一道江苏高考题的奥秘解读和拓展

