拟南芥START 结构域亚家族生物信息学分析及功能
李晓凯,刘 霞,常红娟,王凤茹
(河北省植物生理与分子病理学重点实验室/河北农业大学真菌毒素与植物分子病理学实验室,河北 保定 071000)
START 结构域是一个长度约为220 个氨基酸且可以结合并转移脂质的结构域。X 射线晶体学揭示了START 域的α/β 螺旋和反平行β 折叠结构,内含一个疏水腔,腔内可容纳单一配体分子,如固醇、磷脂、胆汁酸和神经酰胺[1]。据报道,一些含START 结构域的蛋白质还可与类胡萝卜素和叶黄素结合[2]。已有研究表明START 结构域在动物中具有重要的生物学功能[3-14],但植物中START 结构域的功能及作用机制尚不明确。拟南芥中,START结构域家族可分为仅含START 结构域和多结构域家族两类,分别由9 个和26 个成员组成。根据结构域组成的不同,可把35 个成员分为5 个亚家族,分别为仅含START 结构域亚家族、START-DUF1336 结构域亚家族、PH-START-DUF1336 结构域亚家族、HD-ZIP-START 结构域亚家族、HD-ZLZ-START结构域亚家族。在HD-ZLZ-START 结构域亚家族中,已被报道具有生物学功能的有ATML1、PDF2、FWA、GL2 和AtEDT1,其中ATML1 和PDF2 通过与其启动子区高度保守的L1 Box 结合来调控相关特异性基因表达[15]。atml-1 pdf2-1双突变体表现出严重的幼苗生长迟缓,芽表皮分生组织缺陷以及开花前生长迟滞的现象,对单基因不同位点突变体分析结果发现,ATML1 和PDF2 是胚胎发生过程中所必需的[16]。FWA 的过量表达会导致植株花序发生异常。ANL2 参与花青素的积累和皮层的发育,anl2突变体不仅在花青素积累存在缺陷[17],而且在根的皮层发育中也存在缺陷。GL2基因缺失后,拟南芥表皮毛数量及分枝数表现出显著的增多[18],AtEDT1在拟南芥中过表达后可以促进根系的伸长,提高植物对深层土壤水分的吸收,从而提高抗旱性[19]。HD-ZIP-START 结构域亚家族中PHB、PHV 和REV胚胎发生过程中起着关键作用,rev 突变体叶片面积增大并发生卷曲,rev/phv双重突变体出现喇叭状叶片,近轴面表现出远轴面特性,rev/phb/phv三重突变体的叶片几乎全是喇叭状,远轴化特征加剧[20]。拟南芥PH-START-DUF1336 结构域亚家族和STARTDUF1336结构域亚家族成员生物学功能尚未见报道,仅含START 结构域亚家族成员除本实验室前期在逆境胁迫下有关报道外,也尚未见其它研究[21]。
本研究利用生物信息学方法,对拟南芥START结构域家族成员进化关系、理化性质、基因结构和启动子作用元件进行分析;利用qRT-PCR 技术分析了编码仅含START 结构域蛋白基因在拟南芥发育不同部位的表达量,并对仅含START 结构域亚家族的8 个成员的功能获得和功能缺失转基因拟南芥幼苗形态进行了观察,为阐述START 结构域在拟南芥生长发育过程中的生物学功能和作用机制奠定了基础。
1 材料及方法
1.1 试验材料
哥伦比亚野生型拟南芥(Arabidopsis thalianaColumbia, Col-0)和仅含START 结构域亚家族功能获得转基因植株种子均由河北农业大学真菌毒素与植物分子病理学实验室保存。
拟南芥仅含START 结构域亚家族成员的T-DNA插 入 突 变 体(SALK-106413C、SALK-053628、SALK-093319、SALK-053261、SALK-102986、SALK-006629、GK-067A04 和GK-056A02),均购于美国ABRC(Arabidopsisiological Resource Center)突变体库,将其依次编号为stard1~stard8。
1.2 拟南芥START 结构域家族的系统发育分析
从 TAIR(The Arabidopsis Information Resource)数据库下载拟南芥START 结构域家族成员的蛋白序列,利用MEGA7.0 软件构建系统发育进化树,利用MEGA7.0 软件分析和构建系统进化树,统计方法为NJ 法。
1.3 拟南芥START 结构域家族的理化性质分析
利用ProtParam(web.expasy.org/protscale/)对拟南芥START 结构域家族成员的理化性质进行分析,利用NCBI 的CD-search 工具预测保守结构域的位置信息。
1.4 拟南芥START 结构域家族的基因结构分析
利用NCBI(https://www.ncbi.nlm.nih.gov/)网站获取START 结构域家族成员的基因序列和CDS序列,利用在线工具GSDS(https://www.himiku.com/amp/gsds)绘制基因结构图。
1.5 拟南芥START 结构域家族的启动子作用元件分析
基于公共数据平台NCBI 下载关于拟南芥基因组的注释信息,使用TBTOOLS 软件中的Gtf/Gff3 序列提取工具,选取含START 结构域家族成员CDS 上游2 000 bp 的启动子序列,将提取到的序列提交至plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/)进行顺式元件预测,根据反馈结果,使用TBTOOLS 软件中的生物序列查看(BioSequence viewer)功能对拟南芥含START 结构域家族成员的启动子作用元件进行可视化分析。
1.6 拟南芥的种植及RNA 的提取
先将拟南芥种子进行消毒杀菌,然后均匀的撒在盛有MS 培养基的培养皿中使其萌发(过表达株系种子撒种在含0.1%潮霉素的MS 培养基),用封口膜封好后放在4 ℃冰箱春化2 ~3 d,取出转移至光照培养箱中培养,培养条件为20 ℃,光照条件为16 h 光照和8 h 黑暗交替进行,待幼苗长到4 片真叶时,将幼苗从培养皿中移植到蛭石和营养土1∶1(v/v)的培养盒中,并定期浇营养液保证其正常生长。
待拟南芥生长至4 周大小时,分别取拟南芥的根、茎、莲座叶和茎生叶等不同的组织和转基因植株成熟莲座叶,放入液氮后转移至-80℃冰箱保存。提取RNA 步骤参考全式金Trzol 法(详细步骤参考说明书)。cDNA 第一条链的合成使用苏州宇恒生物科技公司UEIris II RT-PCR System for First-Strand cDNA Synthesis( with dsDNase)试剂盒操作说明书步骤完成,每次设置3 个生物学重复。
1.7 表达水平的测定
拟南芥样品总RNA 的提取完成后,采用TaKaRa PrimeScript TM RT reagent Kit with gDNA Eraser 试剂盒,反转录合成第一条cDNA 链,利用内参基因UBQ5和编码仅含START 结构域亚家族基因的特异性引物,参照 TransStart Tip Green qPCR Super Mix 说明书进行实时荧光定量分析。每个处理3 次重复,且以野生型在不同部位表达量为1 的基因转录水平作对照,采用比较 Ct 值法(2-ΔΔCt法)分析各个基因在拟南芥的不同部位和不同转基因植株中的相对表达水平。
1.8 引物设计
利用Prime 5.0(加拿大Premier 公司)、NCBI网 站Primer-blast 和DNAMAN( 美 国 的Lynnon Biosoft 公司)设计引物。本试验所用相关引物均为通用生物有限公司合成,引物序列见表1。

表1 试验中所需引物Table 1 Primers needed in the experiment
2 结果与分析
2.1 拟南芥START 结构域蛋白家族的系统发育分析
为了解START 结构域蛋白家族的进化关系,以拟南芥含START 结构域35 个成员的氨基酸序列构建系统发育进化树。结合前期研究,根据所含结构域的不同,将拟南芥START 结构域家族35 个成员分为5 个亚家族,HD-ZIP-START 亚家族有5 个成员,PH-START-DUF1336 亚家族有4 个成员,START-DUF1336 亚家族有1 个成员,仅含START结构域亚家族有9 个成员。如图1 所示,加粗部分为仅含START 结构域亚家族成员,可以看出,9 个成员共分布在4 个大分枝上,At4g26920 和At5g07260在同一个分枝,与其它成员亲缘关系较远。
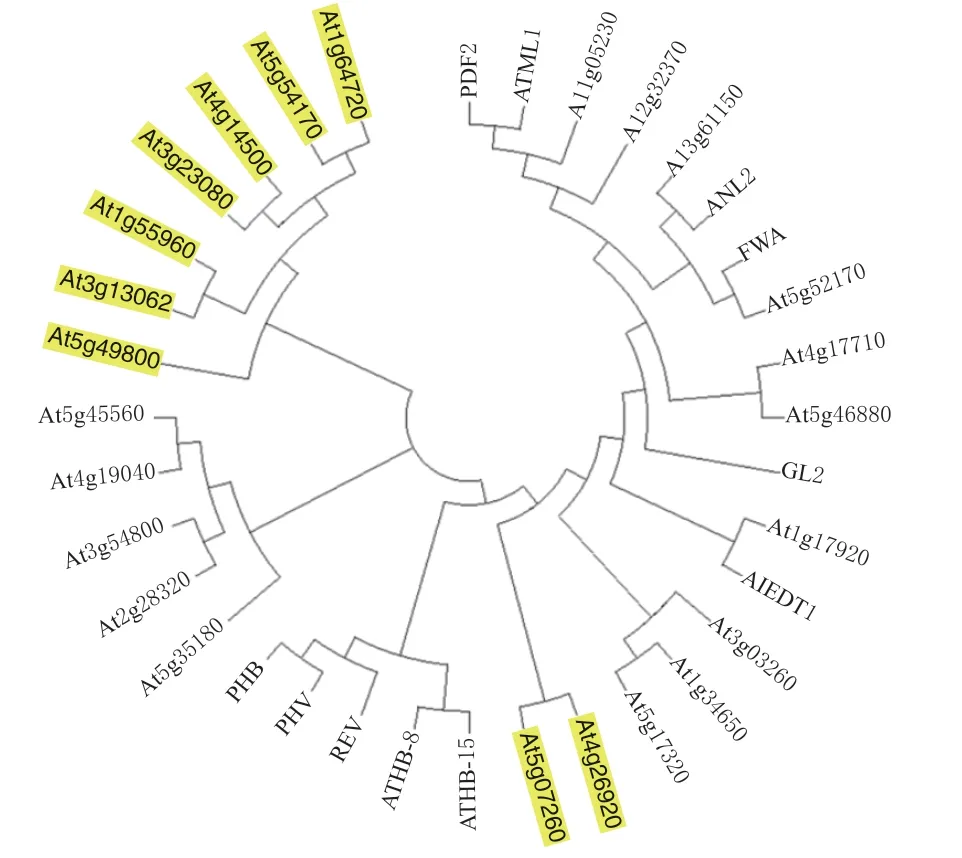
图1 拟南芥含START 结构域基因进化关系分析Fig.1 Analysis on the evolutionary relationship of Arabidopsis genes containing START domain
2.2 拟南芥START 结构域蛋白家族的理化性质分析
利用ProtParam、ProtScale 对拟南芥START 结构域家族成员的理化性质进行分析。结果显示(表2),该家族成员不稳定系数为36.92 ~58.65,大多数成员不稳定系数在40 以上,表明结构不稳定。其中含START 结构域的多结构域亚家族等电点pI<7 的蛋白达到88%以上,多数为酸性氨基酸。而仅含START 结构域亚家族等电点pI >7 的蛋白达到88%以上,多数为碱性氨基酸。

表2 拟南芥START 结构域家族蛋白理化性质分析Table 2 Analysis of physicochemical properties of Arabidopsis START domain family proteins
跨膜片段预测显示,在拟南芥START 结构域家族中,只有仅含START 结构域亚家族存在跨膜片段,其中At3g13062、At1g55960、At3g23080 和At1g64720 蛋白氨基末端包含单个跨膜片段,序列相似性较高的At4g14500 和At5g54170 均含有2 个跨膜片段,
利用NCBI 的CD-search 工具预测基因的保守结构域的位置,发现START 结构域的大小在不同亚家族中出现明显变化,在HD-ZLZ-START 亚家族中START 结构域从羧基端开始定位至大约470 个氨基酸的位置,HD-ZIP-START 亚家族中START 结构域从羧基端开始定位至大约370个氨基酸的位置,PH-START-DUF1336 亚家族中START 结构域亚家族中START 结构域位于2 个结构域之间,而仅含START 结构域亚家族START 结构域从羧基端开始定位至大约300 个氨基酸的位置,位置的差异可能导致功能上的改变(表3)。
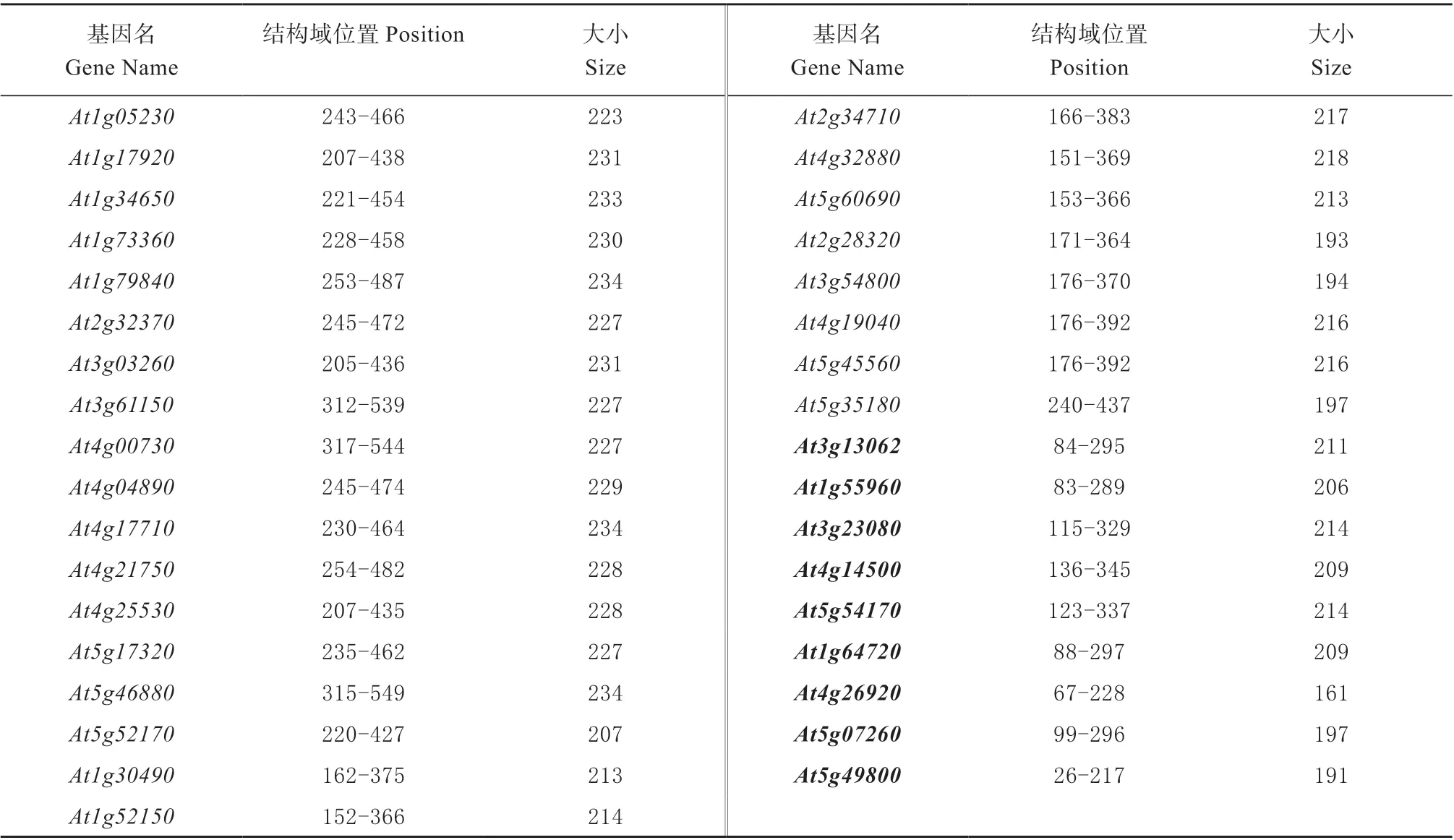
表3 拟南芥START 结构域家族START 结构域分析Table 3 Analysis of START domain of Arabidopsis START domain family

续表:
2.3 拟南芥START 结构域蛋白家族的基因结构分析
内含子-外显子结构的多样性也暗示基因在进化过程中复杂功能,其中外显子作为基因中的保守部分,对判断生物演化提供依据。结果如图2,编码START 结构域基因具有相对复杂的结构,所有基因均被内含子打断。编码仅含START 结构域亚家族的基因外显子数目均为6 个以下,其中At5g49800最少,只含有4 个外显子,而编码含START 结构域的多结构域亚家族的基因其外显子数目明显增多,编码含PH-START-DUF1336 结构域蛋白的基因外显子数目均为15 个以上,结构更为复杂。上述结果表明,随着拟南芥START 结构域家族的进化,外显子/内含子的数目也在变化,相同亚家族间比较保守,可能具有类似的生物学功能。
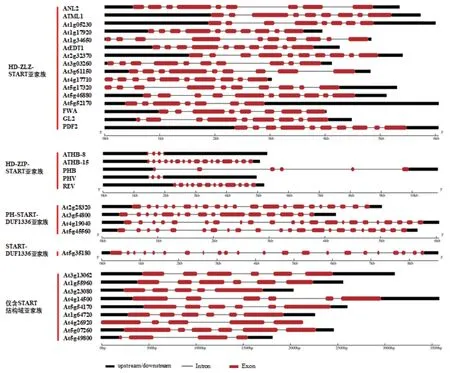
图2 拟南芥含START 结构域基因结构分析Fig.2 Analysis of gene structure of Arabidopsis gene containing START domain
2.4 拟南芥START 结构域蛋白家族的启动子作用元件分析
通过在线网站phytozome 获取编码START 结构域蛋白家族基因上游2 000 bp 作为启动子序列,鉴定出的启动子作用元件与植物生长发育,激素和胁迫响应具有一定关联。其中与植物生长发育相关的有分生组织表达调控元件(CAT-box)、玉米醇溶蛋白代谢元件(O2-site)、胚乳特异性表达元件(Element involved in Endosperm Expression)等,与激素相关有脱落酸(abscisic acid,ABA)响应元件、茉莉酸甲酯(Methyl Jasmonate,MEJA)响应元件,生长素(TGA-element)响应元件等。同时还发现编码START 结构域蛋白家族的基因中还含有响应非生物胁迫的作用元件且在多个基因中被鉴定出,如:干旱胁迫响应元件(MBS)、低温响应元件(LTRmotif)等。此外,START 结构域不同亚家族成员启动子区作用元件类型有差异,如仅含START 结构域亚家族大部分成员含有分生组织表达调控元件、玉米醇溶蛋白代谢元件和低温响应元件,其它多结构域亚家族中启动子区相应元件较少,而赤霉素作用元件(P-box)和赤霉素响应元件(GARE-motif)在仅含START 结构域亚家族大部分成员中缺失,在其它多结构域亚家族中较多(图3)。

图3 拟南芥含START 结构域基因启动子作用元件分析Fig.3 Analysis of the role elements of Arabidopsis thaliana gene promoter containing START domain
2.5 仅含START 结构域亚家族在拟南芥不同组织表达分析
利用qRT-PCR 技术分析仅含START 结构域亚家族成员在拟南芥不同器官的表达量。结果如图4 所 示。其 中At1g55960、At5g54170、At4g26920和At5g07260 在不同组织中表达量存在明显差异,在种子中表达量较高,在其它组织中表达量较少,At3g13062、At3g23080、At4g14500 和At1g64720在莲座叶和茎生叶中表达量较高。

图4 拟南芥仅含START 结构域亚家族在不同部位的表达量Fig.4 Arabidopsis only contains the expression levels of the START domain subfamily in different parts
2.6 拟南芥仅含START 结构域亚家族突变体鉴定
取过表达与突变体植株的成熟莲座叶,进行qRT-PCR 表达量验证(图5)。qRT-PCR 结果表明,所选取的过表达拟南芥内编码仅含START 结构域基因表达量均高于野生型,突变体植株内编码仅含START 结构域基因的表达量均低于野生型。为了方便命名,我们将验证好的过表达植株按表达量由高到低命名为OE-1、OE-2、OE-3,后续表型观察选取过表达植株的一个株系并命名为At3g13062-OE、At1g55960-OE、At3g23080-OE、At4g14500-OE、At5g54170-OE、At1g64720- OE、At4g26920-OE 和At5g07260-OE;各自的T-DNA 插入突变体用At3g13062-T、At1g55960-T、At3g23080-T、At4g14500-T、At5g54170-T、At1g64720- T、At4g26920-T 和At5g07260-T 表示。

图5 仅含START 结构域亚家族过表达和突变体植株的验证Fig.5 Validation of overexpression of subfamily containing only START domain and mutant lines
2.7 拟南芥幼苗表型观察
将野生型、过表达和突变体植株种子春化后正常培养14 d 后对幼苗进行观察。如图6 所示,与野生型相比,过表达植株幼苗出现了极性的改变,但叶片大小未发生改变。At1g55960 过表达幼苗真叶叶柄短粗,At3g23080 过表达幼苗叶片发生卷曲,第一对真叶在近轴面出现远轴面表型,At5g54170 和At4g26920 过表达幼苗真叶出现非对称生长,同时期野生型有一对子叶和两对真叶,而At3g13062、At4g14500 和At1g64720 过表达幼苗第一对真叶只长出一片叶子,叶片发育明显受阻。突变体对称性也出现变化,但极性发生改变的程度不如过表达严重。上述结果表明,仅含START 结构域亚家族成员表达量的改变会影响拟南芥幼苗期的发育。

图6 幼苗时期表型观察Fig.6 Phenotype observation at the seedling stage
3 讨论与结论
START 结构域是一个保守的结构域,主要参与脂质运输、代谢和细胞信号转导。由于它具有和脂质配体的物质结合的特性,可以结合不同的配体。START 结构域在动物中负责将急性调节蛋白中的胆固醇运输到线粒体内膜,而在之后的研究中证明,人类的诸多疾病都与START 结构域蛋白密切相关[1-2]。
目前为止,START 结构域在多个物种中被鉴定出,其中水稻有29 个,拟南芥有35 个,人和小鼠中各有15 个,秀丽隐杆线虫和黑腹果蝇分别有7 个和4 个。在动物和植物中,大多数含START 结构域蛋白已经发生不同的进化。RhoGAP-START 结构域仅存在于动物中,植物中不存在。但在植物中出现了2 个动物中不存在的HD-START 结构域亚家族,这些植物特有的START 结构域蛋白在双子叶和单子叶植物中均被克隆到,进化关系上,它们起源于植物谱系的一个古老祖先。不同结构域的组合可能提高了植物在脂质或甾醇类信号的转导效率。
PHB 显性突变体Phb-1d 是第一个发现的叶片极性缺陷突变体[20],在成熟莲座叶中出现近轴化的针状叶和棒状叶。调控叶片近轴面化基因还有PHV,它们的突变体均在叶的边缘处出现近轴化的表型,叶片呈现棒状和荷叶状,这两者表型十分类似。同属该家族的还有REV,且拟南芥rev 突变体叶片增大并卷曲。本研究中仅含START 结构域亚家族在幼苗叶片发育时表现出和野生型明显的差异,子叶向下卷曲,过表达植株第2 片真叶无法生长,植株对称性发生下降。突变体植株中也出现这种情况,但并没有过表达植株明显。这说明START 结构域本身就具有调控近远轴极性建成的作用。
对仅含START 结构域亚家族成员突变体和过表达转基因拟南芥幼苗形态比较发现,各成员的过表达植株均表现为不同程度的非对称生长特性,结合过表达转基因拟南芥中目的基因的表达水平分析,At1g55960 和At5g07260 的过表达水平很高,分别达到野生型的16 倍和47 倍(图5),但这2个成员的过表达植株的表型并未表现为比其它成员的过表达植株(基因表达水平均是野生型得10 倍以下)更为严重的表型(图6)。这可能与各亚家族成员在组织水平的表达特异性相关,因为本研究观察的是幼苗形态,分析的是莲座叶的生长发育,而At1g55960 和At5g07260 在莲座叶表达水平很低(图4),而过表达植株表型严重的At3g13062、At4g14500 和At1g64720 均在莲座叶中表达量较高(图4、图6),暗示着亚家族成员在幼苗期的生物学功能与其表达特性密切相关。
研究还发现仅含START 结构域亚家族成员的T-DNA 插入突变体的表型不如过表达植株明显,但也表现出第2对真叶非对称生长和发育受阻的表型,这说明START 结构域在植物中的功能可能与在动物中相似,表达量过高和过低均会影响植物的生长发育,之所以T-DNA 插入突变体表型不如过表达植株明显,可能是该亚家族成员的功能冗余原因所致。
综上所述,本研究运用生物信息学方法和qRTPCR 技术,对拟南芥START 结构域家族成员进行了系统发育、理化性质、基因结构、启动子作用元件和组织表达特异性分析,并结合对仅含START 结构域亚家族功能获得和功能缺失转基因拟南芥表型的观察,发现其参与调控植物生长发育的进程,为下一步探究其功能和作用机制提供理论依据。

