单核细胞增生李斯特菌重组酶聚合酶恒温扩增快速检测方法的建立
周红蕾,程淑琴,胡永青,刘 静*
(1. 江苏农牧科技职业学院 宠物科技学院,江苏 泰州 225300;2. 吉林大学 动物医学学院,吉林 长春 130062;3. 河北省农业对外贸易促进中心,河北 石家庄 050011)
单核细胞增生李斯特菌(Listeria monocytogenes,L.monocytogenes),简称单增李斯特菌,属乳酸杆菌科,革兰氏阳性小杆菌,是一种重要的人畜共患病病原菌,临床上引起李氏特菌病,表现为:败血症、脑膜炎、热性肠胃炎、流产、肺炎、淋巴结肿大和单核细胞增多等,通过直接或间接接触污染物而传播,致死率高达44%[1]。单增李斯特菌广泛存在于自然界中,是胞内寄生菌,感染动物机体后主要依靠宿主的细胞免疫对其清除,该病主要见于幼畜和免疫力低下的动物群体。由于单增李斯特菌培养营养要求不高,在4 ℃~45 ℃中均能生长,是冷藏食品威胁人畜健康的主要病原菌之一,肉制品或乳制品等食品中存在的单增李斯特菌对人畜的健康有着重大的危害[2]。因此,建立一种快速、灵敏、特异性的单增李斯特菌检测方法在人畜公共卫生安全中尤为重要。
单增李斯特菌的传统检测方法为生化培养,虽然该方法检测的精准性高,但由于样品中细菌含量通常较低,需要富集培养来提高菌体浓度的前处理步骤,这一过程通常需要12 h~36 h,疑似样品到最终确定耗时久,因此无法广泛推广应用。而分子生物学方法因其检测速度快、灵敏度高而被广泛研究并应用。重组酶聚合酶等温扩增(Recombinase polymerase amplification,RPA)技术是一种可以替代PCR的核酸检测技术。该技术无需昂贵的PCR 仪,反应速度快,灵敏度高,扩增产物可以与琼脂糖凝胶电泳终点法、荧光定量实时检测法、测流层析试纸条等方法结合起来进行检测,广泛应用于现场快速检测[3-6]。本研究基于单增李斯特菌基因组序列设计特异性识别引物,利用RPA技术建立了单增李斯特菌快速、特异、灵敏的检测方法,适用于基层实验室和现场快速检测,是人畜公共卫生安全监测的重要手段。
1 材料与方法
1.1 主要实验材料单增李斯特菌(ATCC 19115)、伊氏李斯特菌(Listeria ivanovii,ATCC 19119)、无害李斯特菌(Listeria innocua,ATCC 33090)、斯氏李斯特菌(Listeria seeligeri,ATCC 35967)、格氏李斯特菌(Listeria grayi,ATCC 25401)、肠致病性大肠埃希菌O157(Escherichia coli O157,ATCC 43888)、沙门氏菌(Salmonella enteritidis,ATCC 14028)、蜡样芽孢杆菌(Bacillus cereus,ATCC 14579)和金黄色葡萄球菌(Staphylococcus aureus,ATCC 6538)均购自北京普天同创生物科技有限公司;TwistAmp®Basic kit购自英国TwistDX公司;HiPure Bacterial DNA Kit、HiPureMicro-Biome DNA Kit 和HiPure Gel Pure Micro Kit 购自广州美基生物科技有限公司;Marker III 购自天根生化科技(北京)有限公司;TB Green®Premix Ex TaqTM(TliRNaseH Plus),Bulk 购自宝生物工程(大连)有限公司。
1.2 引物设计根据GenBank 已公布的单增李斯特菌(CP025567.1)基因组DNA 序列,按照RPA 引物设计原则设计引物,序列如下:LM-F:5'-AAATAGA ATAGGAACCCTGCTACTAAAATC-3'/LM-R:5'-GCA AGTAACATAGAAACACCTCTCCTTCAA-3'。引物由通用生物(安徽)有限公司合成。
1.3 RPA 反应体系和程序的建立利用HiPure Bacterial DNA Kit 提取单增李斯特菌的基因组DNA,以其为模板,利用TwistAmp®Basic kit 反应体系如下:LM-F(10 μmol/L)2.1 μL、LM-R(10 μmol/L)2.1 μL、2×Reaction Buffer 25 μL、10×Basic E-mix 5 μL、dNTP(1.8 mmol/L)2.25 μL、细菌基因组1 μL、ddH2O 7.55 μL、20×core Reaction mix 2.5 μL、MgOAc(280 mmol/L)2.5 μL 共50 μL 反应体积,同时设置阴性对照,充分混匀后将反应体系在37 ℃条件下孵育30 min。按照HiPure Gel Pure Micro Kit 产品说明书对扩增产物进行纯化,纯化后的扩增产物经1.5%琼脂糖凝胶电泳检测。
1.4 RPA 最适反应温度和时间的优化配置RPA反应体系,同时设置阴性对照,在37 ℃条件下,采用方阵法进行最适反应时间筛选(5 min、10 min、15 min、20 min、25 min、30 min)和最适反应温度筛选(25 ℃、30 ℃、37 ℃、42 ℃、45 ℃)。
1.5 特异性试验利用HiPure Bacterial DNA Kit 提取伊氏李斯特菌、无害李斯特菌、斯氏李斯特菌、格氏李斯特菌、肠致病性大肠埃希菌O157、沙门氏菌、蜡样芽孢杆菌和金黄色葡萄球菌基因组DNA,利用建立的RPA 方法对单增李斯特菌及其它常见病原微生物基因组DNA 进行检测,以评价该反应体系的特异性。
1.6 敏感性试验将提取的单增李斯特菌基因组DNA(3×106拷贝/μL)10 倍倍比稀释,以3×106拷贝/μL~3×100拷贝/μL 基因组DNA 为模板,同时设置阴性对照,按照优化后的反应条件分别对其扩增。
对单增李斯特菌菌液(106cfu/mL)进行10 倍倍比稀释,制成106cfu/mL~100cfu/mL 的样品,各取1 mL 提取的基因组DNA 为模板按照优化后的反应条件分别对其扩增。扩增产物经1.5%琼脂糖凝胶电泳检测。确定该方法的敏感性。
1.7 人工污染样品的检测鲜牛奶、牛肉、鱼肉均从当地超市购买,按照国标(GB 4789.30-2016)的方法检测,证实不含单增李斯特菌,可用于后续人工污染样本的建立。量取50 mL 鲜牛奶分成50 份,即1 mL/份,随机选取10份掺入单增李斯特菌至终浓度为106cfu/mL。称取牛肉、鱼肉样品各10 g,加入90 mL生理盐水中匀浆,取上清分成50 份,即1 mL/份,随机选取10 份掺入单增李斯特菌至终浓度为106cfu/mL,利用HiPureMicroBiome DNA Kit 提取上述样品的基因组DNA。应用RPA 方法和荧光定量PCR(qPCR)方法[7]对污染样本进行快速检测,同时利用国标(GB 4789.30-2016)检测方法作为对照,以验证该方法的适用性。
2 结 果
2.1 单增李斯特菌RPA 扩增结果利用设计的特异性引物LM-F/LM-R 对单增李斯特菌DNA 进行RPA扩增,对扩增产物进行柱纯化。扩增结果显示获得一条约320 bp 的目的条带,与预期相符(图1)。表明特异性引物LM-F/LM-R可用于检测单增李斯特菌。

图1 单增李斯特菌目的基因的RPA 扩增结果Fig.1 Amplification of L.monocytogenes target gene by RPA
2.2 RPA 反应条件优化结果使RPA 反应体系在37 ℃条件下,采用方阵法筛选最适反应时间和最适反应温度,结果显示反应时间在15 min~30 min 之间均可获得约320 bp 大小的目的片段,而5 min 的反应时间下无扩增,10 min 的反应时间下可获得微弱的目的条带(图2)。因此,最终确定15 min 为最适反应时间。

图2 单增李斯特菌RPA 检测体系最适反应时间筛选Fig.2 Optimal amplification time of the RPA system targeting L.monocytogenes
反应温度在25 ℃~45 ℃之间均可获得约320 bp大小的目的片段,当反应温度在42 ℃时扩增产量最高,37 ℃时产物量略减少,而25 ℃、30 ℃和45 ℃时扩增产物较低(图3)。因此,最终确定42 ℃为最适反应温度。
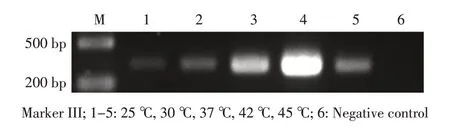
图3 单增李斯特菌RPA 检测体系最适反应温度筛选Fig.3 Optimal amplification temperature of the RPA system targeting L.monocytogenes
2.3 特异性试验结果对单增李斯特菌及伊氏李斯特菌、无害李斯特菌、斯氏李斯特菌、格氏李斯特菌、肠致病性大肠埃希菌O157、沙门氏菌、蜡样芽孢杆菌和金黄色葡萄球菌基因组DNA 进行RPA 检测,结果显示,该方法仅对单增李斯特菌扩增获得约320 bp 大小的目的片段,而对其他细菌基因组DNA 均无特异性扩增(图4)。可见该方法能够特异性的扩增致病性的单增李斯特菌,但对其它常见的食源性微生物和非致病性的李斯特菌无扩增。表明该方法特异性较强。

图4 特异性试验结果Fig.4 Specificity test of the RPA system targeting L.monocytogenes
2.4 敏感性试验结果分别以10 倍倍比稀释的基因组DNA 3×106拷贝/μL~3×100拷贝/μL 和106cfu/mL~100cfu/mL 菌液1 mL 提取的基因组DNA 为模板,进行敏感性试验。结果显示该RPA 检测系统的最低检出限分别为3×102拷贝/μL(图5A)和103cfu/mL(图5B),表明单增李斯特菌RPA 方法敏感性较高。

图5 敏感性试验结果Fig.5 Sensitivity test of the RPA system targeting to L.monocytogenes
2.5 人工污染样品的检测结果应用本研究建立的单增李斯特菌RPA 方法和已报道的qPCR 方法分别对人工污染的50 份鲜牛奶、50 份牛肉匀浆和50 份鱼肉匀浆样品进行检测,结果显示,各污染样品检出率均为20%,各样品均有10 份阳性样品,RPA 方法与qPCR 方法和国标法检测结果一致,表明RPA方法可以用于临床样品的单增李斯特菌污染测定。
3 讨 论
单增李斯特菌被世界卫生组织(WHO)列入20世纪90 年代食品污染的重要致病菌,广泛存在于各类肉制品、水产品、奶制品等。单增李斯特菌的传统的检测方法包括前增菌、分离培养、生化实验等复杂的检测流程,不仅需要较长的鉴定时间,而且检测通量低,无法满足细菌性疾病暴发和食物中毒等临床快速检验。因此,分子生物学诊断技术在很多应用性检测中逐渐替代了传统的生化培养诊断。目前,基于分子生物学技术检测单增李斯特菌的研究有很多。杨国兴等人基于单增李斯特菌内化素基因(inlA)设计特异性引物,建立了多重PCR 检测方法同时检测多种病原微生物[8]。该方法可以同时检测4 种食源性病原微生物,检测时间为2 h,灵敏度为103cfu/mL。然而该实验依赖于温度梯度PCR 仪,限制了在实验设备匮乏的应用场景。O'Grady 等以单增李斯特菌ssr A 基因设计引物,建立了qPCR 检测方法,并测定了天然和人工染菌的食物中的单增李斯特菌[9]。虽然qPCR 实验技术将检测控制在1.5 h 以内,但该实验不仅需昂贵的实时荧光定量PCR 仪器,而且对样本纯度要求非常高,模板中的杂质会抑制DNA 聚合酶的活性,影响扩增荧光信号的强度[10]。王瑞娜等通过环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)扩增单增李斯特菌的inlA 基因,并通过横向流动试纸条来检测扩增的核酸产物[11]。虽然LAMP 技术对实验设备要求低,仅需要一台可设定为65 ℃恒温水浴锅即可完成实验,适合于基层检测,但该方法也存在了一定的弊端。一方面,引物设计时需要选定6 个独立的区域设计2对特殊的引物,增加了引物设计的难度。另一方面,反应结果的判定根据肉眼观察扩增副产物焦磷酸镁的沉淀浊度,易出现误判的情况[12]。
近年由于RPA 技术的兴起,被广泛应用于多种病原生物的检测。姜一曈等基于犬细小病毒VP2 基因的保守序列设计特异性引物,建立了犬细小病毒的RPA 快速检测方法[13]。而单增李斯特菌的RPA 检测应用研究较少。RPA 技术成功的关键在于引物设计,其设计基本原则与普通PCR 相似,但也有不同之处。根据TwistAmp®Basic kit 的说明书中关于引物设计的指导原则:引物长度介于30 bp~36 bp,靶标区域GC含量介于20%~70%,Tm值介于50 ℃~100 ℃,为降低引物二聚体或发卡结构生成,可适当引入错配碱基,同时扩增产物长度不超过500 bp。本研究在单增李斯特菌基因组上筛选得到的最佳引物,正反向引物长度均为30 bp,扩增产物大小约320 bp,软件分析发夹结构和二聚体自由能均较低,保证了RPA 检测方法实施的可行性。虽然病原性检测诊断时选取毒力基因是较为常见的研究手段,如:单增李斯特菌的inlA 基因[8,11],可以特异性检测到致病性病原菌,但另一方面也局限了引物设计。本研究在单增李斯特菌全基因组上筛选引物对,能够特异性的扩增致病性的单增李斯特菌,但对其它常见的食源性微生物和非致病性的李斯特菌无扩增。
与普通PCR 技术和qPCR 技术相比,RPA 最显著的特点是不依赖于高精密的温控PCR 仪,无需高温模板变性和引物退火,仅需要在25 ℃~45 ℃低温条件下利用重组酶、链置换酶完成核酸的扩增[7]。因此,减少了升降温的过程,缩短了反应时间。本研究建立的单增李斯特菌的RPA 检测方法在15 min即可获得准确的检测结果,远快于其它分子生物学实验技术。在RPA基础扩增体系内加入不同的探针、修饰的引物,可以实现多样化检测。李林等根据非洲猪瘟病毒(ASFV)基因组序列设计特异性引物和exo 探针,建立了检测ASFV 的实时荧光RPA 方法[14]。樊晓旭等根据塞尼卡谷病毒(SVV)基因组序列设计特异性的生物素标记的引物和FAM 荧光基团修饰的探针,建立了检测SVV 的RPA-侧流层析试纸条可视化检测方法[15]。为模拟实际检测场景,本研究选取了无单增李斯特菌污染的牛奶、牛肉、鱼肉样品,建立了人工污染实验样本模型。将RPA 检测结果与qPCR 方法检测结果进行比较,获得了一致性的检测结果,证实了建立的单增李斯特菌RPA 方法的准确性。
本研究建立一种用于检测单增李斯特菌的RPA方法,反应速度快、特异性强、灵敏度高、检测流程简单,能够进行实时实地的现场检测,满足单增李斯特菌引起的疾病暴发和食物中毒等多种应用场景诊断。

