水貂阿留申病在不同感染率貂场的联合检疫方法
韦 韬,吴艳虹,马瑞芳,丛 丽,岳志刚,赵永强,肖家美,邵西群
(中国农业科学院特产研究所吉林省特种经济动物分子生物学重点实验室,吉林 长春 130112)
水貂阿留申病(Aleutian disease,AD)是由AD 病毒(AMDV)感染引起的慢性消耗性疾病,是水貂养殖业的主要疫病[1]。在我国水貂养殖场阿留申病感染率普遍偏高,危害严重[2]。目前无有效疫苗来防控AD[3-4],主要通过检疫来净化感染貂群。碘凝集反应(Iodine agglutination test,IAT)最先用于AD 的检测,虽然是一种非特异性的检测方法,但可通过碘试剂检测的净化血清γ-球蛋白血症,间接判断出水貂是否患阿留申病[5-6]。Cho 和Greenfield 采用对流免疫电泳(Counter immuno-electrophoresis,CIEP)即利用阿留申病毒抗原检测水貂血清中的抗体,间接检测病毒感染,成功用于阿留申病毒感染貂群的净化[7],CIEP 作为检疫阿留申病毒抗体的标准方法目前被广泛使用[8]。然而单纯抗体检疫对感染初期未产生抗体的水貂容易漏检。PCR 可直接通过检测外周血的病毒核酸来判断病毒感染情况以及病毒基因型,常被用于AMDV 的核酸检测[9-11]。荧光定量PCR(qPCR)方法可定量检测水貂感染的病毒量,弥补了通过抗体检测病毒感染的局限[12-14]。AMDV 及其抗体在水貂体内呈动态变化,AD 的单一检疫方法只适用于病毒感染的某个阶段。研究显示水貂体内阿留申抗体存在阳转阴的现象,貂群中还存在AMDV 抗性貂[9,15-16]。为此,本研究对两个不同感染率貂场开展联合检疫判断水貂AD 的感染状态,旨在为貂场水貂留种和AD 检疫提出新思路。
1 材料与方法
1.1 样品的采集与处理2017 年12 月~2018 年1月,对辽宁省辽中县A、B 两个养殖场貂群进行检疫。A 场已连续开展3 年以上CIEP 检疫淘汰的防控措施,2017 年12 月该场突然暴发AD,对A 场2 442只水貂采集血样,其中公貂110 只,母貂2 332 只。B 场为AD 未检疫貂场,经过初检为高感染率貂场,共对B 场1 851 只水貂采集血样,其中公貂262 只,母貂1 589 只。两场留种公貂与母貂的比例为1∶3~1∶5。留种公貂主要为当年貂,母貂为已产仔貂和当年母貂,其中已产仔貂>60%。
采血操作:水貂逐一编号,每只剪取后肢一个趾尖采血约0.5 mL,自然沉降析出血清后,取上层血清100 μL 用于IAT、CIEP 检测。
1.2 主要试剂Ex Taq DNA 聚合酶、MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0 购自宝生物(大连)有限公司;TransStart Tip Green qPCR superMix 试剂盒购自全式金(北京)生物技术有限公司;AMDV-G 株及其CIEP 抗原、AMDV 标准抗原和阴、阳性血清均由中国农业科学院特产研究所提供;分析纯KI2和I2购自Sigma 公司。
1.3 引物的设计与合成参考文献[10,17]合成PCR引物AV7-F:5'-ccaacaagtaatgacaccttggt-3'/AV7-R:5'-cctgctggtattatccattcagga-3',引物扩增的预期长度为786 bp;qPCR 引物YGF:5'-ctgtaacagaaaccaaccaagg ta-3'/YGR:5'-gttggtttggttgctctcca-3',引物扩增的预期长度为166 bp,均由Thermo Fisher(北京)DNA 合成部合成。
1.4 AD 的CIEP、IAT 检测参照《水貂阿留申病对流免疫电泳操作规程SN/T 1314-2003》[8],对所有水貂血清样品进行CIEP 检测。在阴、阳性对照成立时,按规程判定结果。每个样品检测2 次,若第1次与第2 次不一致,则补测1 次。
参考文献[9]配置试剂对所有水貂血清样品进行IAT 检测。取10 μL 水貂血清与等量配置的碘试剂混匀,1~2 min 出现沉淀则判定为IAT 阳性。
1.5 AD 的PCR 检测随机选取两场各200 份血清样品,提取血清样品中的病毒DNA,利用AV7-F/AV7-R 引物对样品DNA 进行PCR 检测。设置纯水为阴性对照,AMDV G 株DNA 为阳性对照。PCR 产物经琼脂糖凝胶电泳检测、纯化回收后由长春库美公司测序。
1.6 AD 感染状态判定根据IAT 结果判断水貂是否为高γ-球蛋白血症(指示慢性感染病症),根据CIEP 结果判断水貂是否有AMDV 抗体(指示其是否曾感染AMDV)以及PCR 结果判定水貂是否为AMDV阳性,3 种检测结果可将貂群分为6 个类型,即初步定性健康貂为IAT-CIEP-PCR-、AMDV 抗性貂为IAT-CIEP+PCR-、感染AMDV 初期貂为IAT-CIEPPCR+、AMDV 耐受貂为IAT-CIEP+PCR+、AMDV 感染发病貂为IAT+CIEP+PCR+以及其它慢性病貂。
1.7 AD 的qPCR 检测每场随机选取10 份PCR 检测为阴性和50 份PCR 检测为阳性的水貂血清样品经本实验室建立的SYBR Green I qPCR 方法检测病毒载量[17]。qPCR 反 应 条 件: 95 ℃3 min;95 ℃15 s、55 ℃10 s、72 ℃10 s,共40 个循环。设置纯水为阴性对照,AMDV-G 株为阳性对照,每个样品设置3个重复反应。
1.8 数据分析根据3 种联合检疫方法对这两个貂场貂群存在不同感染状态分类、并计算不同感染状态在貂群中的比例。利用GrapahPad Prism 5.3 统计软件分析两个貂场主要感染状态的差异,用卡方检验或Student’s T 检验进行数据统计分析,p<0.05 认为有统计学意义。
2 结 果
2.1 AD 的CIEP、IAT 检测结果将貂群AD 感染状态分为:IAT-CIEP-、IAT-CIEP+、IAT+CIEP-和IAT+CIEP+。两个养殖场AD 的CIEP、IAT 检测结果显示,低感染率A 貂场主要为IAT-CIEP-群体,占貂群72%(1764/2442),其次为IAT+CIEP+群体,占貂群16%(399/2442);高感染率B 貂场主要为IAT+CIEP+群体,占貂群58%(1088/1851),其次为IAT-CIEP+群体,占貂群41%(750/1851)。可见不同AMDV 感染率的貂场,4 个群体分布不同(表1、表2)。A 与B属于不同感染率貂场,水貂感染AMDV 后呈现出4种不同的感染状态。利用GrapahPad Prism 5.3 软件的卡方检验分析A 场IAT-CIEP+群体(119 只)和B 场IAT-CIEP+群体(750 只)的分布差异,结果显示x2值为826.44,p<0.001(x2临界值10.83,p=0.001),B 场与A 场IAT-CIEP+貂比例差异极显著。卡方检验结果表明在高感染率B 貂场中更易出现IAT-CIEP+类型的感染水貂。利用Student’s T 检验分析A 场与B 场公貂与母貂感染率(CIEP+)差异。经计算结果显示,A 场t=5.666,自由度df=4,p 值为0.0048 小于0.01,表明A 场母貂感染率显著高于公貂,而B 场t=0.8944,自由度df=4,p 值为0.4216 大于0.05,表明该场公貂与母貂感染率差异不显著。
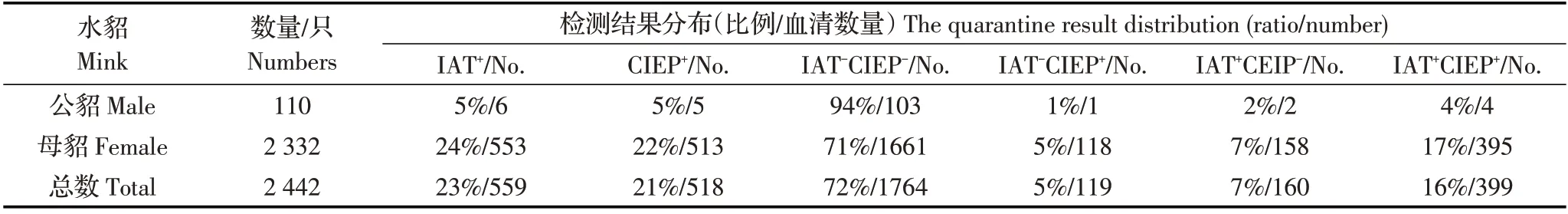
表1 A 貂场IAT 和CIEP 联合检测结果Table 1 The combined detection result by IAT and CIEP in A farm
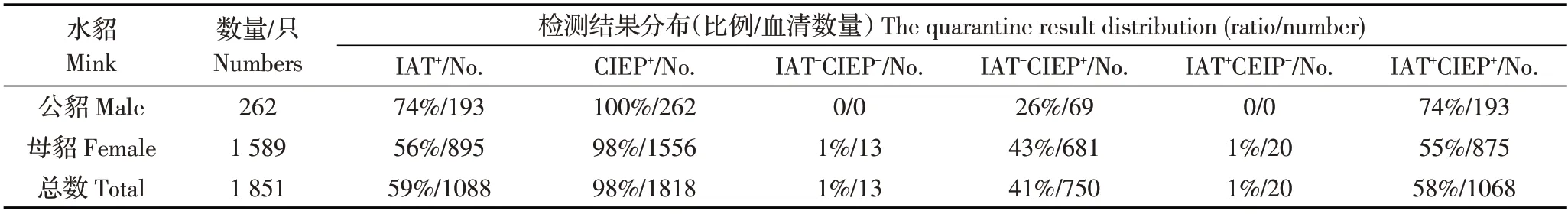
表2 B 貂场IAT 和CIEP 联合检测结果Table 2 The combined detection result by IAT and CIEP in B farm
2.2 AD 的PCR 检测结果随机选取A、B 两个貂场各200 份血清样品进行PCR检测。综合2.1及本结果分析显示,A 貂场主要为健康貂群(IAT-CIEP-PCR-:44%,88/200),其次为AMDV 感染病貂(IAT+CIEP+PCR+:18%,36/200)以及其它病貂群(30%,60/200),貂群中存在AMDV 感染初期貂(IAT-CIEP-PCR+:8%,16/200);B貂场主要为AMDV感染病貂(45.5%,91/200),存在一定比例的AMDV 耐受貂(IAT-CIEP+PCR+:35%,70/200)以及AMDV 抗性貂(IAT-CIEP+PCR-:9.5 %,19/200),未发现AMDV 感染初期貂(图1)。结果表明,A 貂场AMDV 耐受貂和抗性貂比例低,貂群中存在感染初期貂,貂场处于AMDV感染初期;B 貂场水貂与AMDV 长期共存,貂群整体抗病力较A 场强,AMDV 耐受貂和抗性貂比例较高,其它患病水貂数量也较A 场少。
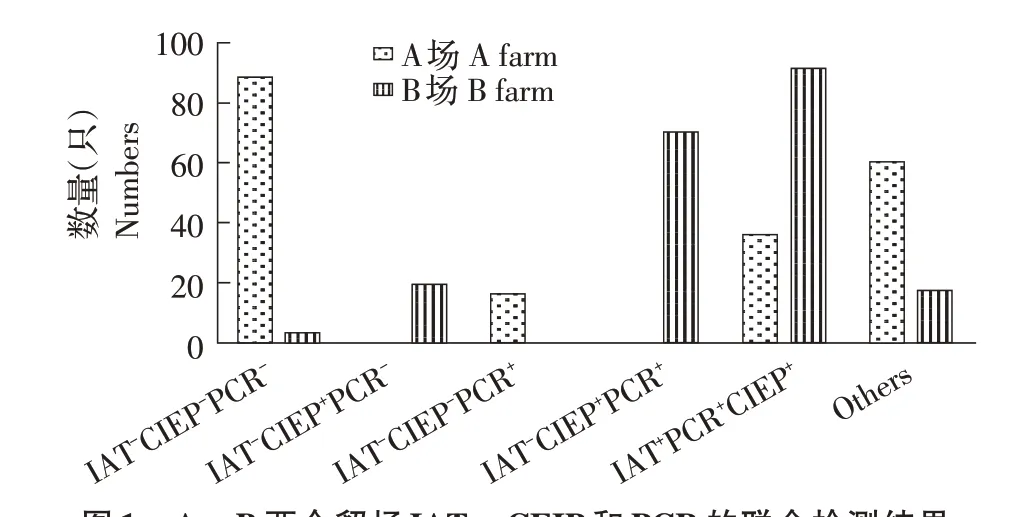
图1 A、B 两个貂场IAT、CEIP 和PCR 的联合检测结果Fig.1 The combined detection results of A and B farms with IAT,CIEP,and PCR
2.3 AD 的qPCR 检测结果对A、B 两个场分别随机选取10 份PCR 阴性样品和50 份PCR 阳性样品,利用本实验室建立的SYBR Green I qPCR[17]进行定量检测。结果显示,A 貂场qPCR 阳性样品52 份,阴性样品8 份,B 貂场qPCR 阳性样品58 份,阴性样品2 份。A、B 两场AMDV 载量最高分别为4.2×106拷贝/μL 和3.1×104拷贝/μL,最低分别为6.1×102拷贝/μL 和8.0×102拷 贝/μL,平 均 分 别 为1.8×105拷 贝/μL 和4.1×103拷贝/μL。A 场水貂体内病毒载量离散,但主要分布在1.1×104拷贝/μL~7.5×105拷贝/μL范围内,B场病毒载量集中分布在1.8×103拷贝/μL~9.5×103拷贝/μL范围内。用Student’s T 检验比较分析A 场(52 只)和B 场(58 只)qPCR 阳性水貂血清病毒载量,计算t=3.008,自由度df=108,p 值为0.0033 小于0.01,两场水貂血清病毒载量差异极显著,A 场较B 场阳性水貂体内病毒拷贝数显著增加(p<0.01)(图2)。表明A 场AMDV阳性水貂体内病毒复制能力强且复制活跃。

图2 A、B 两个貂场水貂感染AMDV 载量的检测结果Fig.2 The quantitative detection results of AMDV in A and B farms
3 讨 论
本研究通过IAT、CIEP 和PCR 联合检测水貂AD感染状态,并将貂群分为健康貂(IAT-CIEP-PCR-)、AMDV 感染初期貂(IAT-CIEP-PCR+)、AMDV 耐受貂(IAT-CIEP+PCR+)、AMDV 抗性貂(IAT-CIEP+PCR-)、AMDV 感染貂(IAT+CIEP+PCR+)以及其它慢性病貂。研究表明,水貂感染AMDV 后的发展状态与其自身免疫力和AMDV 毒力相关,主要发展为3 种类型[9]:病毒持续感染水貂,造成γ-球蛋白显著增高,表现出典型AD 症状的水貂,判定为阿留申病貂;水貂曾感染AMDV,抗体呈阳性,出现短暂病毒血症后病毒从外周血中消失,血清中γ-球蛋白含量正常,生产性能无明显影响,且在不利环境下仍不表现出AD 症状的水貂,判定为AMDV 抗性貂[5,16];水貂感染AMDV,抗体呈阳性,外周血中病毒载量低,血清中γ-球蛋白含量正常,对生产性能影响较低,无典型AD 症状的水貂,判定为AMDV 耐受貂[17]。这与本研究的联合检疫结果所判定水貂感染AMDV 状态相符合。
联合检疫结果显示,A、B 两场水貂AD 感染状态分布存在明显差异。A 属于低感染率貂场,主要集中为健康貂群(IAT-CIEP-),其它貂群分布较少。CIEP 与IAT 阳性率均约为20%,二者检测结果符合率约为88%(2 163/2442),这与之前的研究结果相一致[18]。该场当年公貂感染率显著低于母貂(p<0.01),这主要是由于母貂中经产母貂约占60%以上,比当年貂积累了更多AMDV 感染的数量。PCR 检测结果显示,IAT-CIEP-貂群中存在感染初期貂(IAT-CIEPPCR+),这对于貂场是潜在感染源。qPCR 结果表明,与B 场相比A 场貂的AMDV 载量更加离散,病毒载量在6.1×102拷贝/μL~4.2×106拷贝/μL,且病毒载量显著高于B 场(p<0.01)。这些数据表明A 场属于早期感染貂场,AMDV 在貂体内的复制处于活跃期。
B 属于AMDV 高感染率貂场,该场中病毒长期与水貂共存,水貂普遍AMDV 抗体阳性,CEIP 与IAT 检测结果符合率为58%(1081/1851),表明长期未检疫貂场不宜单独仅用CIEP 检疫。与A 场显著不同,B 场潜在抗性貂和耐受貂群体(IAT-CIEP+)约占41%(750/1851),显著高于A 场(p<0.001),显示长期高感染率貂场更易出现AMDV 抗性貂和耐受貂,这一点与Farid[15]和Kowalczyk 等[19]的结果相一致。并且当年公貂感染率与母貂感染率相近(p>0.05),展示出B 场AMDV 感染已达饱和状态。qPCR 结果显示B 貂场处于低病毒载量感染状态,AMDV 载量较为聚集,主要集中在103拷贝/μL 水平,表明B 场AMDV 在水貂体内的复制趋于稳定。A 和B 貂场AD 感染状态分布显示出貂群AMDV 感染从初期低感染经历累积后发展到高饱和感染的过程。
研究结果表明,不同AD 防控的貂场应采取不同淘汰留种策略。多数学者建议对于已开展CIEP 净化的貂场,应注意防范检疫采血过程中的病毒交叉感染,加强貂场污染环境的病毒消杀,以有效防控水貂AMDV 感染扩散[9,20]。但仅用CIEP 检疫存在一定缺陷,通过连续清除CIEP+水貂,会降低水貂抵抗力,使水貂对AMDV 更加敏感。Farid 等人指出在外来AMDV 侵入时,CIEP-貂群更易暴发感染,而耐受貂和抗性貂受到的影响则较低[15];并且单一CEIP抗体检疫会造成AMDV 感染初期貂的漏检,给貂群遗留危险感染源,造成日后AD 的暴发。因此,AMDV 长期感染但未检疫的貂场,建议采用联合检疫将IAT-CIEP+PCR-貂群与母貂产仔性能相结合,保留高产仔成活数(>4 只/窝)的母貂,可避免淘汰感染后的康复貂,降低扑杀损失。AMDV 抗性貂和耐受貂的筛选留种是目前国内外防控AD 的策略之一[9,15-16],该方式有利于提高貂群体对AMDV 感染的整体抵抗力,对高感染率貂场生产有着重要的经济价值。水貂体内AMDV 感染状态属于动态过程,需通过间隔多次联合检疫,才可检出状态稳定的AMDV 耐受貂(IAT-CIEP+PCR+)和AMDV 抗性貂(IATCIEP+PCR-),另外可结合母貂的产仔性能来筛选有留种价值的AMDV 抗性貂和耐受貂。
综上所述,联合检疫方法能够弥补单一抗体或病毒检疫方法的局限,通过联合检疫结果可准确判断AMDV 感染貂的感染状态,并可发现高感染貂场存在的较高比例的AMDV 耐受貂和抗性貂。建议不同感染率貂场应根据水貂AMDV 感染状态,采用适宜的检疫淘汰策略。本研究通过联合检疫方法为貂场检疫和淘汰AD 病貂提供了技术手段。

