联合生物电阻抗评估危重症患者预后
胡 臻 姚佳舒 陈海燕 周 蕾 孔 凌 龚德华
危重症病情严重程度及预后判断一直是研究热点之一。多种评分系统已用于临床,最常用的包括简化急性生理学评分 Ⅱ(SAPS Ⅱ)、序贯器官衰竭评估(SOFA)及急性生理学和慢性健康评估 Ⅱ(APACHE Ⅱ)评分。临床利用这些评分系统的方法包括:基线值,某一时间段内变化趋势(如变化幅度及方向)[1],而变化趋势则较少。事实上由于患者的病情变化及治疗干预,基线值的价值可能不如变化趋势。少量研究表明动态评估对于预后判断可能更有价值,如有研究发现入重症监护病房(ICU)后SOFA最高值较初始值对于预后的判断效果更佳[3];还有研究表明出院前APACHE Ⅱ 评分较入院评分对于外科重症患者出院后死亡预测价值更好[4]。目前仍不清楚,基于动态值分析,哪些评分系统与预后关系更密切。
此外,我们前期研究显示,这些评分系统在判断安全患者方面存在缺陷,而生物电阻抗分析(BIA)参数S值则有优势[5]。结合两者的变化趋势能否进一步区别预后不同的患者是值得探讨的问题。本研究对一组危重症患者危重评分及BIA参数动态值的分析,以探讨其变化趋势与预后的关系。
对象和方法
研究对象回顾性分析2018年6月至2019年6月期间入住东部战区总医院ICU患者,其中年龄大于18岁、入住ICU当日及第3天两次行BIA测量者入选。排除标准:烧伤、妊娠、起搏器置入或植入式除颤仪置入患者。收集患者临床资料及APACHE Ⅱ、SAPS Ⅱ、SOFA评分,主要终点为90d后生存率。
BIA测量患者入ICU当天及第3天,采用QuadScan 4000人体成分分析仪,按仪器说明进行测量,结果包括频率(f)5 kHZ、50 kHZ、100 kHZ、200 kHZ下的电阻抗值(Z),相位角(PA)、阻抗比(IR)等;以及根据患者f与Z的拟合指数函数Z=S×ln(f)+D所得到的回归系数S值[5]。
患者分组
基线病情轻重判定 根据危重评分及BIA参数分别绘制第1天及第3天各指标预测90d死亡的受试者工作曲线(ROC曲线),并得到截点值的平均值,定义截点值内(包含)为轻,超出为重。
第3天S值变化分组 按截点值区分(1)轻症无恶化组:两次均为轻症;(2)轻症恶化组:第1天轻症第3天重症;(3)重症好转组:第1天重症第3天轻症;(4)重症无好转组:两次均为重症。
第3天危重评分变化分组 统计第3天危重评分较基线变化幅度的绝对值,取其25百分位数作为幅度截点值,据此分为(1)轻症无恶化组:第1天轻症,第3天评分未上升或上升幅度不超过幅度截点值;(2)轻症恶化组:第1天轻症,第3天上升且幅度大于幅度截点值;(3)重症好转组:第1天重症,第3天降低且幅度大于幅度截点值;(4)重症无好转组:第1天重症,第3天未降低或降低幅度小于幅度截点值。
比较存活与死亡患者基线情况差异,绘制每个参数分组下患者的Kaplan-Meier生存曲线,比较各组生存率的差异。
统计学方法应用《SPSS 23.0》软件进行数据分析。正态分布的计量资料用均数±标准差表示。非正态分布的计量资料用中位数(四分位数间距)表示。多组之间及组内比较,符合正态分布且方差齐时使用单因素方差检验,方差不齐或不符合正态分布时,采用非参数检验,分别生成BIA参数及危重症评分的90天死亡ROC曲线并得到截断值。生存分析采用Kaplan-Meier生存曲线分析及COX回归分析。P<0.05为差异有统计学意义。
结 果
共入选113例患者,男性83例(73.5%),平均年龄45.9±15.7岁,90d死亡率为35.4%。入住ICU原因包括:急性胰腺炎(61.1%),胃肠系统疾病(15.9%),肺部感染(7.1%),外伤(5.3%)及其他(10.6%)。合并多脏器衰竭29例(25.7%),合并脓毒症者28例(24.8%),行连续肾脏替代治疗(CRRT)80例(70.8%)。住ICU中位天数27.0(15.0,45.0)d,APACHE Ⅱ、SOFA及APACHE Ⅱ评分中位值分别为18.0(13.0,24.0)、8.0(4.0,12.0)及28.0(20.0,41.5)。
90d存活及死亡患者基线情况比较90d存活及死亡患者的基线情况比较见表1,其中年龄及NT-proBNP,血红蛋白,血球压积,血小板计数和3项危重症评分差异显著,BIA参数中TBW、ECW、ECW/体重(%)、FFM%、PA、IR及S值差异显著(P<0.05)。
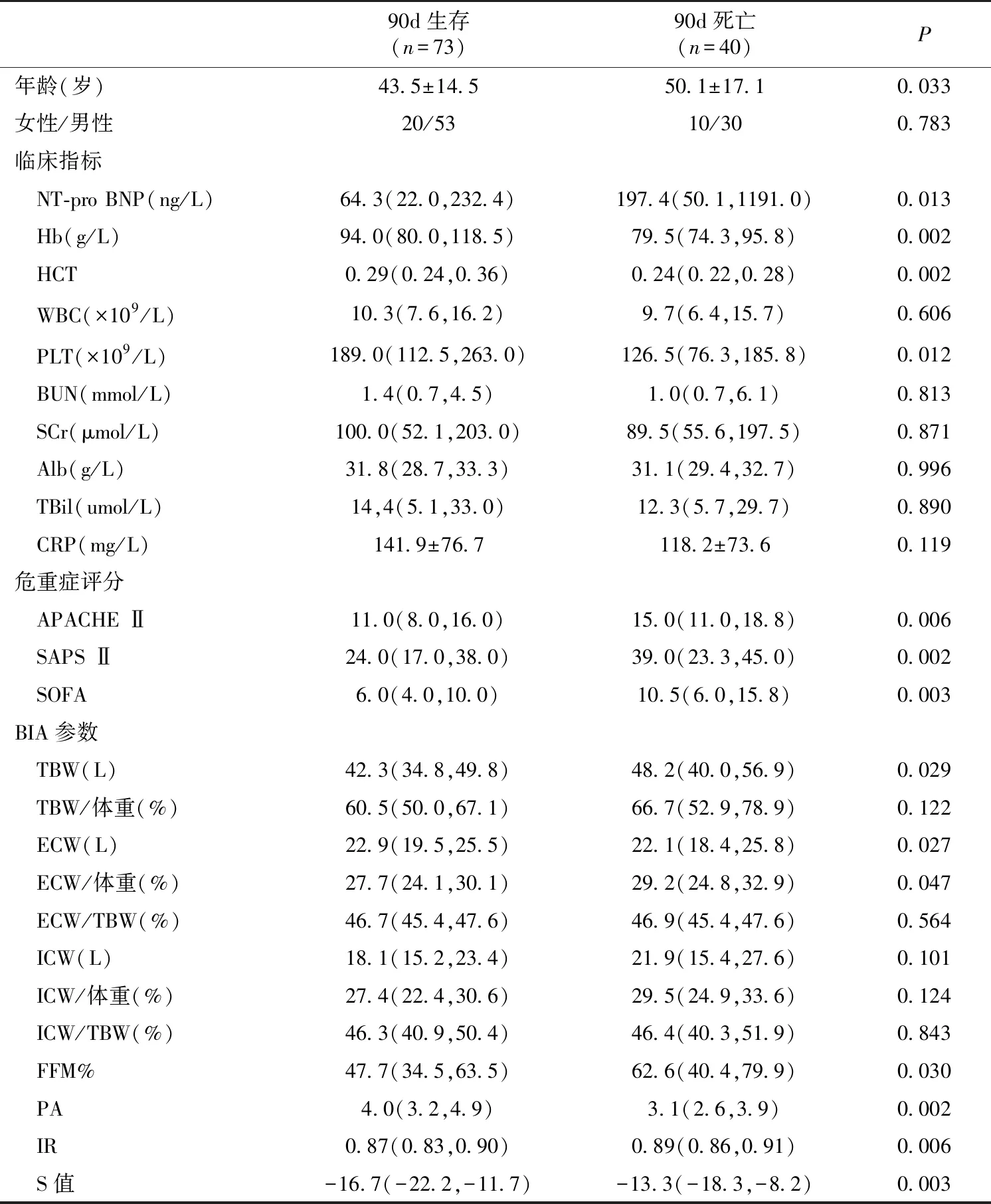
表1 90d存活及及死亡患者基线情况比较
危重症评分及S值变化与预后关系各指标判断病情轻重的截断值分别为:S值 -21.7; APACHE Ⅱ 10.0;SAPS Ⅱ 34.5;SOFA 8.0。据前文分组方法,分别绘制各指标分组患者90天Kaplan-Meier生存曲线(图1)。结果显示S值,SAPS Ⅱ及SOFA 3种指标分组患者累计生存率差异明显(P<0.05)。其他BIA参数如容量相关指标,PA及IR分组之间生存率无差异(结果未列出)。

图1 按各指标变化分组下患者生存曲线根据90d死亡ROC曲线得到各指标截断值以作病情轻重判断,根据第3天指标变化幅度作病情好转与恶化判断,将患者分为轻症无恶化组,轻症恶化组,重症好转组及重症无好转组。*:与第1组比较,P<0.05;#:与第2组比较,P<0.05;$:与第3组比较,P<0.05
危重评分中基于SAPS Ⅱ分组的各组间差别最明显,但其第1组死亡率仍高达17.3%,而基于S值分组第1、3组死亡率则分别为0及8.3%。
S值联合SAPSⅡ与患者预后的关系鉴于S值与SAPS Ⅱ各自特点,我们进一步联合S值及SAPS Ⅱ动态变化进行赋分(S值-SAPS Ⅱ联合分值):S值第1天及第3天皆为轻症,0分;S值第1天重症而第3天轻症,1分;S值第3天重症再根据SAPS Ⅱ赋分,即SAPS Ⅱ第1天轻症而第3天无恶化为2分;第1天重症而第3天好转为3分,第1天轻症而第3天恶化为4分,第1天重症而第3天无好转为5分(图2)。

图2 S值-SAPS Ⅱ联合评分流程SAPS Ⅱ:简化急性生理学评分Ⅱ
各分值患者对应生存曲线(图3)显示各组间累计生存率差异明显(P<0.05)。S值-SAPS Ⅱ联合评分对应死亡率见图4,分值与死亡率显著线性相关,预测公式为Y=0.174X(R20.96,P<0.001)。

图4 S值-SAPSⅡ联合评分与患者死亡率SAPS Ⅱ:简化急性生理学评分Ⅱ;S值第1天及第3天两次皆为轻,0分;S值第1天重第3天轻,1分;S值第3天重症再根据SAPS Ⅱ赋分,SAPS Ⅱ第1天轻第3天未恶化为2分;第1天重第3天好转为3分,第1天轻第3天恶化为4分,第1天重第3天未好转为5分
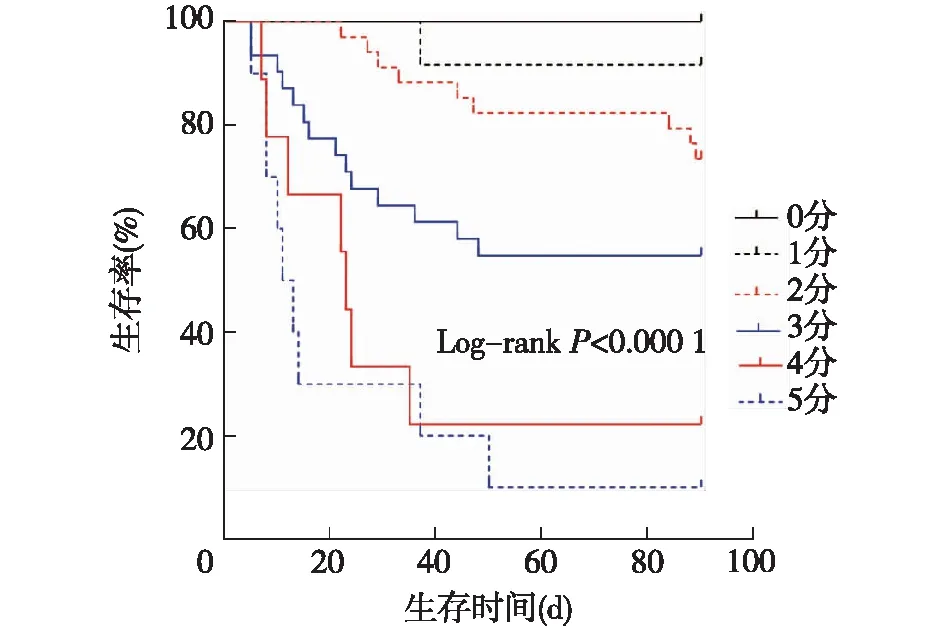
图3 S值-SAPSⅡ联合评分对应患者生存曲线SAPS Ⅱ:简化急性生理学评分Ⅱ;S值第1天及第3天皆为轻症,0分;S值第1天重第3天轻症,1分;S值第3天重症再根据SAPS Ⅱ赋分,即SAPS Ⅱ第1天轻第3天未恶化为2分;第1天重第3天好转为3分,第1天轻第3天恶化为4分,第1天重第3天未好转为5分
预测90d死亡ROC曲线显示,S-SAPS Ⅱ联合评分AUC值为0.790(95%CI 0.708~0.872),与第3天SAPS Ⅱ(0.794,95%CI 0.705~0.884)相当(P>0.05),而优于第1天SAPS Ⅱ评分(0.680,95%CI 0.577~0.784)(P<0.05)(图5)。
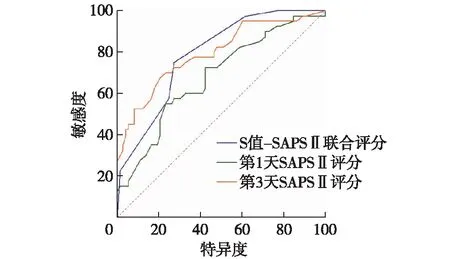
图5 S值-SAPS Ⅱ联合评分与SAPS Ⅱ预测90d死亡ROC曲线比较SAPS Ⅱ:简化急性生理学评分Ⅱ;S值-SAPS Ⅱ:S值与SAPS Ⅱ联合评分
COX单因素回归分析显示,S值-SAPS Ⅱ分、基线危重评分、PA、IR、血红蛋白等变量可能为患者90d死亡危险因素(P≤0.1),将之纳入多因素回归模型,结果显示只有S值-SAPS Ⅱ联合评分为患者90d死亡独立危险因素(HR=1.999,95%CI 1.529~2.613,P<0.001)(表2)。
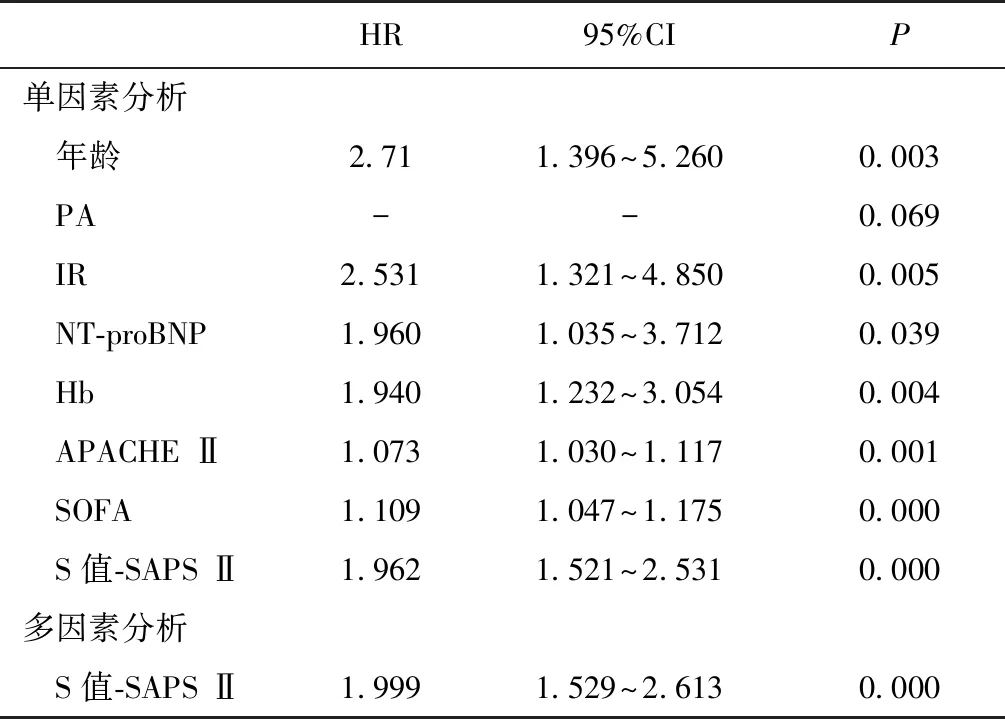
表2 患者死亡因素COX回归分析
讨 论
本文通过一组ICU患者的数据分析不同危重症评分与基线比较,3d时变化趋势对病情严重程度判断的意义。结果显示,三种评分系统中基于SAPS Ⅱ变化的分组死亡率差异最明显,显示出其在判断病情变化方面的价值。此外,我们前期工作所提出的BIA参数S值的变化,在与SAPS Ⅱ变化结合后所形成的新赋分方法,是90d死亡唯一的独立危险因素;且分值与死亡率呈很强线性相关,提示其很好地反映了病情严重程度的变化。
PA:相位角;IR:阻抗比;NT-proBNP:N端-脑利钠肽前体;Hb:血红蛋白;APACHE Ⅱ:急性生理与慢性健康状态Ⅱ;SOFA:序贯器官衰竭评分;S值:电阻抗值(Z)与电流频率(f)的回归系数;SAPS Ⅱ:简化急性生理学评分Ⅱ;S值-SAPS Ⅱ:S值与SAPS Ⅱ联合评分
曾有研究报道,采用第7天与第1天SOFA变化值作为脓毒症合并凝血功能紊乱患者28d生存的预测指标,显示了较好的精确性,而相关性并不理想(R20.315)[6]。2017年的一项关于经低温治疗的心跳骤停患者入ICU 48h内危重评分与预后关系的研究显示,APACHE Ⅱ、SAPS Ⅱ评分预测90d死亡AUC在48h最大,提示动态监测较单一时间点评估更重要[7]。其他一些研究也证明动态评估更优[3-4,6-9]。与上述研究不同,本研究并非某一时间点,而是相对基线的变化趋势。同时我们基于这样一种推理,即基线轻症第3天病情有恶化者可能预后会变差,基线重症第3天病情有好转者可能预后会变好,据此将患者分组后观察其预后的不同。结果证实变化趋势相似而基线不同患者预后是有差异的,说明忽视基线情况单纯观察变化趋势可能降低判断效能;但需要注意的是某一时间段内的变化趋势并不能完全代表患者转归。尽管如此,本研究结果仍然表明一定时间内的病情变化趋势具有观察价值。
同时本研究也显示,3种危重评分都存在轻症组死亡率并不低的问题,如SAPS Ⅱ或SOFA评分变化判断为最轻的患者死亡率分别达17.3%,17.0%。而有研究则认为SAPS Ⅱ过高估计了患者死亡率[10]。基于我们前期工作显示BIA参数S值能很好地判断死亡率为0的患者[5],因此我们将S值与3种评分中效能最好的SAPS Ⅱ结合,从而利用S值先区分出死亡率为0或极低的患者,再采用SAPS Ⅱ变化来区分其他患者,最终得到了与死亡率呈很好线性相关的S值-SAPS Ⅱ联合赋分方法。而与死亡率极好的线性相关说明其每一分的变化,对应的患者预后不同,说明其分值变化反映患者病情严重程度的变化。而我们前期的研究显示,SAPS Ⅱ分值在0~33的患者死亡率接近10%且无差别,说明SAPS Ⅱ无法区别这些患者的病情严重程度[5]。
本研究尚存在很大局限性。首先,单中心小样本回顾性研究,其真实价值还需更大样本量及多中心的前瞻性研究来验证。其次,如有足够多的样本,就可能进一步细化分组,得到的评分可更敏锐体现患者病情的变化。更重要的是,我们提出的S值-SAPS Ⅱ联合赋分法,还未在另外一组危重症患者中进行验证,这也是今后需进一步做的工作。
小结:S值、SAPS Ⅱ评分动态变化可更好区分预后不同患者,而两者动态变化的联合评分则进一步显示了与死亡率很强线性相关,提示联合评分判断病情严重程度上的价值。S值联合SAPS Ⅱ评分综合评估可能为危重症患者预后研究提供了新的方向,值得今后进一步大样本临床数据对其价值进行验证。

