维持性血液透析患者血清骨硬化蛋白与冠脉钙化及心血管事件的关系
赵俊丽 张 婷 闵丹燕 吴秀红 詹秋楠
心血管疾病(CVD)是维持性血液透析(MHD)患者的主要并发症及死亡原因。血管钙化是造成MHD患者CVD高发病率和高死亡率的重要因素, 钙化程度和组织解剖类型可预测CVD的死亡率[1-2]。骨硬化蛋白(sclerostin,SOST)是近年发现的一个可通过阻断 Wnt 经典通路参与骨-血管轴的新型调节因子,研究证实血清SOST与血管钙化、CVD死亡存在一定的关联[3-4]。但关于SOST的研究仍然存在很多不确定因素,本研究旨在探讨 MHD 患者血清SOST与血管钙化和CVD之间的关系,评价其对 MHD 患者CVD事件的预测价值。
对象和方法
研究对象纳入2017年6月至2019年12月在上海健康医学院附属周浦医院血液净化中心进行MHD,且透析龄≥3个月,年龄18~80岁的患者。排除标准:接受过冠状动脉搭桥术或者冠状动脉支架植入术、乙型和丙型肝炎及其他严重肝脏疾病、严重感染、恶性肿瘤、活动性自身免疫性疾病、活动性结核、腹膜透析/肾移植转为HD者、入选前1个月发生急性心血管事件。本研究通过周浦医院医学伦理委员会批准,研究对象均知情同意。
所有患者均使用贝朗血液透析机、聚砜膜透析器、碳酸氢盐透析液,透析3次/周、4h/次;患者定期进行透析充分性评估,单次透析尿素氮的清除率(spKt/v)>1.2。随访期间患者如果出现心血管事件或死亡被统一登记于本院透析管理系统。
临床资料收集及实验室指标测定收集患者年龄、性别、原发病、透析龄、体质量指数(BMI)、心血管病史、糖尿病史、高血压史、用药史、吸烟史(吸烟>10支/d并持续≥5年)等,并记录患者透析前血压、超滤量、24h 尿量等资料。实验室指标:血液常规、肝肾功能、血脂、电解质、碱性磷酸酶(ALP)、超敏C反应蛋白(hs-CRP)、钙、磷、全段甲状旁腺激素(iPTH)。所有入组者均在透析上机前当日清晨空腹采上肢静脉血,立即送本院检验科,统一由生化室专人技师当日完成,并计算尿素清除指数(urea clearance index,Kt/v)。
血清SOST检测采用夹心酶联免疫吸附法(ELISA)测定血清SOST水平,人血清 SOST ELISA试剂盒购自美国R&D公司,严格按照试剂盒说明步骤进行操作。以3次测定值均值为SOST水平。
冠状动脉钙化积分(CACs)的测定及分组64层螺旋CT(MDCT)检查由头向足侧扫描,从气管隆突至心脏膈面。冠状动脉成像采用增强扫描回顾性心电门控,根据患者的心率确定扫描方式。冠状动脉钙化程度采用Agatston 评分[5],由 2 位放射科医生独立进行,取两个数值的均数作为最后评分结果。根据Rumberger 冠脉钙化程度分级法,将患者分为 3 组:轻度钙化组 (CACs<100分)、中度钙化组 (CACs 100~400分)和重度钙化组(CACs>400分)。冠状动脉钙化定义为CACs>100分。
新发CVD事件的前瞻性随访所有患者自收集血样开始计时,随访24个月,记录随访期间所有新发生的CVD或原有CVD基础上的再发。CVD事件定义为[5]:充血性心力衰竭(根据临床表现判断为NYHAⅡ级以上)、心律失常(根据临床症状和心电图诊断)、心绞痛及心肌梗死、或心源性猝死;经确诊的短暂性脑缺血发作(TIA)、脑梗塞、脑出血。CVD死亡以患者的病史及死亡证明确认死亡事件及发生时间。
统计学方法采用《SPSS 22.0》统计软件进行数据分析。正态分布的计量资料以均数±标准差表示,两组间比较采用比较采用独立样本t检验,多组间比较采用方差分析。非正态分布的计量资料用M(1/4,3/4)表示,用 Log 转换后进行统计,组间比较采用Mann-Whitney U检验。计数资料用例数和百分率描述,组间比较采用χ2检验。Spearman相关分析SOST与CACs的相关性,Logistic回归分析血清SOST与冠脉钙化程度间的关系。Kaplan-Meier 法计算终点事件的累积发生率并绘制曲线,以Log-rank 检验进行显著性分析。影响CVD发生的危险因素分析采用COX回归分析,结果以风险比值[HR,95%CI]表示。ROC曲线分析血清SOST和CACs对预测CVD的价值。P<0.05为差异有统计学意义。
结 果
基本资料及冠状动脉钙化情况112例患者纳入本研究,其中男67例,女45例,平均年龄(58.92±11.90)岁,平均透析龄(61.18±25.15)个月;原发病为:慢性肾小球肾炎54例,糖尿病肾病31例;高血压肾损害9例,尿酸性肾病5例,多囊肾3例,梗阻性肾病2例,狼疮性肾炎1例,慢性间质性肾炎4例,不明病因4例。
CACs范围0~4 106分,中位CACs 238(19,595.21)分,冠状动脉钙化的发生率为58.03%(65/112)。根据 CACs分为3组(表1),组间在性别构成比、吸烟、Kt/V、血脂、血红蛋白、血浆白蛋白等方面均无显著性差异。与CACs<100分组比较,CACs>400分组年龄、透析龄、糖尿病及高血压患病率、血清SOST、hs-CRP、ALP、P、钙磷乘积等指标均显著增高(均P<0.05)。
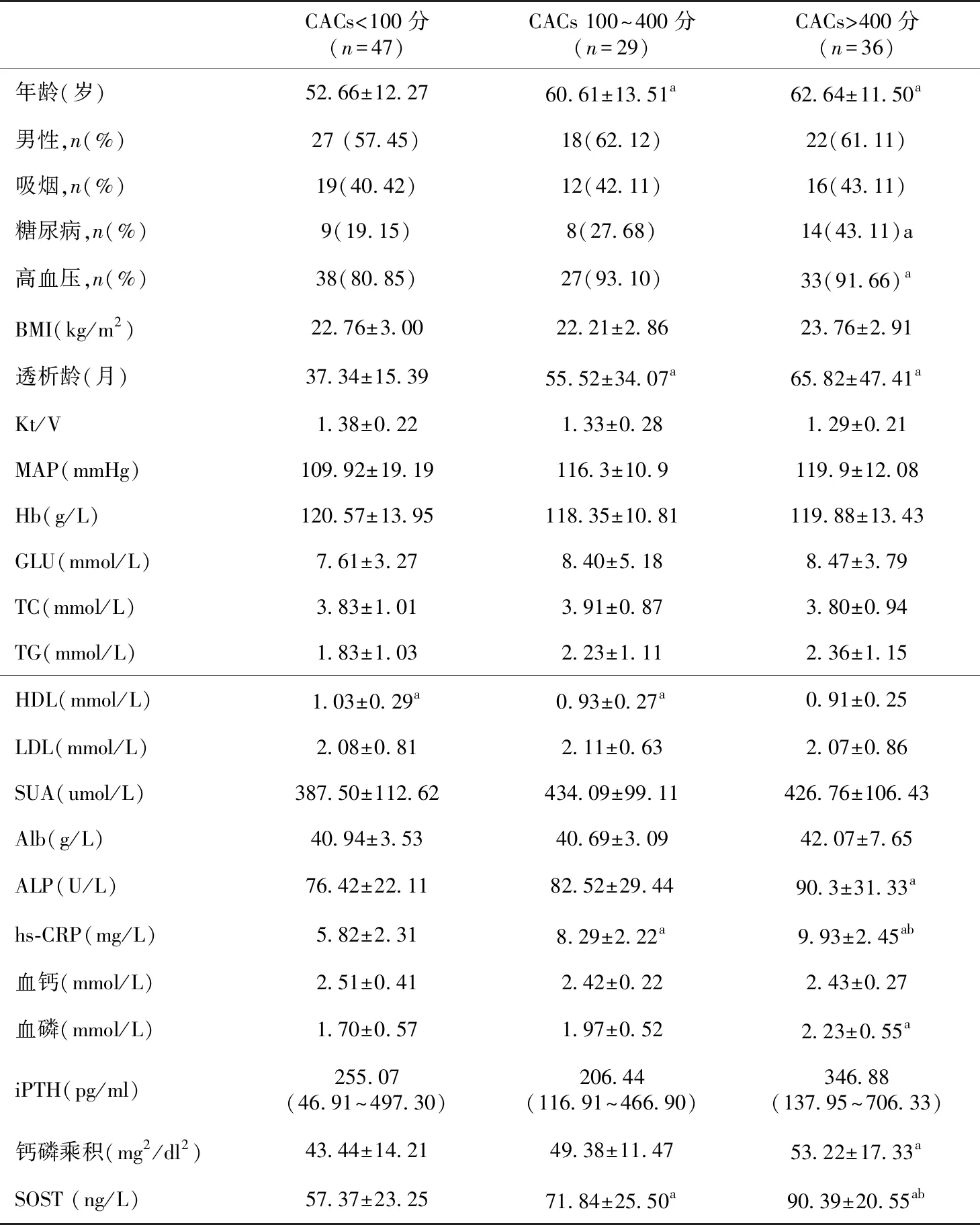
表1 不同冠状动脉钙化积分组患者的临床基本资料比较
冠状动脉钙化的相关危险因素Spearman相关分析显示 ,MHD患者CACs与年龄(r=0.212,P=0.046)、透析龄(r=0.261,P=0.014)、SOST(r=0.483,P=0.000)、血磷(r=0.281,P=0.008)、钙磷乘积(r=0.248,P=0.024) 、iPTH(r=0.218,P=0.038)、hs-CRP(r=0.293,P=0.009)、MAP(r=0.242,P=0.023)呈正相关(P<0.05),与其他指标无相关性(P>0.05)。以CACs=100分作为临界点分为两组,采用二元多因素Logistic回归分析冠状动脉钙化的危险因素,结果显示年龄(OR=1.072,P=0.032)、透析龄(OR=1.044,P=0.007)、SOST(OR=1.053,P=0.004)、血磷(OR=1.008,P=0.031)和hs-CRP(OR=1.053,P=0.035) 是MHD冠脉中、重度钙化的重要危险因素。
冠脉钙化与血清SOST的关系血清SOST中位数为72.30(20.18~193.12)ng/L,将患者分为<72.30 ng/L和≥72.30 ng/L两 组。Logistic回归分析显示血清SOST升高显著增加MHD患者冠脉中、重度钙化的风险;即使调整CKD相关CVD危险因素(如尿酸、血钙、血磷、iPTH、透析龄、Kt/v)和传统CVD危险因素(如性别、年龄、血压、空腹血糖、总胆固醇、低密度脂蛋白、吸烟史、糖尿病史),其危险度依然增高。血清SOST每增加1 个标准差(29.96 pg/ml),患者发生冠脉中、重度钙化的风险约增加0.49倍(表2)。

表2 血清SOST与冠脉中、重度钙化风险的关系
CVD事件累计风险24个月随访期内,共有39例患者发生CVD 57例次,其中冠状动脉疾病20例次(35.09%),充血性心力衰 竭18 例次(31.58%),脑血管意外12例次(21.05%),外周动脉闭塞 7例次(12.28%)。轻度钙化组12例次(25.53%) ,中度钙化组14例次(48.27%) ,均显著少于重度钙化组31例次 (86.11%),组间比较差异有统计学意义(P<0.01)。因CVD死亡9例,其中重度钙化组6 例(16.67%),中度钙化组2例(6.89%),轻度钙化组1 例(2.13%)。Kaplan-Meier生存分析发现,重度钙化组CVD的累计风险明显高于轻度钙化组与中度钙化组,中度钙化组又高于轻度钙化组,且Log-rank 检验表明组间差异具有统计学意义(χ2=59.629,P<0.000 1)(图 1A)。血清SOST≥72.30 ng/L组首次新发心血管事件发生率为67.86%,显著高于SOST<72.30 ng/L 组(25.58%),两组间CVD事件发生的累计风险存在统计学差异(χ2=21.343,P<0.000 1)(图 1B)。
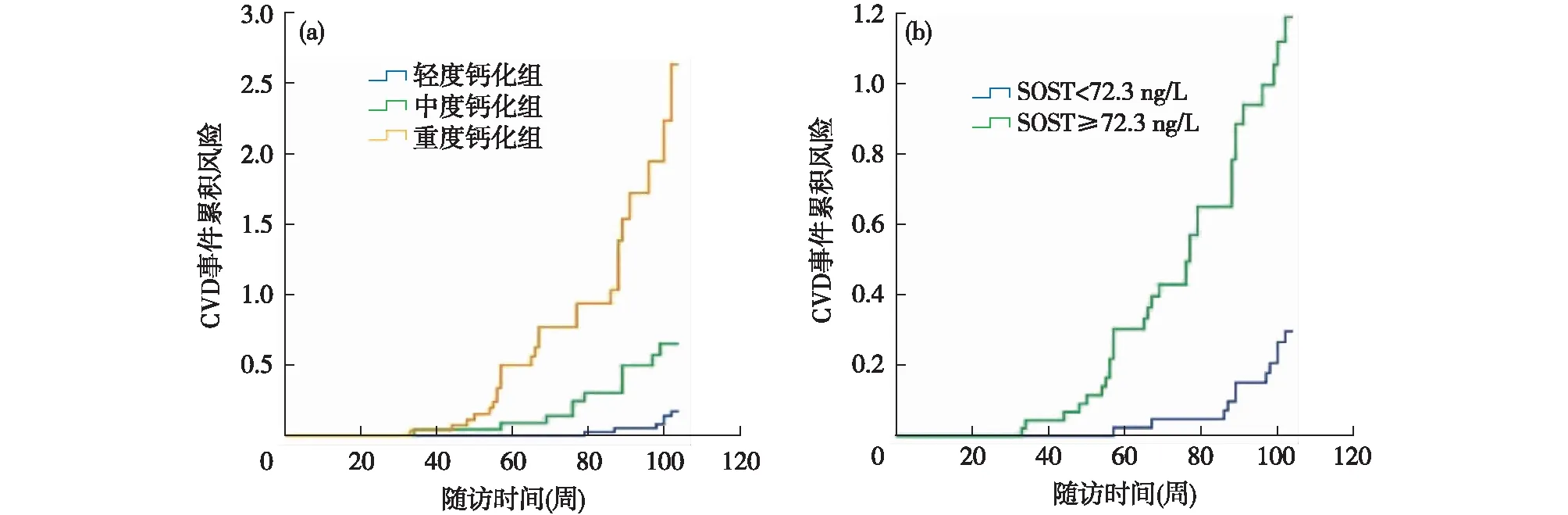
图1 维持性血液透析患者CVD事件累积风险比较A:冠脉钙化积分(CACs)分组CVD事件发生的累积风险;B:骨硬化蛋白(SOST)中位数分组CVD事件发生的累积风险
CVD事件相关危险因素分析将SOST、CACs作为连续变量及分类变量分别纳入COX回归分析模型。在单因素COX回归中,SOST、 CACs是CVD事件的独立危险因素(P<0.001) 。对年龄、透析龄、性别、iPTH、血磷、钙磷乘积、hs-CRP、ALP、MAP、Alb、Hb等临床及生化资料与CVD事件进行单因素分析,结果显示SOST、CACs、年龄、透析龄、血磷、hs-CRP 与CVD事件发生有统计学意义(P<0.05) ,然后在单因素分析基础上对P<0.1的变量进行多因素COX比例风险模型分析及多因素模型a分析显示,无论作为连续变量或分类变量SOST、 CACs仍然是心血管事件发生的独立危险因素(表3)。
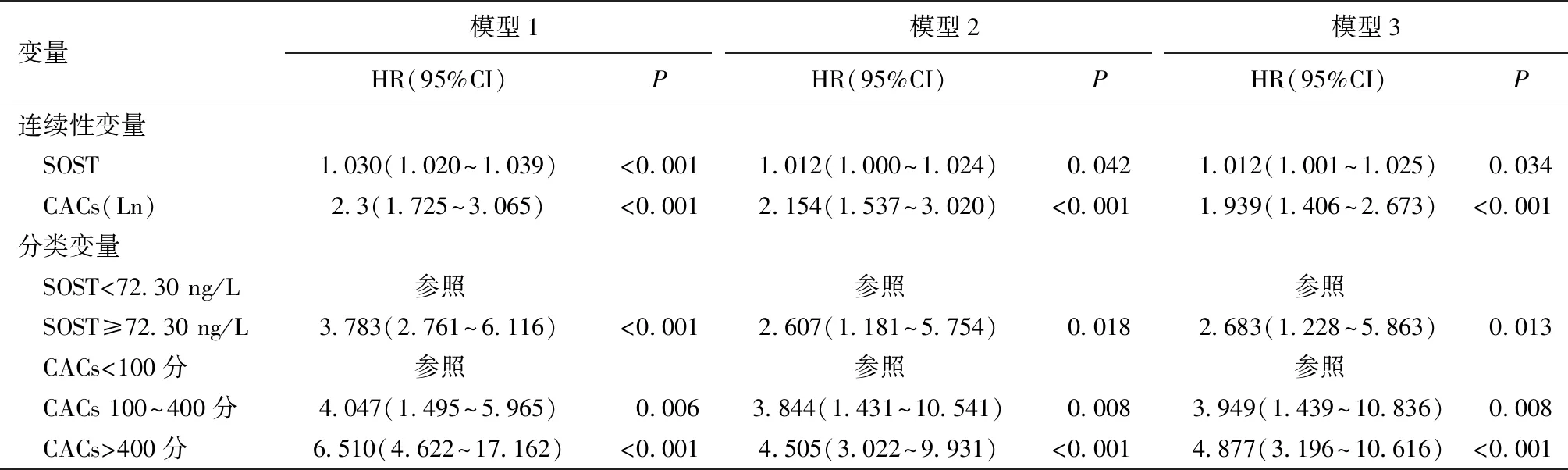
表3 影响新发CVD事件发生的 COX 回归模型分析
ROC曲线分析SOST预测CVD的曲线下面积(AUC)为0.796(95%CI为0.703~0.889,P=0.001),临界值为76.83 ng/L,灵敏度70.6%,特异度76.0%。CACs预测CVD的AUC为0.861(95%CI为0.786~0.963,P=0.000),临界值为189.5,灵敏度82.5%,特异度80.0%。当两者同时检测用于预测MHD患者CVD事件时,其AUC为0.897(95%CI为0.833~0.901,P=0.000)(图2)。
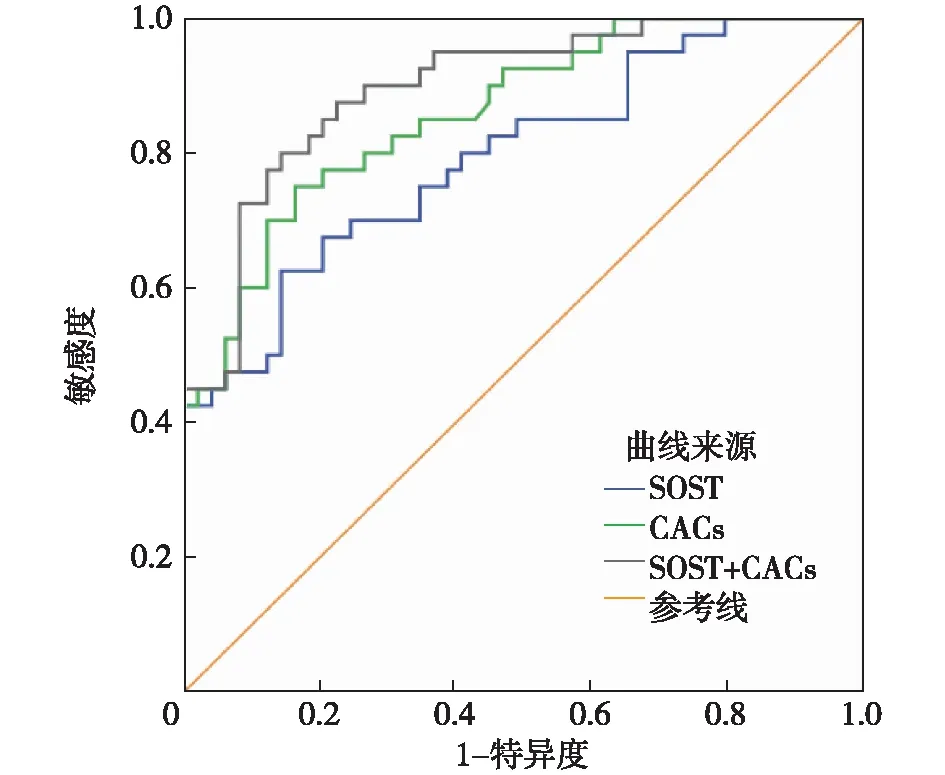
图2 CACs及SOST预测CVD的ROC曲线CACs:冠状动脉钙化积分;SOST:骨硬化蛋白;SOST+CACs:骨硬化蛋白联合冠状动脉钙化积分;CVD:心血管疾病
讨 论
心血管疾病是MHD患者的主要并发症及首位死亡原因[6]。大量研究报道,MHD 患者普遍存在冠脉钙化,比普通人群高2.5~5倍[7],且是CVD事件发生和死亡的独立危险因素[2]。因此重视冠脉钙化的筛查及早期干预,对于改善患者预后具有重要意义。
MSCT为基础的CACs是诊断冠脉钙化敏感度和特异度较高的方法[8]。根据Rumberger分级法,CACs积分为4 个等级,当CACs在101~400分时,冠状动脉已经产生中等程度的粥样斑块;CACs≥400分时则预示着冠状动脉已经产生了严重、广泛的粥样斑块,同时患者发生阻塞性心血管疾病的危险性显著提高,并且较易并发缺血性心肌病[9]。有研究报道,MHD患者发生钙化的部位和范围较普通人群更广泛,冠脉钙化(CACs>100)的比率高达70%以上,其中CACs大于1 000者20.2%[10]。我们的结果显示,本院41.96%MHD患者CACs位于0~100分,冠脉钙化(CACs>100分)的发生率58.03%,CACs>1 000分者占17.2%。Spearman相关分析显示,MHD患者CACs与年龄、透析龄、血磷、钙磷乘积、MAP、hs-CRP呈明显正相关(P<0.05);Logistic回归分析结果显示年龄、透析龄、血磷和hs-CRP是冠脉中、重度钙化的独立危险因素,表明促使MHD患者冠脉钙化进展是传统危险因素与CKD相关的非传统危险因素共同作用的结果。
SOST是由骨细胞通过SOST 基因表达产生的一种相对分子质量为22 000的分泌型糖蛋白,通过抑制Wnt/β-Catenin 信号通路参与骨代谢及血管钙化[11]。很多研究证实血清SOST 和CKD患者CVD相关死亡及全因死亡密切相关[12-13]。除了骨源性的SOST, Brandenburg等[14]体外实验证实血管平滑肌细胞在钙化过程中SOST的表达增加,同时发现MHD患者钙化的主动脉瓣局部也表达SOST,表明SOST水平可反映血管钙化的情况。有研究发现MHD患者血清SOST升高是严重腹主动脉钙化的独立危险因素[3]。但Balc等[15]研究相反,认为较低的SOST是动静脉内瘘钙化的独立危险因素。本研究结果显示MHD患者中,重度钙化组血清SOST水平明显高于轻度组,随着血清SOST水平的升高,冠脉钙化发生的比率明显增加,钙化程度趋向严重,CACs与SOST呈正相关,SOST升高是MHD患者发生冠脉中、重度钙化的独立危险因素,与王喆等[16]研究报道相符。血清SOST尤其是联合CKD相关和传统心血管危险因素,可以较准确地评估MHD患者冠脉中、重度钙化。24个月随访期内,共发生心血管事件57例次,重度钙化组CVD发生的累积风险和CVD发生率明显高于轻度和中度钙化组。COX 回归分析模型显示无论作为连续变量或分类变量,SOST和CACs升高均是CVD发生的独立危险因素,表明发生CVD的患者,冠脉钙化的发生率明显升高,钙化程度更为严重,血清SOST升高与血管钙化及CVD事件密切相关。此外本研究通过ROC曲线分析提示CACs和SOST对CVD发生均有较好的预测价值,而当两者联合预测CVD发生的准确性更高。相较于CACs,血清SOST无辐射、检测简单方便,价格低廉,可用于CVD高危人群的筛查、诊断甚至是治疗后的再评价,这无疑对CVD的防治具有十分重要的意义。
总之,本研究显示高水平的血清SOST是CAC 的独立危险因素,血清SOST升高与血管钙化及CVD事件密切相关。但本研究为单中心研究,样本量较少,随访时间相对较短,且目前不同生产厂家的SOST检测试剂盒,计量单位不同,对比性很难统一,研究结果的适用性存在一定局限。尤其SOST表达增加是否作为保护因素限制血管钙化的进展还不清楚,后续仍需关注血清SOST防治血管钙化的机制及其临床应用方面。

