华氏巨球蛋白血症相关肾损害的临床病理特征
童 玲 成水芹 陈 光 张 炯 黄 力 王金泉
华氏巨球蛋白血症(WM)是一种由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞组成的淋巴瘤[1-2]。>90%患者MYD88基因发生了突变[3]。WM累及肾脏可能是由于恶性肿瘤(高肿瘤负荷)或单克隆免疫球蛋白相关性肾病(MGRS)[4]。WM相关肾损害肾脏病理表现多样[5],明确WM相关肾损害病变,对指导WM治疗及判断预后至关重要。本研究回顾性分析WM相关肾损害患者的临床及病理特征,以提高WM相关肾损害的诊治水平。
对象和方法
研究对象2002年2月至2019年9月国家肾脏疾病临床研究中心住院明确诊断为WM的患者16例,均符合以下诊断标准[1-2]:(1)血清中有单克隆性的IgM(不论数量);(2)骨髓中有浆细胞样或浆细胞分化的小淋巴细胞呈小梁间隙侵犯(不论数量);(3)免疫表型:CD19+,CD20+,slgM+, CD22+,CD25+,CD27+,FMC7+,CD5+/-,CD10-,CD23-,CD103-,少数患者部分表达CD5、CD10、CD23;(4)除外其他已知类型的淋巴瘤。
观察指标患者的年龄、性别;肾脏损害的临床表现和病程;24h尿蛋白定量、尿本周蛋白;血红蛋白、血小板、血清白蛋白、球蛋白、血清肌酐,血清IgM、冷球蛋白、血游离轻链、免疫固定电泳、血β2微球蛋白、外周血CD20计数、血液黏滞度;双肾B超。组织活检:肾活检的光镜及免疫荧光、电镜检查、刚果红染色;皮肤黏膜活检;直肠黏膜活检;淋巴结活检;骨髓穿刺活检。
华氏巨球蛋白血症国际预后评分系统(ISSWM)评分年龄>65岁,血红蛋白≤115 g/L,血小板≤100×109/L,β2微球蛋白>3 mg/L,血清单克隆免疫球蛋白>70 g/L,以上各项为1分。低危组:0或1分且年龄≤65岁;中危组:2分或年龄>65岁;高危组:>2分[1-2]。
治疗及随访记录患者的治疗方案并回访观察蛋白尿、血清肌酐、IgM、免疫固定电泳、骨髓细胞学等变化。
统计学方法采用《SPSS 21.0》软件进行统计分析,计量资料采用均数±标准差、中位数表示,计数资料采用百分比表示。
结 果
16例患者中男性11例,女性5例,平均年龄60.9±11.3岁,出现肾脏损害至确诊WM平均病程3个月(1~6.75个月)。
临床表现
肾脏损害 11例就诊时有肾功能不全(1例合并肾病综合征),5例肾功能正常。就诊时血清白蛋白32.4±5.56 g/L,血清肌酐183.8 μmol/L(76.9~359.7 μmol/L),尿蛋白1.79(0.75~2.97) g/24h,2/15例尿本周蛋白阳性(表1)。
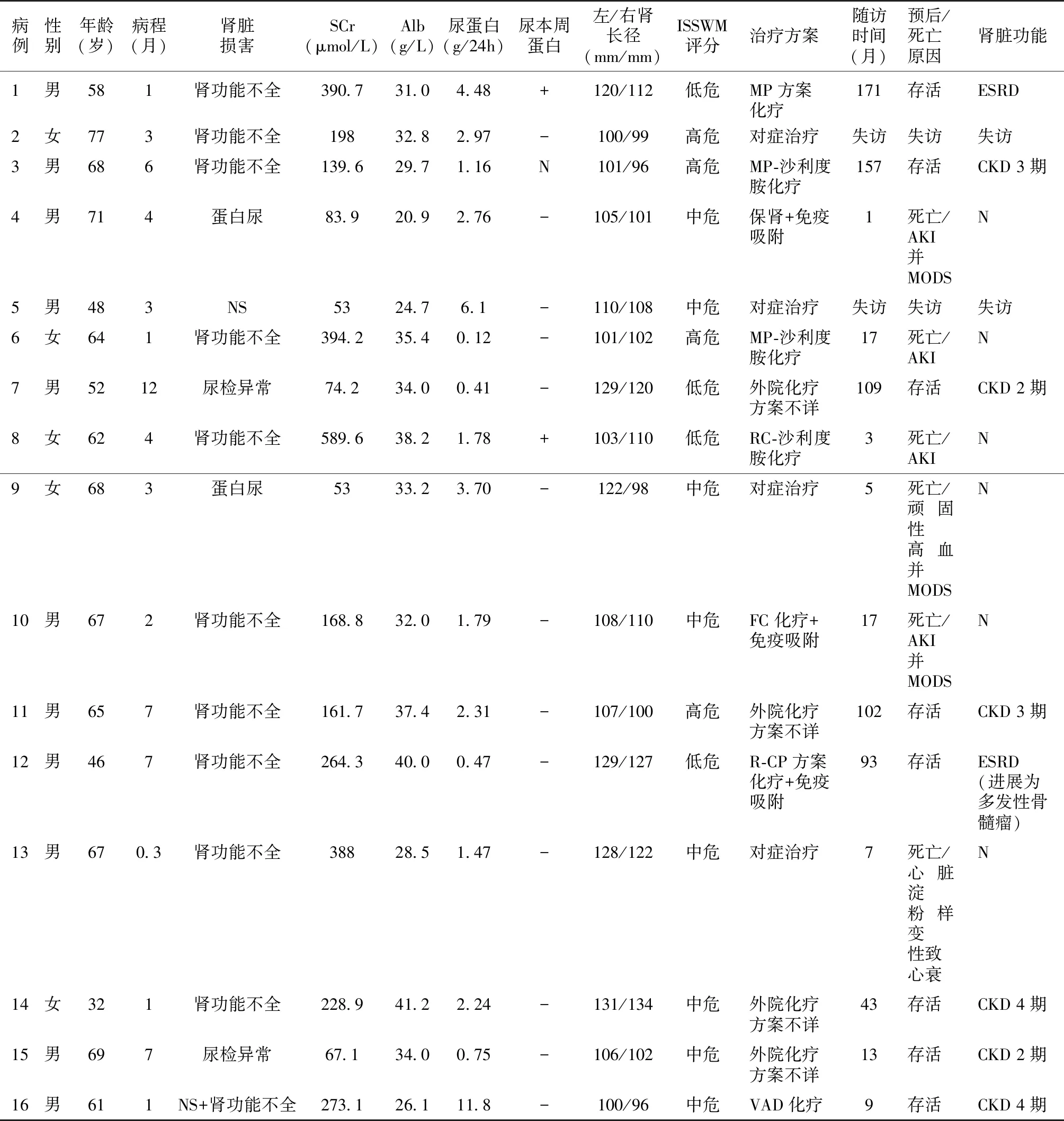
表1 华氏巨球蛋白血症相关肾损害患者基本情况及治疗预后
肾外损害 反复发热3例;消瘦5例;淋巴结肿大7例;脾大3例;鼻出血2例。16例均有贫血(血红蛋白83.2±20 g/L),12例球蛋白升高(球蛋白40.8±13.6 g/L);16例IgM均升高(30.6±16.9 g/L);免疫固定电泳10例为κ型单克隆IgM,1例为λ型单克隆IgM;15/15例血轻链比值异常,4/11例冷球蛋白血症;8/14例有低补体血症;例8和例14完善血浆黏滞度检测,分别为1.35 mPas和1.48 mPas(正常值1.26~1.66 mPas)(表2)。
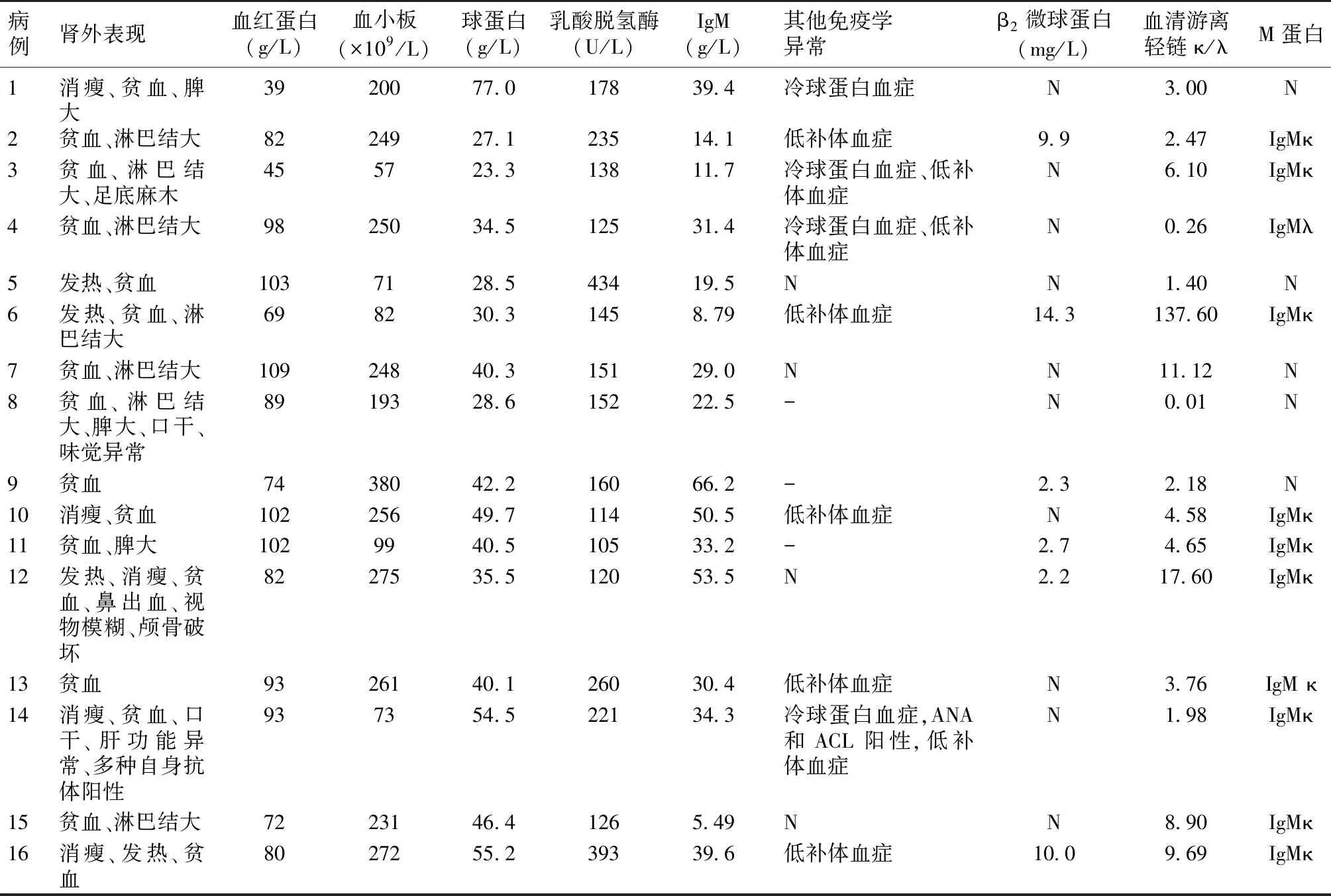
表2 华氏巨球蛋白血症相关肾外表现及实验室检查
病理特征例13直肠黏膜和皮肤淀粉刚果红染色均为阳性,证实为系统性淀粉样变性;例4直肠黏膜刚果红染色阳性;例2直肠黏膜刚果红染色阳性,但肾活检刚果红染色阴性。
8例行肾活检,3例肾小球系膜增生病变,肾小球轻微病变、肾小球内皮细胞病变、肾小球膜增生样病变、肾小球毛细血管袢皱缩、κ型轻链沉积病各1例。免疫荧光以IgM阳性为主。另可见上皮侧或内皮下电子致密物沉积(例5、例14),系膜溶解(例2、例11)、肾小球毛细血管袢腔内红细胞堆积(例16)、肾小球基膜内、肾小球囊壁及小管基膜亦见上述泥沙样电子致密物沉积(例12)。电镜下肾小球系膜区和外周袢细胞内和肾间质细胞可见结晶样物,密度较低,呈菱形、棒状或长方形(例11 )(图1、表3)。肾组织刚果红染色均为阴性(表3)。2例行右腹股沟淋巴结活检,例4为淋巴浆细胞型淋巴瘤(表型CD3+、CD20+、CD43+、CD79a+);例7为淋巴细胞轻度增生伴纤维组织增生(表型CD3+、CD20+、CD43+、CD79a+、CD138+、VS38c+)。骨髓穿刺及骨髓活检结果见表4。

图1 例11的肾脏病理表现A:肾小球系膜溶解(↑)(PAS,×400);B:肾小管间质慢性病变中度(↑)(HE,×200);C、D:肾小球系膜区和外周袢细胞内和肾间质细胞可见结晶样物,呈菱形、棒状或长方形(↑)(EM)
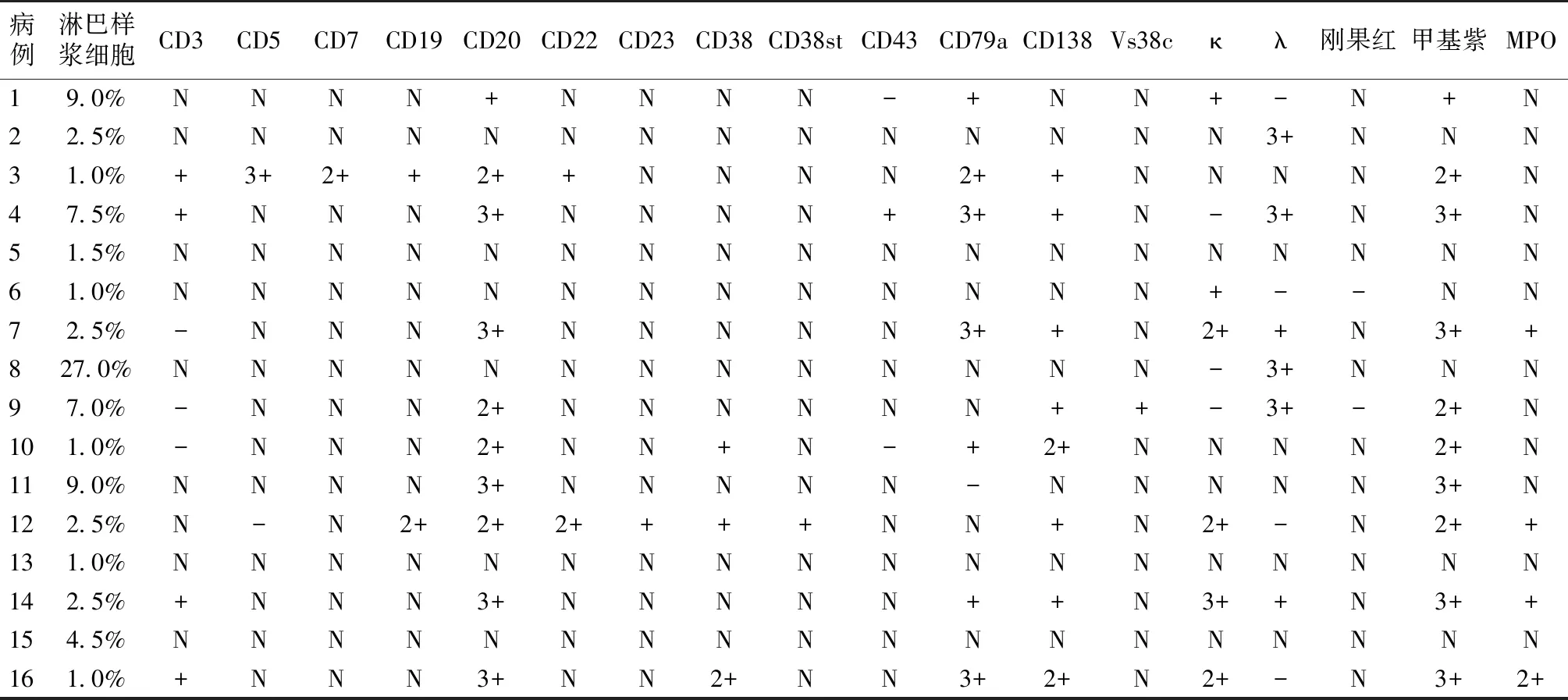
表4 华氏巨球蛋白血症相关肾损害患者骨髓穿刺活检结果

表3 华氏巨球蛋白血症相关肾损害患者的病理表现
治疗及预后患者随访时间1~171个月不等(表1),2例失访,6 例死亡,8例存活(例12转化为骨髓瘤),4例经治疗后为缓解状态,尿蛋白部分缓解,肾功能为CKD 2~4期。
讨 论
WM早期为单克隆IgM相关的意义不明的单克隆免疫球蛋白病,随后进展为冒烟型WM (SWM)[6],需要更密切的随访和监测[7]。我中心WM相关肾损害占同期住院患者肾活检比例约为0.018%。患者进展至症状性WM表现为疲乏、厌食、贫血、周围神经病变、消瘦、发热、雷诺现象、高黏滞血症等,另有肝脾肿大、淋巴结肿大、紫癜、出血等[8]。绝大多数WM患者血清免疫固定电泳可见IgM型κ型条带[9]和β2微球蛋白升高[10]。与既往研究不同,本研究还发现WM患者低补体血症发生率较高。
文献报道WM相关肾损害多为非选择性的少~中等量蛋白尿,偶尔见肾病综合征,常伴血尿、肾小球滤过率降低、氮质血症、肾小管浓缩功能障碍[5,11]。本研究11例患者以肾功能不全起病,1例患者表现为肾病综合征。WM患者肾脏损害的原因:(1)IgM沉积于肾小球并在毛细血管腔内形成类血栓样物质;(2)IgM被肾小管上皮细胞吞饮,造成肾小球和肾小管直接损害。间接肾脏损害原因可能为血浆内IgM分子间相互聚合或IgM与其他血浆蛋白相结合,而肾小球的超滤过特性有利于此过程并使其局部浓度升高而发生凝集,即为高黏滞血症或冷球蛋白血症,少数表现为淀粉样变性及轻链沉积病,最终导致肾脏损害。
以往报道WM典型的肾脏病理活检可见肾小球毛细血管内血栓形成,纤维蛋白较少,亦称“假血栓”,免疫荧光以IgM沉积物多见[5]。本研究中8例行肾活检患者均未见典型的肾小球毛细血管内血栓形成,可能与本研究样本量较小或肾组织取材有关。Chauvet等[12]报道26例WM肾损害患者有11例肾小球淀粉样变性,12例非淀粉样肾小球病,6例非淀粉样肾小管间质性肾病。另有研究表明皮肤脂肪及直肠黏膜活检同时刚果红染色阳性对诊断AL型淀粉样变性阳性率达100%,对于不适合行肾活检的患者,可同时行皮肤脂肪及直肠黏膜活检以诊断 AL型淀粉样变性[13]。本研究16例患者中2例未行肾活检,其直肠黏膜刚果红染色阳性,这2例患者中有1例同时行皮肤脂肪刚果红染色为阳性。有1例肾组织刚果红染色阴性但直肠黏膜刚果红染色阳性,可能与肾组织取材局限相关。本研究共3例为淀粉样变性。Vos等[5]总结1 391例WM患者中44例患者行肾活检:11例淀粉样变性,10例伴单克隆IgM沉积病,9例轻链沉积病,8例淋巴浆细胞淋巴瘤浸润,轻链沉积病、管型肾病各4例;冷球蛋白血症、血栓性微血管病变各3例,微小病变、膜性肾病各2例,轻重链沉积病、重链沉积病、轻链近端肾小管沉积病各1例。本研究也证实了WM相关肾损害的肾脏病理表现多样的特点,其中1例患者电镜可见系膜区和外周袢细胞内和肾间质细胞见结晶样物,密度较低,呈菱形、棒状或长方形。故考虑肾小球膜增生样病变、κ型轻链沉积病和WM直接相关,肾小球系膜增生病变、肾小球轻微病变、肾小球内皮细胞病变、系膜区和外周袢细胞内和肾间质细胞结晶样物可能与WM相关。
WM的治疗方法包括血浆置换、放化疗及造血干细胞移植,治疗药物有核苷酸类药物、烷化剂、CD20单抗、蛋白酶体抑制剂、新型药物BCL2抑制剂和抗CXCR4单抗等[14-15]。有报道利妥昔单抗治疗WM肾损害患者肾功能好转并摆脱透析[16]。16例患者中,本研究ISSWM评分为中高危患者占75%,提示患者预后较差,但经化疗的患者预后较单纯保肾治疗患者好。
小结: WM相关肾损害好发于中老年,男性多见,肾功能不全发生率高,肾脏病理改变多种多样,肾小球系膜增生样病变最常见。患者总体预后不佳。由于本文是回顾性研究,样本较小,随访时间相对短,部分患者临床检查不完善,需结合其他样本量相对较大的前瞻性研究,全面评估WM的相关肾损害的临床病理特征。

