miR-199a-5p靶向PDCD5基因调控幼年类风湿关节炎软骨细胞的增殖和凋亡
符艺影 许志有 韩 萍 董战玲 郑诗华 王小花
(海口市第三人民医院儿科,海口 571100)
幼年型类风湿关节炎(juvenile rheumatoid arthritis,JRA)是一种以慢性关节炎为主要特征的小儿时期常见的结缔组织病,对儿童危害较大,发病率大约7/10万[1]。近来的研究表明软骨细胞在抑制RA的软骨破坏中具有重要作用[2],理解软骨细胞增殖和凋亡的分子机制可能为RA的治疗提供新的潜在治疗思路。
研究表明,miR-199a-5p在大鼠脊髓缺血/再灌注损伤(IRI)中表达降低,七氟烷可通过增加miR-199a-5p表达,减少细胞凋亡,保护大鼠脊髓细胞[3]。miR-199a-5p在小鼠肝脏IRI模型中表达明显下调,其能够在缺氧/复氧过程中对细胞起到保护作用[4]。而miR-199a-5p在RA中对软骨细胞是否有保护作用还不清楚。通过TargetScan预测,PDCD5的3′UTR序列中含有与miR-199a-5p互补的核苷酸序列,可能是miR-199a-5p的下游靶基因。程序化细胞死亡5(programmed cell death 5,PDCD5)在骨关节炎软骨细胞中表达上调,可能参与骨关节炎软骨细胞的凋亡过程[5]。PDCD5在SD大鼠脑IRI损伤后海马组织中、H/R损伤的心肌细胞和I/R后的心肌细胞中表达升高,抑制PDCD5的表达,可抑制细胞凋亡或增加细胞存活率[6-8]。miR-199a-5p在RA软骨细胞中的表达、对其影响以及miR-199a-5p与PDCD5在RA中的关系还尚未可知。
本课题研究miR-199a-5p影响RA软骨细胞增殖、凋亡的分子机制,并探讨PDCD5在此过程中的作用,以期为RA的临床治疗提供新的方向。
1 资料与方法
1.1资料
1.1.1一般资料 人RA软骨细胞和人正常软骨细胞由分离培养所得,样本采用海口市第三人民医院骨科10例RA患者行人工关节置换术废弃的关节软骨标本[男6例,女4例,年龄5~9岁,平均年龄(6.1±1.52)岁]和4例因下肢损毁性创伤手术废弃的膝正常关节软骨标本[男2例,女2例,年龄4~10岁,平均年龄(7.0±2.94)岁],与所有患者家属签订知情同意书,RA患者的临床诊断特征均符合美国风湿病学会标准。
1.1.2主要试剂 高糖DMEM培养基和胎牛血清(FBS)购自美国Gibco公司;胰蛋白酶Trypsin、四氮唑蓝(MTT)和二甲基亚砜(DMSO)购自Sigma-Aldrich公司;抗PDCD5抗体、抗CyclinD1抗体、抗p21抗体、抗p27抗体、抗Bcl-2抗体、抗Bax抗体、抗cleaved-caspase3抗体和抗GAPDH抗体购自英国Abcam公司;引物、miR-199a-5p模拟物(miR-199a-5p)、抑制剂(anti-miR-199a-5p)、PDCD5的过表达载体(pcDNA-PDCD5)、干扰物(si-PDCD5)、空载体和阴性对照(miR-NC、anti-miR-NC和si-NC)及双荧光载体的构建购自上海吉玛制药有限公司;双荧光素酶报告系统购自美国Promega公司;Ⅱ型胶原酶、TRIzol试剂、real-time PCR 试剂盒、反转录试剂盒(RT-PCR)、Lipofectamine 2000转染试剂购自美国Invitrogen公司;流式细胞仪和凋亡检测试剂盒购自美国BD公司;光学显微镜、全自动酶标仪、发光仪及Real-time PCR仪购自美国Bio-Rad公司。
1.2方法
1.2.1软骨细胞分离和培养[9]细胞分离:将上述关节软骨组织置于含1%青-链霉素的PBS溶液中,无菌条件下避开增生骨赘表面的薄层纤维软骨,将软骨组织剪成约1 mm3的软骨块,PBS清洗2遍,收集软骨块,加入约5倍体积的含0.25%胰蛋白酶和10%FBS的DMEM培养液(含1%青-链霉素),37℃孵育消化30 min,弃消化,加入含0.2%Ⅱ型胶原酶和10%FBS的DMEM培养液(含1%青-链霉素),37℃摇床振荡消化约16 h,离心,弃上清,用高糖DMEM培养液洗涤3遍,经200目钢网过滤,即为处理好的软骨细胞。
细胞培养:用含10%FBS的高糖DMEM培养液(添加100 U/ml青霉素+100 μg/ml链霉素),在饱和湿度的37℃ 5% CO2培养箱中培养,每48 h换一次培养液,待细胞铺满瓶底或融合度达80%~90%时收集细胞和消化传代。
1.2.2细胞转染 将软骨细胞用培养液稀释至1×106个/ml,接种于6孔板中,细胞培养至融合度达80%~90% 时进行转染。用无血清OptiMEM培养液稀释Lipofectamine 2000、miR-199a-5p模拟物(miR-199a-5p)、抑制剂(anti-miR-199a-5p)、PDCD5的过表达载体(pcDNA-PDCD5)、干扰物(si-PDCD5)、空载体和阴性对照(miR-NC、anti-miR-NC和si-NC)及双荧光载体,然后取等体积脂质体与等体积各组载体或片段混合,室温孵育20 min,加入培养好的软骨细胞中,混匀后继续培养,6 h后换成完全培养基,转染48 h,收集细胞验证转染效果,进行后续实验。
1.2.3qRT-PCR检测RNA的表达 收集各组软骨细胞,用TRIzol提取细胞总RNA,-80℃保存。然后按照反转录PCR试剂盒说明书合成cDNA,以合成的cDNA为模板,按照 real-time PCR的说明书进行qRT-PCR反应,合成PDCD5 mRNA和miR-199a-5p,反应程序为:95℃5 min;95℃40 s、58℃45 s、72℃45 s,40个循环;72℃10 min。用2-ΔΔCt方法进行数据分析。
1.2.4MTT实验测定细胞活性 收集培养好的软骨细胞,消化细胞,用培养液稀释细胞为1×104个/ml,按照每孔200 μl细胞/孔接种于96微孔板中,继续培养,分别在24 h、48 h、72 h进行 MTT 实验,每孔加入 20 μl MTT溶液,继续培养4 h,弃上清,然后每孔加入150 μl DMSO,室温振荡孵育10 min,酶标仪测定OD490 nm处的吸光度(A)值。
1.2.5流式细胞术检测细胞凋亡率 将转染后的各组软骨细胞培养至对数生长期,用培养液稀释细胞为1×105个/ml,接种于24孔板中,继续培养72 h,收集细胞PBS缓冲液洗涤2次,根据Annexin V/PI kit说明书操作,用100 μl标记缓冲液重悬细胞,然后加入5 μl膜联蛋白V-FITC(Annexin V-FITC)和 10 μl碘化丙啶(propidium iodide,PI),室温避光20 min,加入400 μl标记缓冲液,用流式细胞仪检测分析细胞凋亡率。
1.2.6双荧光素酶报告系统实验 按照1.2.2的方法将构建好的PDCD5野生型(WT-PDCD5)和突变型(MUT-PDCD5)双荧光素酶报告载体,然后分别与miR-NC或miR-199a-5p共转染培养好的软骨细胞,转染后培养48 h,收集细胞,加入裂解缓冲液,室温裂解20 min,离心收集上清,加入荧光素酶底物,发光仪检测荧光素酶活性。以海肾荧光素酶活性为内参照,计算相对萤火虫荧光素酶活性。
1.2.7Western blot实验 收集各组软骨细胞,加入RIPA裂解液,室温裂解30 min,超声破碎细胞,离心收集蛋白,检测蛋白浓度。然后进行SDS-PAGE,转PVDF膜,脱脂奶粉室温封闭2 h,分别加入一抗,抗CDCA5抗体(1∶1 000)、CyclinD1抗体(1∶1 000)、p21抗体(1∶1 000)、p27抗体(1∶1 500)、抗Bcl-2抗体(1∶1 000)、抗Bax抗体(1∶1 200)、抗cleaved-caspase3抗体(1∶1 000)和抗GAPDH抗体(1∶2 000),4℃孵育过夜。洗膜2次,然后加入稀释的二抗,室温孵育2 h。以GAPDH为内参照,分析蛋白水平。
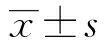
2 结果
2.1miR-199a-5p和PDCD5在RA软骨细胞和正常软骨细胞中的表达 qRT-PCR和Western blot结果表明,与normal组相比,在RA组软骨细胞中miR-199a-5p的表达量显著降低(P<0.05),而PDCD5 mRNA和蛋白表达量则显著升高(P<0.05),见图1。
2.2miR-199a-5p过表达可促进RA软骨细胞增殖 结果表明,与normal组相比,RA组miR-199a-5p表达量下降(P<0.05),促增殖蛋白CyclinD1表达下降(P<0.05),增殖负调控蛋白p21和p27表达量上升(P<0.05),软骨细胞增殖活性显著下降(P<0.05);与RA+miR-NC组相比,RA+miR-199a-5p组的miR-199a-5p表达量显著升高(P<0.05),CyclinD1表达上升(P<0.05),p21和p27表达量降低(P<0.05),软骨细胞增殖活性显著升高(P<0.05),见图2。
2.3过表达miR-199a-5p可抑制RA软骨细胞凋亡 流式细胞术和Western blot结果表明,与normal组相比,RA组软骨细胞凋亡率显著上升(P<0.05),抗凋亡蛋白Bcl-2表达降低(P<0.05),凋亡蛋白Bax和cleaved-caspase3表达量上升(P<0.05);与RA+miR-NC组相比,RA+miR-199a-5p组软骨细胞凋亡率显著下降(P<0.05),抗凋亡蛋白Bcl-2表达升高(P<0.05),凋亡蛋白Bax和cleaved-caspase3表达量降低(P<0.05),见图3。
2.4抑制PDCD5表达可促进RA软骨细胞增殖和抑制细胞凋亡 结果表明,与normal组相比,RA组的PDCD5蛋白表达量显著升高(P<0.05),CyclinD1表达降低(P<0.05),p21表达量升高(P<0.05),抗凋亡蛋白Bcl-2表达降低(P<0.05),凋亡蛋白Bax表达量上升(P<0.05),细胞增殖活性降低(P<0.05),凋亡率显著升高(P<0.05);与RA+si-NC组相比,RA+si-PDCD5组的PDCD5蛋白表达量降低(P<0.05),CyclinD1表达升高(P<0.05),p21表达量降低(P<0.05),抗凋亡蛋白Bcl-2表达升高(P<0.05),凋亡蛋白Bax表达量降低(P<0.05),细胞增殖活性升高(P<0.05),凋亡率显著降低(P<0.05),见图4。
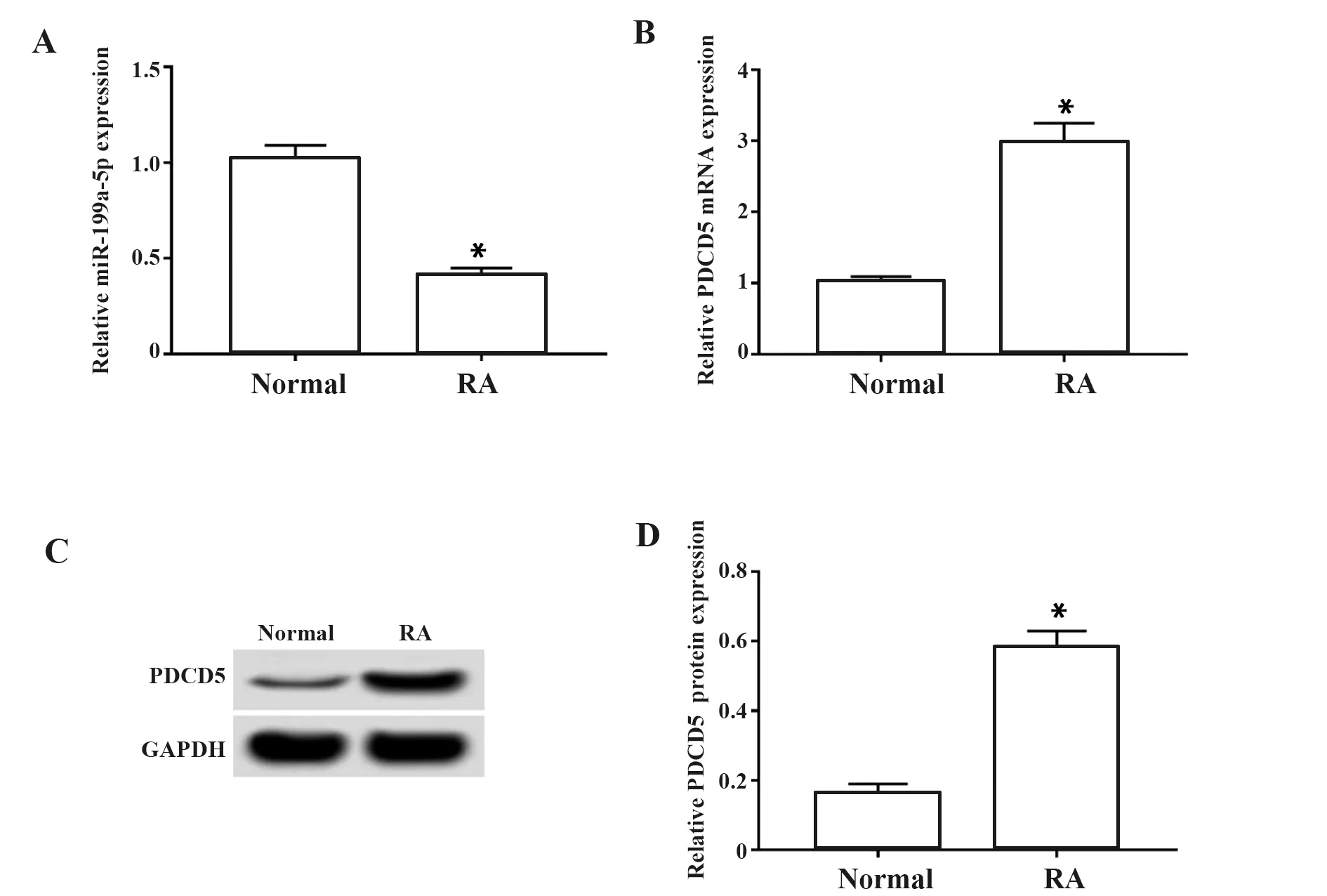
图1 miR-199a-5p和PDCD5在RA软骨细胞和正常软骨细胞中的表达Fig.1 Expression levels of miR-199a-5p and PDCD5 in RA chondrocytes and normal chondrocytesNote: A.Expression levels of miR-199a-5p in RA chondrocytes and normal chondrocytes;B.Expression levels of PDCD5 mRNA in RA chondrocyte and normal chondrocytes;C and D.Expression levels of PDCD5 protein in RA chondrocyte and normal chondrocytes,*.P<0.05 vs Normal group.

图2 过表达miR-199a-5p对RA软骨细胞增殖的影响Fig.2 Effect of overexpression of miR-199a-5p on proliferation of RA chondrocytesNote: A.Relative expression of miR-199a-5p in RA chondrocyte;B.Effect of overexpression of miR-199a-5p on proliferation of RA chondrocytes;C and D.Effect of overexpression of miR-199a-5p on the expression of proliferation-related proteins in chondrocytes,*.P<0.05 vs normal group;#.P<0.05 vs RA+miR-NC group.
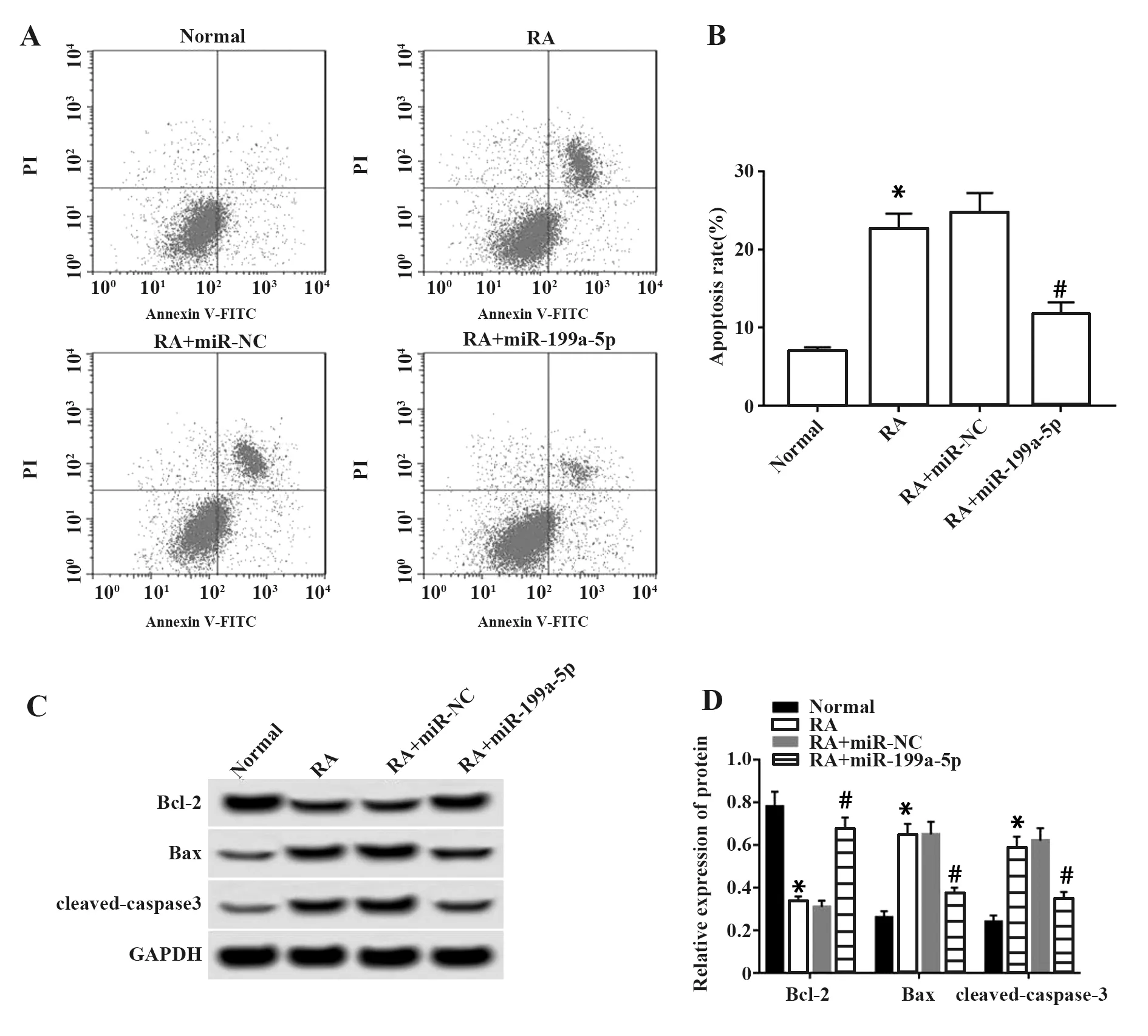
图3 miR-199a-5p过表达对RA软骨细胞凋亡的影响Fig.3 Effect of overexpression of miR-199a-5p on apoptosis of RA chondrocytesNote: A.Flow cytometry was used to detect apoptosis of chondrocyte;B.Effects of overexpression of miR-199a-5p on cell apoptosis in RA chondrocyte;C and D.Effect of miR-199a-5p overexpression on the expression of apoptosis-related proteins in RA chondrocytes,*.P<0.05 vs normal group;#.P<0.05 vs RA+miR-NC group.
2.5miR-199a-5p靶向调控PDCD5的表达 通过Targetscan预测结果发现,PDCD5的3′UTR序列中含有与miR-199a-5p互补的核苷酸序列,见图5A。

图4 过表达PDCD5对RA软骨细胞增殖、凋亡的影响Fig.4 Effects of overexpression PDCD5 on proliferation and apoptosis of RA Note: A.Expression levels of proteins in chondrocyte detected by Western blot;B.Relative expression of PDCD5 protein in RA chondrocyte;C and D.Effects of inhibition of PDCD5 on cell proliferation and the expression of proliferation-related proteins in RA chondrocyte;E and F.Effects of inhibition of PDCD5 on cell apoptosis and the expression of apoptosis-related proteins in RA chondrocyte,*.P<0.05 vs miR-NC group;#.P<0.05 vs RA+si-NC group.
图5 miR-199a-5p和PDCD5在RA软骨细胞中的调控关系Fig.5 Regulatory relationship between miR-199a-5p and PDCD5 in RA Note: A.The sequence of PDCD5 3′UTR contains complementary nucleotide sequences with miR-199a-5p;B.Dual luciferase reporter assay;C and D.miR-199a-5p regulates the expression of PDCD5 protein,*.P<0.05 vs miR-NC group,#.P<0.05 vs anti-miR-NC group.
双荧光素酶报告系统结果如图5B所示,与miR-NC组相比,miR-199a-5p组野生型WT-PDCD5的萤火虫荧光素酶相对活性显著下降(P<0.05),而突变型MUT-PDCD5的萤火虫荧光素酶相对活性没有显著变化。Western blot结果发现,与miR-NC组相比,miR-199a-5p组的PDCD5表达量显著降低(P<0.05);与anti-miR-NC组相比,anti-miR-199a-5p组的PDCD5表达量显著上升(P<0.05),见图5C、D。
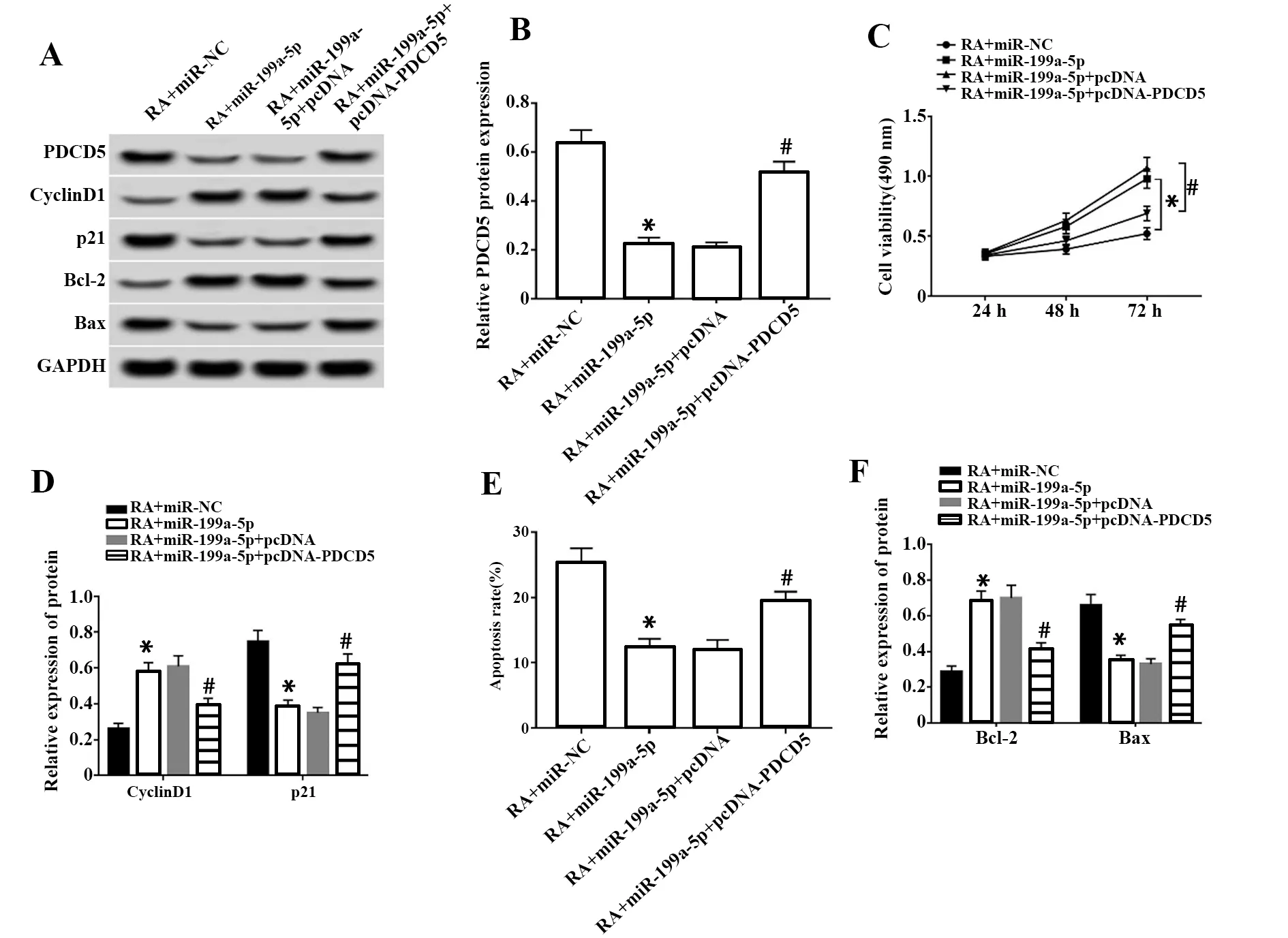
图6 过表达PDCD5逆转了miR-199a-5p过表达对RA软骨细胞增殖和凋亡的影响Fig.6 Overexpression of PDCD5 reversed effect of miR-199a-5p overexpression on proliferation and apoptosis of RA chondrocytesNote: A.Expression levels of proteins in chondrocyte detected by Western blot;B.Relative expression of PDCD5 protein in RA chondrocyte;C and D.Overexpression of PDCD5 reversed the effects of miR-199a-5p overexpression on proliferation and the expression of proliferation-related proteins of RA chondrocyte;E and F.Overexpression of PDCD5 reversed the effects of miR-199a-5p overexpression on apoptosis and the expression apoptosis-related proteins of RA chondrocyte.*.P<0.05 vs RA+miR-NC group;#.P<0.05 vs RA+miR-199a-5p+pcDNA group.
2.6PDCD5过表达逆转了miR-199a-5p过表达对RA软骨细胞增殖和凋亡的作用 结果显示,与RA+miR-NC组相比,RA+miR-199a-5p组软骨细胞中PDCD5表达量显著下降(P<0.05),增殖相关蛋白CyclinD1表达升高(P<0.05),p21表达下降(P<0.05),细胞增殖活性显著升高(P<0.05),抗凋亡蛋白Bcl-2表达升高(P<0.05),凋亡蛋白Bax表达下降(P<0.05),细胞凋亡率显著降低(P<0.05);与RA+miR-199a-5p+pcDNA组相比,RA+miR-199a-5p+pcDNA-PDCD5组PDCD5表达量显著升高(P<0.05),CyclinD1表达下降(P<0.05),p21表达升高(P<0.05),细胞增殖活性显著降低(P<0.05),抗凋亡蛋白Bcl-2表达降低(P<0.05),凋亡蛋白Bax表达升高(P<0.05),细胞凋亡率显著升高(P<0.05)。见图6。
3 讨论
JRA比成人RA具有更多、更突出的全身症状,导致约20%患者关节永久损害和严重残疾[10],软骨和骨组织的结构损伤以及由此造成的关节破坏是RA的一个显著特征[11],阐明软骨损伤和修复机制有助于理解RA发病机制,也有助于改进现有的诊断和治疗方法。
大量研究表明,miRNAs在RA患者的外周血、滑膜组织、滑膜成纤维细胞和滑膜液中异常表达,参与调控RASFs的增殖、凋亡和侵袭[12],但在软骨细胞中的研究较少。miR-199a在人恶性肿瘤中异常表达,miR-199a-5p在大鼠脑缺血再灌注损伤和大鼠溃疡性结肠炎中表达上调,药物可通过下调miR-199a-5p改善炎症损伤[13-15]。miR-199a-5p在中枢神经系统慢性炎症性脱髓鞘疾病的多发性硬化(mulitple sclerosis,MS)患者血清中表达下调,可能作为MS患者复发鉴别的诊断指标[16]。有研究表明,在中药治疗的骨关节炎的关节软骨中miR-199a-5p表达升高[17]。miR-199a-5p在RA中的表达情况和作用尚不清楚。本研究结果发现,在JRA软骨细胞中miR-199a-5p表达量显著降低,过表达miR-199a-5p可促进JRA软骨细胞增殖,抑制JRA软骨细胞凋亡,说明miR-199a-5p在JRA中具有重要作用。
本研究通过生物信息学预测发现,PDCD5的3′UTR中含有与miR-199a-5p互补的核苷酸序列,提示miR-199a-5p与PDCD5之间可能存在结合位点或调控关系,PDCD5在RA中可能也有调控作用。PDCD5在细胞凋亡和旁体细胞死亡中起重要作用,在培养基中添加外源重组PDCD5也能增强特定刺激引起程序性细胞死亡[18]。有研究表明,PDCD5还可通过PDCD5-TIP60-FOXP3通路促进调节T细胞功能,参与免疫调节[19]。Wang等[20]发现,PDCD5在RA患者血浆和滑膜液中表达上调,与滑膜液中TNF-α表达呈负相关,在血浆中与C反应蛋白和血沉呈负相关。RA患者血清和滑膜液中PDCD5水平与IL-17水平呈负相关[21],过表达PDCD5可促进雷公藤甲素诱导的RA成纤维样滑膜细胞凋亡,PDCD5影响RA发病机制[22]。本研究结果发现,PDCD5在JRA软骨细胞中表达上调,抑制PDCD5表达可促进JRA软骨细胞增殖并抑制凋亡,与上述结果呼应[22]。
本研究通过双荧光素酶报告系统和Western blot进一步确认,miR-199a-5p靶向调控PDCD5的表达,过表达PDCD5逆转了miR-199a-5p过表达对软骨细胞增殖和凋亡的作用,验证了两者在JRA软骨细胞中的调控关系。
本研究阐述了miR-199a-5p在JRA软骨细胞靶向调控PDCD5的表达,影响软骨细胞增殖和凋亡,在JRA发病机制中具有重要作用。综上,本研究为JRA分子靶向治疗提供了新的研究方向,miR-199a-5p和PDCD5有望成为JRA潜在治疗靶点。

