新生儿乙肝表面抗原阳性的确认及原因分析①
王菊英 刘瑶瑶 李 锋
(宁夏医科大学总医院医学实验中心,银川 750004)
电化学发光法(ECLIA)检测乙型肝炎病毒(HBV)感染在临床中诊断率较高[1]。近年来,临床检验中出现多例新生儿乙肝表面抗原(HBsAg)一过性阳性,其母体多数并非乙型肝炎患者。因此,本研究从本院儿科住院部检测乙肝病毒标志物(HBV-M)的2 260例接种过乙肝疫苗的新生儿中,选取99例HBsAg阳性新生儿,通过病例对照及追踪监测,明确HBsAg阳性新生儿HBV感染状况并分析其阳性原因,为临床合理解释新生儿HBV-M结果提供理论依据,为正确选择HBV-M检测时间提供指导性建议。
1 资料与方法
1.1资料
1.1.1研究对象 选取2014年1月~2017年12月宁夏医科大学总医院儿科住院部检测HBV-M的2 260例接种过乙肝疫苗的新生儿,其中,男性1 335例、女性925例、年龄1~28 d。
1.1.2仪器及试剂 ROCHE COBAS E601电化学发光免疫分析仪及其配套试剂、校准品及质控品(罗氏公司);总胆红素检测使用奥森多VITROS5600全自动干式生化免疫分析仪及其配套试剂、校准品及质控品(中国奥森多医疗器械贸易有限公司)。
1.2方法 采集2 260例新生儿静脉血2~3 ml,检测HBV-M,HBsAg阳性者立即采用原管血清进行HBsAg定量复检,确认阳性者纳入观察组,阴性者纳入对照组,将观察组依据年龄分为1~7 d组、8~14 d组和15~28 d组,对照组依据临床诊断是否为高胆红素血症分为黄疸组和非黄疸组。知情同意后,观察组进行1~2周HBV-M追踪监测,收集所有新生儿的临床诊断、HBV-M及总胆红素(TBIL)检测结果,观察组患儿母亲的HBV感染资料,进行统计学分析。
1.3统计学处理 应用SPSS25.0软件统计分析。样本率比较采用χ2检验,平均值比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1观察组HBV-M特征、追踪监测结果及其母亲HBV感染状况 经HBsAg定量确认,观察组纳入99例,阳性率4.4%(99/2 260)。观察组HBV-M模式主要以单项HBsAg(+)为主,占比62.6%(62/99),其次为HBsAg(+)合并HBsAb(+),占比20.2%(20/99);1~7 d组新生儿阳性检出率最高,占比97.0(96/99);3例HBeAg阳性者(出生时均进行了乙肝疫苗联合乙肝高效价免疫球蛋白的标准免疫预防)其母亲为乙肝“大三阳”,其余患儿母亲HBsAg阴性,HBsAg定量测定值前者为3.84(0.5~11.5)U/ml,后者为0.11(0.06~0.24)U/ml,均为低值;追踪监测,第1周3例HBeAg阳性者HBV-M模式未变,67例HBsAg转阴,29例患儿测定值明显降低,并于第2周转阴20例、9例未检。观察组HBV-M的检出情况详见表1。
2.2观察组、黄疸组及非黄疸组总胆红素比较 观察组中新生儿高胆红素血症者为50例,占比50.5%。为排除新生儿黄疸引起HBsAg检测结果假阳性,比较观察组、黄疸组及非黄疸组总胆红素检测结果。观察组与黄疸组差异无统计学意义(P>0.05),与非黄疸组差异有统计学意义(P<0.05);黄疸组与非黄疸组差异有统计学意义(P<0.05),见表2。
表1 观察组HBV-M检测结果
Tab.1 Results of HBV-M in observation group
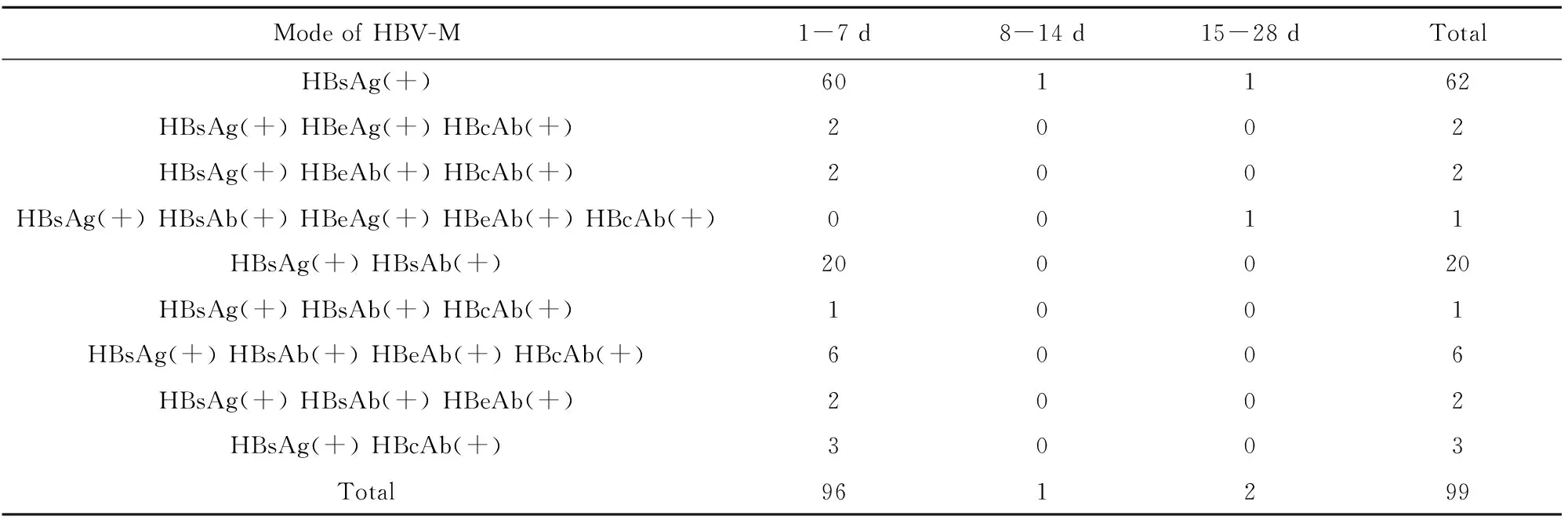
Mode of HBV-M1-7 d8-14 d15-28 dTotalHBsAg(+)601162HBsAg(+) HBeAg(+) HBcAb(+)2002HBsAg(+) HBeAb(+) HBcAb(+)2002HBsAg(+) HBsAb(+) HBeAg(+) HBeAb(+) HBcAb(+)0011HBsAg(+) HBsAb(+)200020HBsAg(+) HBsAb(+) HBcAb(+)1001HBsAg(+) HBsAb(+) HBeAb(+) HBcAb(+)6006HBsAg(+) HBsAb(+) HBeAb(+)2002HBsAg(+) HBcAb(+)3003Total961299
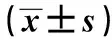
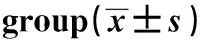

GroupsnTBIL(μmol/L)tPObservation50247.2±73.11.012>0.05Jaundice526264.2±68.75.113<0.05Non-Jaundice1 635166.9±71.39.723<0.05
表3 观察组与对照组HBsAb阳性率及其测定值比较
Tab.3 Comparison of HBsAb positive rate and results between observation group and control group

GroupsnPositive rate(%)χ2PResults(U/L)tPObservation9930.3(30/99)62.4<0.0555.1(12-1000)6.1<0.05Control2 16168.6(1 481/2 161)272.3(10-948)
2.3观察组与对照组间HBsAb检测结果比较 观察组HBsAb阳性率及其测定值均低于对照组,差异有统计学意义(P<0.05),见表3。
3 讨论
HBsAg是乙肝病毒的外壳蛋白,本身不具有传染性,但常伴随乙肝病毒存在,HBsAg阳性可表示HBV感染[2]。本研究观察组99例HBsAg阳性新生儿均经定量确认,定量检测HBsAg血清标志物可有效反映HBV DNA复制程度,HBV DNA载量是反映HBV感染的最直接指标,由此表明该组患儿可能感染HBV,母婴垂直传播为HBV感染的主要途径[3-5]。观察组仅3例患儿母亲为乙肝“大三阳”,其余患儿母亲均为HBsAg阴性,经1~2周追踪监测共计87例HBsAg(+)转阴,表明观察组87.9%(87/99)未感染HBV。鉴于观察组50.5%(50/99)为高胆红素血症患儿,为排除新生儿黄疸引起HBsAg检测结果假阳性,本研究比较观察组、黄疸组及非黄疸组间总胆红素检测结果,结果显示观察组与黄疸组差异无统计学意义(P>0.05),与非黄疸组差异有统计学意义(P<0.05)。HBsAg试剂说明书标明胆红素<684 μmol/L检测结果不受影响,而观察组总胆红素为(247.2±73.1)μmol/L,小于此截断值,由此可见新生儿黄疸对HBsAg检测结果无影响。
乙肝疫苗主要成分不含有病毒遗传物质HBsAg,不具有致病性,但保留了免疫原性,能够刺激机体产生保护性抗体[6]。新生儿接种乙肝疫苗后会发生HBsAg一过性阳性,主要发生于接种后0~7 d,以单项HBsAg(+)为主,同时伴有合并性HBsAb(+),HBsAg定量为低值水平[6-13]。本研究观察组1~7 d组新生儿HBsAg阳性检出率占97.0%(96/99),HBV-M模式主要以单项HBsAg(+)为主,占比62.6%(62/99),其次为HBsAg(+)合并HBsAb(+),占比20.2%(20/99),除3例HBeAg(+)者外,其余新生儿HBsAg定量测定为0.11(0.06~0.24)U/ml的低值水平,与文献报道一致。刘华等[7]将乙肝疫苗1∶600稀释后检测HBsAg为0.13 U/ml,与本研究观察组HBsAg定量浓度相似。鉴于87例HBsAg转阴新生儿均接种过乙肝疫苗,HBV-M特征与报道一致,HBsAg已通过定量确认,并除了母婴垂直传播及黄疸影响检测结果等因素,由此推测是接种乙肝疫苗即刻检测引起的HBsAg一过性阳性。
张楠[14]认为新生儿HBsAb阳性率及病毒滴度均与母亲HBsAb有关,对乙肝疫苗主动免疫具有负面效果。武巧珍[15]等也报道新生儿可通过胎盘获得母源性HBsAb,且这些HBsAb能有效中和HBsAg,保护新生儿免受HBV感染,但同时也抑制乙肝疫苗的接种效果。本研究中,观察组HBsAb阳性率及其测定值均低于对照组P<0.05,由此提示对照组HBsAg检测结果阴性是由于高浓度的母源性HBsAb中和了乙肝疫苗中HBsAg,而观察组因无HBsAb或浓度较低,无法中和或结合乙肝疫苗中HBsAg,导致阳性。
如果母源性HBsAb可以中和乙肝疫苗中的HBsAg,但观察组中出现的20例HBsAg合并HBsAb阳性、10例HBsAg、HBsAb合并其他乙肝标志物阳性的模式的原因未明确。文献报道S基因突变诱导机体产生的无效中和抗体不具备保护作用,试推测此类新生儿体内的母源性HBsAb可能为抗病毒变异株抗体,无法中和乙肝疫苗中的HBsAg,此推论有待进一步研究[16]。本研究不足之处在于3例HBeAg(+)及9例未完成追踪监测新生儿的HBV感染状况未明确,有待日后补充病例继续研究。
综上所述,HBsAg阳性多出现于1周龄内新生儿,多数经2周后转阴,表明并未感染HBV,为接种乙肝疫苗即刻检测所致。由此提示,新生儿检测HBV-M最好选择在接种乙肝疫苗2~3周后。

