中缅边境恶性疟原虫AMA1蛋白结构域Ⅱ的单倍体型和抗体应答相关性分析
洪明阳 于园超 周 丹 曹雅明 朱晓彤
(中国医科大学基础医学院免疫教研室,沈阳 110122)
2017年全球有219万疟疾病例,43.5万人死于疟疾感染[1]。裂殖子期原虫表面抗原诱导产生的抗体可阻断原虫侵袭红细胞,并促进宿主免疫系统的调理性吞噬和抗体依赖性细胞毒作用,从而抑制红内期原虫裂体增殖并阻断感染患者发病[2,3]。因此,红内期疫苗在预防发病和防治重症疟疾方面具有广泛的应用前景,而裂殖子期原虫抗原为理想的红内期疫苗靶位。
恶性疟原虫裂殖子顶端膜抗原1(Plasmodiumfalciparumapical membrane antigen 1,PfAMA1)位于微线体,在裂殖子侵袭红细胞前释放并介导侵袭过程[4,5]。PfAMA1蛋白诱导产生的抗体可阻断裂殖子体外侵袭宿主红细胞[6]。鼠和灵长类动物的疟疾模型研究显示,AMA1蛋白可诱导宿主产生种属特异性保护性抗体应答[7]。疟疾流行区患者体内常具有自然获得性AMA1抗体,且抗体水平与疟疾临床预防密切相关[8]。Ⅱ期临床实验显示,PfAMA1疫苗对非洲马里流行区1~6岁儿童的有效性为65%,提示其作为疫苗候选抗原的可行性[9]。然而,大样本分析显示,PfAMA1蛋白胞外区含60个多态性位点,在各流行区有200余种单倍体型[10,11]。红内期疟疾疫苗候选抗原的多态性会限制其广泛应用。因此,全面了解PfAMA1的抗原多样性和免疫应答特点可为开发和应用PfAMA1疫苗提供必要的理论依据。
PfAMA1蛋白胞外区包含DomainⅠ(DⅠ,149-302 aa)、DomainⅡ(DⅡ,320-418 aa)和DomainⅢ(DⅢ,443-509 aa)三个子结构域[12]。抗DⅠ和DⅡ的抗体可阻断裂殖子侵袭宿主红细胞[13,14]。DⅡ结构域具有相对保守的氨基酸序列,其内部环形区域中含有特异性抗原表位,可被抑制疟原虫入侵红细胞的4G2单克隆抗体识别[6]。上述结果提示以DⅡ区域作为红内期疫苗候选靶点的可行性。目前,尚无中缅边境恶性疟原虫流行区pfama1基因DⅡ结构域单倍体型和抗体应答特点的相关报道。本文通过对中缅边境地区恶性疟分离株pfama1基因的单倍体型进行分析,结合流行区患者血清的ELISA检测结果,查找流行区优势单倍体型和其诱导产生的抗体亚类,旨在为我国恶性疟红内期疫苗的研制和应用提供前期基础。
1 材料与方法
1.1材料 6~8周龄雌性BALB/c小鼠(北京实验动物研究所);Plasmodiumfalciparum3D7株和基因组DNA(gDNA)由本教研室保存。pET32a载体(Millipore,USA),Rosetta(DE)Competent Cell、TaKaRa MiniBEST Universal Genomic DNA Extraction kit、TaKaRa MiniBEST Agarose Gel DNA Extraction kit(TaKaRa);KOD-Plus Neo (ToYoBo);限制性内切酶NotⅠ和BamHⅠ(NEB);Infusion连接酶(Vazyme),LB broth(Gibco),快速质粒小提试剂盒(TIANGEN);HisPurTMNi-NTA Magnetic Beads(ThermoFisher);Protein A(Sigma);Goat anti-Mouse IgG(H+L)、mouse anti-his tag mAb(Abcam);Secondary Antibody HRP conjugated、PierceTMECL Plus Western blot Substrate、96孔板(ThermoFisher);Due Set ELISA试剂盒(R&D);辣根过氧化物酶结合的抗人IgG/IgG1/IgG2a/IgG3/IgG4抗体(Chemicon)。
1.2方法
1.2.1样本采集和基因组DNA提取 2013~2015年,于中缅边境地区采集30例恶性疟原虫感染患者指尖血制备血样干滤纸片,另外收集123例恶性疟原虫感染患者血清样本及非疟疾流行区43例正常人血清样本。TaKaRa MiniBEST Universal Genomic DNA Extraction试剂盒提取血样干滤纸片gDNA。
1.2.2pfama1基因DⅡ区域的PCR扩增和测序 采用引物pfama1_DⅡF (5′-GAATGTAGTTGATAAC-TGGG-3′)和pfama1_DⅡR(5′-GCTCTTTTTTCTT-CCCCCC-3′) 扩增pfama1基因(PlasmoDB ID:PF3D7_1133400)的DⅡ结构域。反应体系:10×KOD-Plus Neo 缓冲液1 μl,2 mmol/L dNTPs 1 μl,25 mmol/L MgSO40.8 μl,10 μmol/L 引物各 0.25 μl,KOD-Plus Neo 0.2单位,基因组DNA 模板1.0 μl。反应条件:95℃变性5 min;95℃变性15 s,56℃退火15 s,68℃ 延伸60 s,44个循环;68℃延伸5 min。PCR产物经TaKaRa MiniBEST Agarose Gel DNA Extraction试剂盒纯化后,送华大基因公司测序。
1.2.3DⅡ重组蛋白表达和免疫血清制备 采用PfAMA1-DⅡ-BamHⅠ F(5′-cgcggatccTGTGAAG-ATATACCACATGTAAATG-3′)和PfAMA1-DⅡ-NotⅠ R(5′-ttttccttttgcggccgcATCTAACATTTCATCATTT-CTTGAATTTG-3′)引物扩增pfama1基因DⅡ区域。纯化PCR产物后,采用Infusion连接酶连接入BamHⅠ和NotⅠ酶切线性化的pET32a(+)载体,构建pET32a(+)-PfAMA1-DⅡ表达载体,转化入Rosetta(DE)Competent Cell宿主菌,质粒小提并测序鉴定。
PfAMA1-DⅡ重组蛋白(rPfAMA1-DⅡ)经1 mmol/L IPTG 20℃过夜诱导表达。HisPurTMNi-NTA Magnetic Beads纯化后,采用10%的SDS-PAGE电泳分离。半干法转膜,5%脱脂奶粉封闭,TBS-T漂洗后,采用抗his标签抗体(1∶2 000)标记和HRP标记的山羊抗小鼠IgG抗体分别标记一抗和二抗。ECL发光方法检测。
6~8周龄BALB/c小鼠,隔周皮下免疫50 μg rPfAMA1-DⅡ重组蛋白(首次免疫采用完全弗氏佐剂,二次和三次免疫采用不完全弗氏佐剂)制备多克隆抗体。3次免疫后第10天收集小鼠血清,采用Protein A纯化。Western blot方法检测抗PfAMAI-DⅡ免疫血清的特异性。采用ELISA法检测血清中抗体滴度。
1.2.4恶性疟原虫体外裂殖子侵袭抑制实验 常规方法体外培养恶性疟原虫[15],并采用40% 和70% percoll分离液提取晚期成熟的裂殖体期原虫,调整培养体系中原虫血症为1%后置于24孔板中培养(红细胞压积2.5%,总体系2 ml)。在对照组(NC)和免疫组(DⅡ)中分别加入正常小鼠IgG抗体和抗PfAMA1-DⅡ纯化后的免疫血清,浓度梯度:1.5 mg/ml,0.75 mg/ml 和0.31 mg/ml。各实验组每个浓度梯度设3个复孔。培养10 h后,姬姆萨染色计数原虫血症(P)。裂殖子侵袭抑制率=100-(DⅡ组原虫血症均值/NC组原虫血症均值)× 100%。
1.2.5序列比对和单倍体型分析 以3D7株为参照,MEGA7.0软件分析30例中缅边境样本pfama1基因DⅡ区域序列[16]。DnaSP v6软件计算单倍型(number of haplotypes,H)和单倍型多样度(haplotype diversity,Hd)[17]。
1.2.6抗体及其亚类的ELISA检测 采用酶联免疫吸附试验检测总IgG及IgG1、IgG2、IgG3和IgG4。0.5 μg/孔PfAMA1-DⅡ重组蛋白包被96孔板,4℃过夜。1%牛血清白蛋白(BSA)封闭2 h后,采用含0.5% Tween-20的PBS缓冲液(0.5% Tween-20/PBS)洗涤5次。每孔加入100 μl稀释血清(总IgG,1∶200倍稀释血清;IgG各亚类,1∶50倍稀释血清),37℃下孵育2 h后,采用0.5% Tween-20/PBS洗涤5次,100 μl/孔HRP结合的抗人IgG 和各亚类二抗(1∶4 000)37℃ 孵育2 h,0.5% Tween-20/PBS洗板5次后,加入50 μl/孔底物(KPL,USA)避光反应5 min,2 mol/L硫酸终止反应。492 nm处读取吸光度。负截止值定义为阴性对照样品的平均值加上阴性对照样本的两倍标准差。抗体水平高于负截止值被认为是阳性。
1.3统计学处理 采用Graph Pad Prism 6.0软件和SPSS16.0软件进行统计学分析。ELISA抗体滴度组间差异采用Student′st检验。IgG和其亚类的组间差异采用单向非参数Kruskal-Wallis检验。抗体水平与单倍体型间相关性分析采用Spearman相关检验。P<0.05表示差异具有统计学意义。
2 结果
2.1PfAMA1-DⅡ重组蛋白表达情况和免疫血清检测 本研究中成功构建了pET32a (+)-PfAMA1-DⅡ 原核表达载体,采用1 mmol/L IPTG过夜诱导后,SDS-PAGE电泳分析可见大量可溶性PfAMA1-DⅡ重组蛋白(rPfAMA1-DⅡ,~74.8 kD)的表达(图1A)。使用HisPurTMNi-NTA柱纯化重组蛋白,并对洗脱及透析后的样品进行Western blot 检测,可清晰看到目标蛋白条带约74.8 kD(图1A)。检测其蛋白纯度>80%,调整浓度为1.5 mg/ml(图1A)。Western blot实验显示,rPfAMA1-DⅡ重组蛋白免疫小鼠后提纯获得的免疫血清(3 mg/ml)可检测到rPfAMA1-DⅡ(图1B)。ELISA实验显示,抗-PfAMA1-DⅡ免疫血清抗体滴度为1∶6 400(图1C)。
2.2恶性疟原虫裂殖子侵袭抑制实验 与正常鼠IgG处理组相比,抗PfAMA1-DⅡ抗体可显著抑制恶性疟原虫裂殖子侵袭宿主红细胞,其抑制作用呈剂量依赖性。当抗PfAMA1-DⅡ抗体量达到2 mg/ml时,抑制率>85%,提示抗PfAMA1-DⅡ结构域的抗体对宿主具有保护性作用(表1)。
2.3中缅边境流行区pfama1-DⅡ区域单倍体型多样性和单倍体型频率分析 本研究成功扩增了30例恶性疟原虫分离株pfama1基因的D Ⅱ 区域297 bp 长度片段。30例恶性疟原虫分离株PfAMA1基因D Ⅱ 分属 9个单倍体型(H),单倍型多样度(Hd)为0.88,H4为优势单倍体型,频率为26.7%(表2)。
2.4中缅边境流行区123例恶性疟原虫感染患者血清样本信息 2013~2015年于中缅边境地区采集123例恶性疟原虫感染患者血清样本。患者年龄1~71岁(中位年龄24岁),15岁以上的病例样本约为84.55%,75.61%为男性患者(表3)。86.18%的患者有发热症状(腋窝温度>37.5℃),75.3%的患者在发热后3 d内有抗疟药物治疗史,7.32%的患者有重症疟疾临床症状(表3)。患者的无性期原虫密度均值9 860 μl-1(表3)。

图1 PfAMA1-DⅡ重组蛋白表达情况和免疫原性检测Fig.1 Expression of recombinant PfAMA1-DⅡ protein and detection of its immunogenicityNote: A.Detection of recombinant PfAMA1-DⅡ protein expression.The left panel shows the coomassie brilliant blue staining result of recombinant PfAMA1-DⅡ protein.The right panel shows the Western blot results of recombinant PfAMA1-DⅡ protein.Probed with anti-His tag mAb (1∶2 000 dilutions);B.Western blot detection of the specificity of anti-PfAMA1-DⅡ sera;C.ELISA assay for antibody titer detection of anti-PfAMA1-DⅡ serum.Arrows indicate recombinant PfAMA1-DⅡ proteins,~74.8 kD.**.P<0.01;***.P<0.001.
表1 抗-PfAMA1-DⅡ抑制裂殖子侵袭能力检测
Tab.1 Analysis of anti-PfAMA1-DⅡ inhibition ability of merozoite invasion
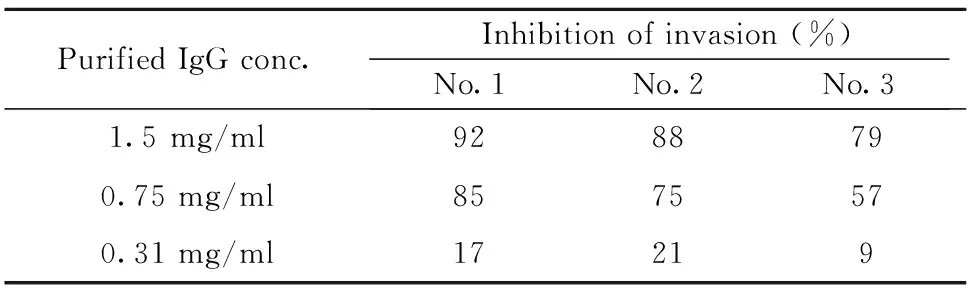
Purified IgG conc.Inhibition of invasion (%)No.1No.2No.31.5 mg/ml9288790.75 mg/ml8575570.31 mg/ml17219
表2 中缅边境地区30例恶性疟原虫分离株pfama1基因单倍体型频率分析
Tab.2 Haplotype frequency ofPlasmodiumfalciparumin 30pfama1 isolates from China-Myanmar border area

HaplotypeNo.of sequencesFrequency (%)H1413.3H2310.0H3310.0H4826.7H5413.3H626.7H713.3H8413.3H913.3
表3 中缅边境地区恶性疟原虫急性感染病例(n=123)
Tab.3 Description of acute infection cases withPlasmodiumfalciparumin China-Myanmar border areas (n=123)
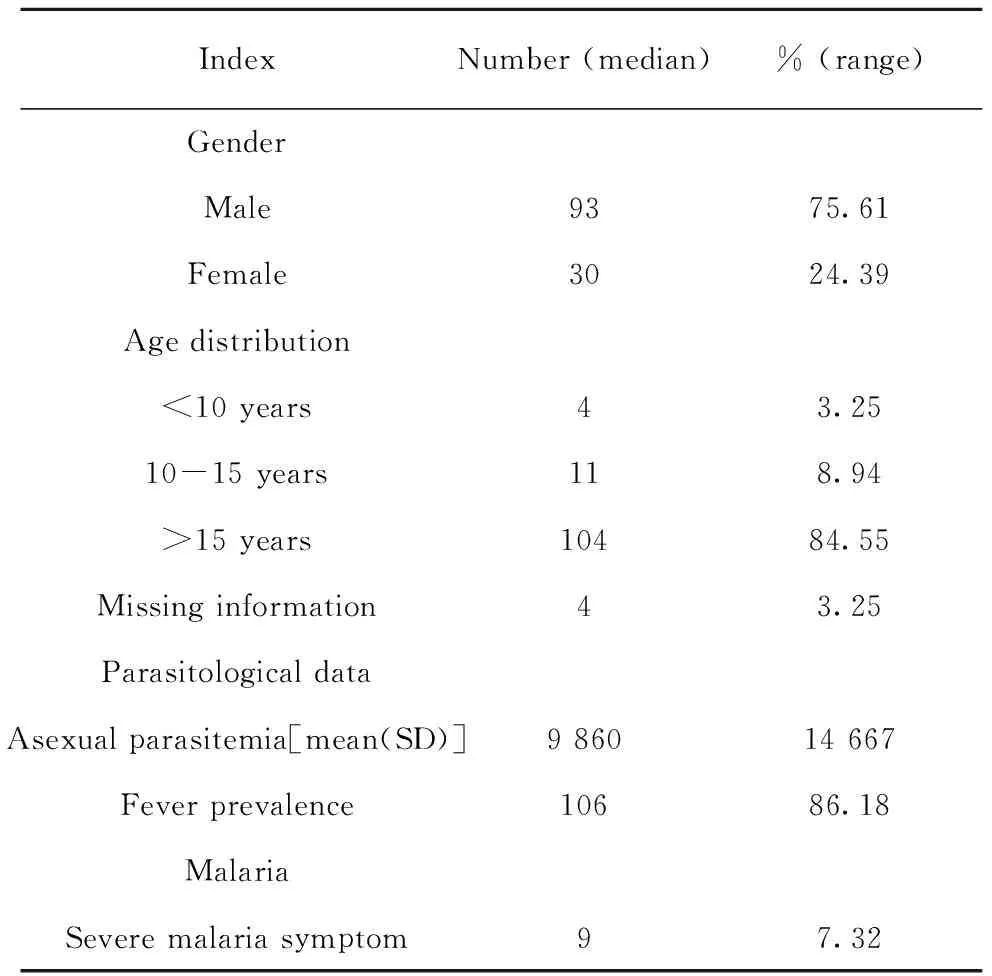
IndexNumber (median)% (range)GenderMale 9375.61Female 3024.39Age distribution<10 years43.2510-15 years118.94>15 years10484.55 Missing information43.25Parasitological dataAsexual parasitemia[mean(SD)]9 86014 667Fever prevalence10686.18MalariaSevere malaria symptom97.32
2.5IgG及其亚类的ELISA检测结果和单倍体型相关性分析 本研究检测了123例恶性疟原虫感染患者血清样本对PfAMA1-DⅡ蛋白的IgG抗体及其亚类产生水平。与正常对照组相比,45.1%(55/122)的恶性疟原虫患者血清中含有高水平抗PfAMA1-DⅡ的IgG抗体产生,提示恶性疟原虫感染患者体内可产生抗PfAMA1抗体(P<0.000 1,图2A)。IgG抗体亚类分析显示,58.82%(60/102)的患者血清中IgG1抗体反应为阳性,27.4%(34/124)
表4 中缅边境地区H4和H5单倍体型产生的抗体反应比较
Tab.4 Antibody response between H4 and H5 in China-Mynamar border isolates
Note:1)P<0.01.
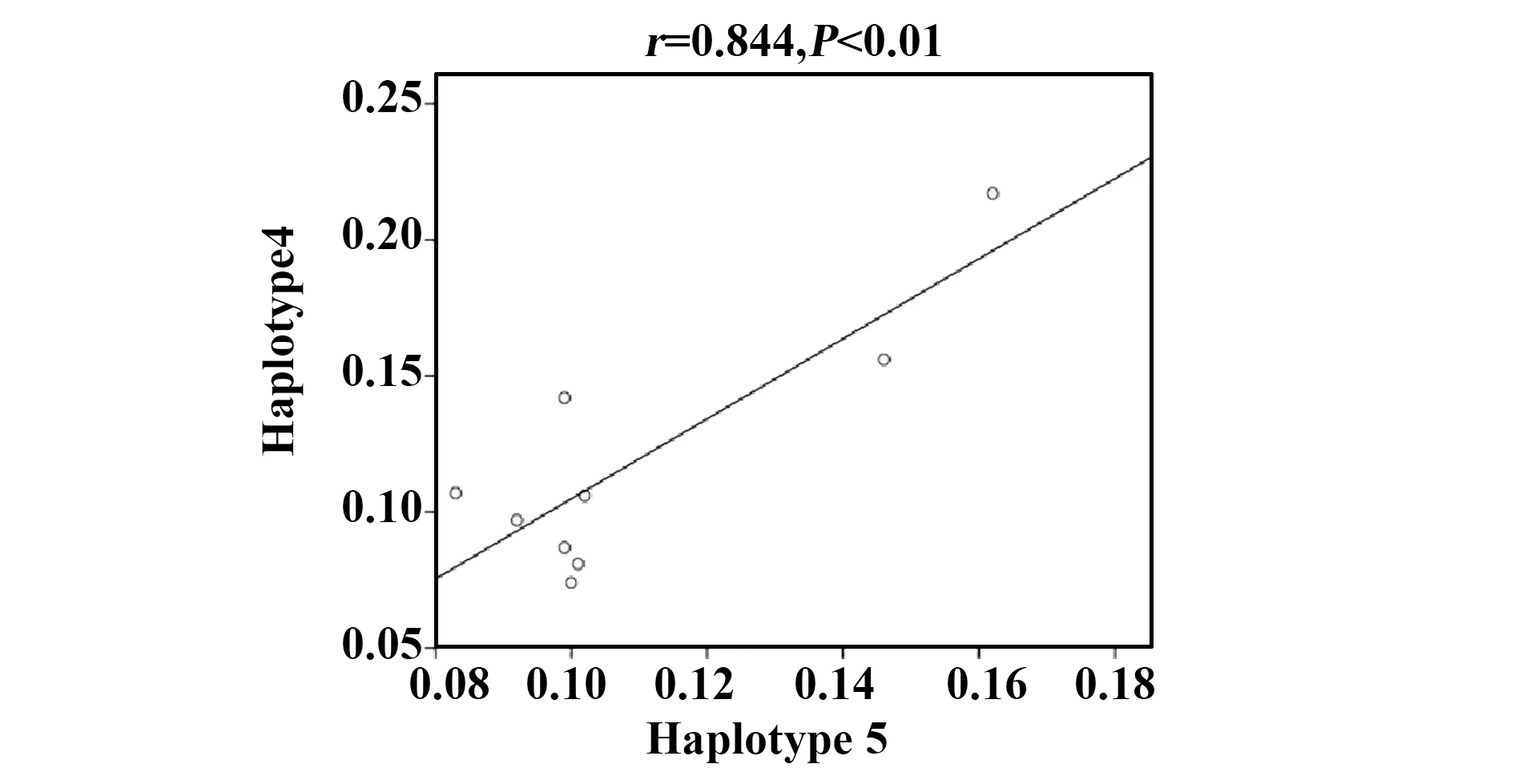
图3 中缅边境地区PfAMA1-DⅡ抗原H4和H5单倍体型产生IgG4抗体水平的相关性分析Fig.3 Correlation of IgG4 antibody response to H4 and H5 of PfAMA1-DⅡ antigen in China-Myanmar border area
的患者血清中IgG2抗体反应为阳性, 38.5%(47/122)的患者血清中IgG3抗体反应为阳性,27.1%(33/122)的患者血清中IgG4抗体反应为阳性(图2B~E)。上述结果提示,中缅边境流行区恶性疟感染患者血清中对PfAMA1-DⅡ的抗体反应以IgG1和IgG3抗体亚类为主。此外,在22份具有基因组DNA样本的阳性血清样本中,检测到4种不同的单倍型(H1、H4、H5和H8的频率分别为1.9%、75.0%、19.2%和3.8%)。中缅边境人群血清中抗PfAMA1蛋白的IgG1和IgG3抗体反应对两个主要单倍型H4和H5差异具有统计学意义(表4)。其中,恶性疟原虫感染患者体内IgG4抗体水平与H4和H5单倍体型显著相关(r=0.844,P<0.01,图3)。
3 讨论
中国正处于消灭疟疾的边缘时期,但边境地区人口流动所致疟疾再传播,非洲和东南亚输入性疟疾的威胁均使卫生部于2020年在全国范围内消灭疟疾的计划面临严峻挑战[18]。目前广泛研究的红内期疟疾疫苗候选抗原均具有多态性,限制了上述抗原制备的疫苗在不同流行区间广泛应用。了解疟疾疫苗候选抗原的多态性及其与抗疟保护性免疫应答之间的关联,可为疟疾疫苗的研制提供理论依据。
恶性疟原虫裂殖子抗原产生的自然获得性抗体在流行区宿主抵御疟疾感染中发挥重要作用[19]。在疟疾低密度流行区患者体内检测到高水平的抗裂殖子蛋白抗体,提示裂殖子抗原具有良好的免疫原性[19]。与前期研究结果一致,在疟疾低密度流行的中缅边境地区,于45.1%的患者血清中检测到抗PfAMA1的IgG抗体。此普遍存在于疟疾感染患者体内的抗体反应可能是由前次感染后存留的抗原特异性记忆B细胞被激活所致[20]。同时,多项研究发现疟疾流行区患者血清中抗AMA1的IgG1和IgG3抗体水平随年龄增长逐渐升高,且与疟疾发病率下降相关,提示调理性抗体在预防临床疟疾中的重要保护作用[21,22]。有研究报道抗裂殖子抗原MSP3和GLURP R2的IgG2和IgG4抗体产生可预防重症临床疟疾发生[23]。但PfAMA1蛋白诱导产生的IgG2和IgG4抗体在宿主抵抗疟疾感染中的作用尚存在争议。有研究提示,由于缺乏激活细胞毒性细胞的能力,患者体内抗AMA1的IgG2和IgG4抗体水平与阻断疟疾感染后的保护性免疫机制相关[24]。另有研究表明,IgG2和IgG4抗体与降低疟疾发病率相关[25]。本研究结果显示,PfAMA1蛋白DⅡ抗体可体外阻断裂殖子侵袭宿主红细胞,且中缅边境流行区患者体内产生的抗PfAMA1-DⅡ抗体以IgG1和IgG3为主,提示以PfAMA1-DⅡ抗原制备红内期疫苗可诱导患者体内保护性免疫应答。
早期研究显示AMA1所诱导的保护性作用是单倍体型特异性的,但由于对AMA1单倍体型多样性尚缺乏广泛性的研究,现有的AMA1疫苗都是基于恶性疟原虫标准株3D7和/或FVO株AMA1序列,从而限制了AMA1疫苗的地域性应用价值[26,27]。前期对中缅边境疟疾流行区pfama1基因的多态性分析显示,中缅边境流行区样本中无3D7株相同基因型,且与FVO株相同的单倍体型仅占流行区总单倍体型的5%[19]。本研究中检测到的优势单倍体型H4(频率:26.7%)与2011至2012年间普查检测到的优势单倍体型H3基因序列一致,提示同一单倍体型仍广泛流行于中缅边境流行区[28]。联合同一流行区患者血清学结果分析显示,H1(频率:1.9%)、H4(75.0%)、H5(19.2%)和H8(3.8%)感染的恶性疟原虫患者血清中抗体可与3D7型PfAMA1-DⅡ重组蛋白发生交叉反应,提示3D7型AMA1疫苗在中缅边境流行区具有部分保护性效果。此外,本研究发现单倍体型H4和H5诱导宿主保护性免疫应答能力差异有统计学意义(P<0.01),且IgG4抗体产生水平与H4和H5单倍体型显著相关。鉴于H4为中缅边境流行区优势单倍体型,可诱导IgG1和IgG3为主导的保护性免疫应答,上述结果提示以H4作为中缅边境地区恶性疟原虫红内期潜在的疫苗候选有可能性。
综上,本研究发现PfAMA1-DⅡ区域具有强免疫原性,其诱导产生的保护性抗体以调理性抗体IgG1和IgG3为主。且研究发现患者体内的保护性抗体与3D7型PfAMA1-DⅡ重组蛋白具有交叉反应,提示以3D7株为背景的PfAMA1疫苗在中缅边境流行区具有保护性效果。同时,研究显示H4可诱导产生IgG抗体及其亚类,提示以此单倍体型制备PfAMA1红内期疫苗在中缅边境流行区可能获得良好的保护性效果。然而,中缅边境地区AMA1抗原的单倍型多样性,各单倍体型与IgG抗体亚类产生水平间的相关性及各IgG抗体亚类对恶性疟原虫生长抑制的作用效果仍需大样本广泛研究,从而进行综合评价。

