染料木素对乳腺癌细胞睾丸特异性蛋白酶50表达的影响①
冯 磊 李 响 孟繁平 李 妍
(延边大学医学院免疫学与病原微生物学教研室,延吉 133002)
乳腺癌作为女性发病率最高的肿瘤,严重危害女性健康[1]。亚洲人广泛摄取雌激素结构类似物,即植物性雌激素的豆科植物及中药材,染料木素(genistein,Gen)等植物性雌激素的日常饮食摄入是否可促进乳腺癌细胞生长尚存争议[2-4]。睾丸特异性蛋白酶50(testes-specific protease 50,TSP50)是近年发现的促癌基因,与乳腺癌复发密切相关[5]。约70%乳腺癌为雌激素受体阳性型(ER+),内源或外源雌激素对癌细胞有生长促进作用[6]。本研究通过探讨不同浓度Gen对人乳腺癌细胞中TSP50表达的影响,阐明植物性雌激素对乳腺癌细胞增殖的影响,为揭示TSP50在雌激素非基因组中的效应提供研究依据。
1 材料与方法
1.1材料 人乳腺癌细胞株MCF-7和MDA-MB-231购自中南大学湘雅医学院;1640培养液、马血清购自美国Gibco公司;DMEM/F12培养基购自美国Hyclone公司;胎牛血清购自美国Corning公司;TSP50兔抗人免疫组化抗体购自美国Novus公司;通用型二抗购自北京中杉金桥公司;垂直板电泳槽购自美国伯乐公司;流式细胞仪购自美国贝克曼公司;酶标仪购自北京普天公司。
1.2方法
1.2.1细胞培养 复苏MCF-7细胞接种于10% 1640培养液的培养瓶中,置于37℃、5%CO2增殖培养,培养瓶中细胞生长超过80%时,胰酶消化传代至达到实验所需细胞量。
1.2.2MTT还原实验 取对数期MCF-7细胞铺于96孔板给药,24 h后取上清,加入新的含血清培养基200 ml/孔,按1∶10加入MTT试剂,37℃培养。4 h后终止培养,每孔加入200 μl DMSO溶解甲臢结晶,37℃温育10 min,将结晶溶解后的液体分装于96孔酶标板内,每份设置3个复孔,200 μl/孔,酶标仪490 nm 处检测各孔吸光度值,取3次试验平均值。
1.2.3细胞周期检测 固定好的细胞液1 000 r/min离心5 min;冷PBS洗涤细胞团块2次, PI染液悬起洗涤过的细胞团块,300目尼龙网过滤,转入流式管,避光染色30 min,检测并分析细胞周期。
1.2.4免疫荧光染色检测膜分子 直接免疫荧光法检测膜分子CD24、CD44和CD326表达,稀释荧光抗体,加入1×106个细胞中,悬起细胞,避光染色。30 min后PBS洗涤2次,转入流式管检测。以膜分子表达阳性细胞的百分率或细胞膜上该分子表达的荧光强度代表实验结果。
1.2.5免疫印迹分析乳腺癌细胞TSP50表达 取25 μl蛋白样品进行聚丙烯酰胺凝胶电泳,移至PVDF膜,封闭液室温封闭2 h,加一抗兔抗小鼠 MMP-2 或β-actin 抗体,4℃孵育过夜;TBS-T洗3次,每次10 min,加入山羊抗兔二抗室温孵育1 h,TBS-T洗3次,每次10 min;ECL化学发光试剂显影,Image One软件定量分析。
1.2.6免疫组化 取对数生长期细胞MCF-7和MDA-MB-231,接种于24孔板,培养板底面积细胞覆盖至60%~70%时,收集细胞爬片,经固定、脱水、染色、封片、拍照后镜下观察产生棕色沉淀为阳性。
2 结果
2.1免疫组化法观察乳腺癌细胞中TSP50表达情况 免疫组化镜下观察细胞内产生棕色沉淀为阳性,结果显示2种乳腺癌细胞中TSP50表达均呈阳性,见图1。
2.2免疫印迹法测量2种乳腺癌细胞TSP50、MMP-2表达情况 结果显示,TSP50和MMP-2在MCF-7和MDA-MB-231细胞中均表达,MDA-MB-231细胞中较高。因此MDA-MB-231为转移和侵袭能力高的乳腺癌细胞,见图2。
2.3免疫组化观察增殖乳腺癌细胞TSP50表达情况 与正常乳腺癌细胞相比,处于分裂增殖期的乳腺癌细胞TSP50着色加深,见图3,TSP50表达增强,MCF-7细胞TSP50表达最强。
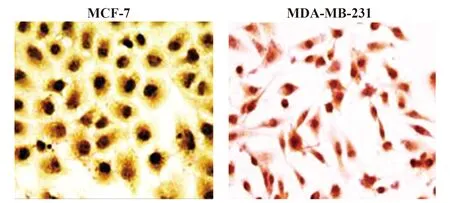
图1 乳腺癌细胞中TSP50表达情况(×400) Fig.1 Expression of TSP50 on breast cancer cell lines(×400)
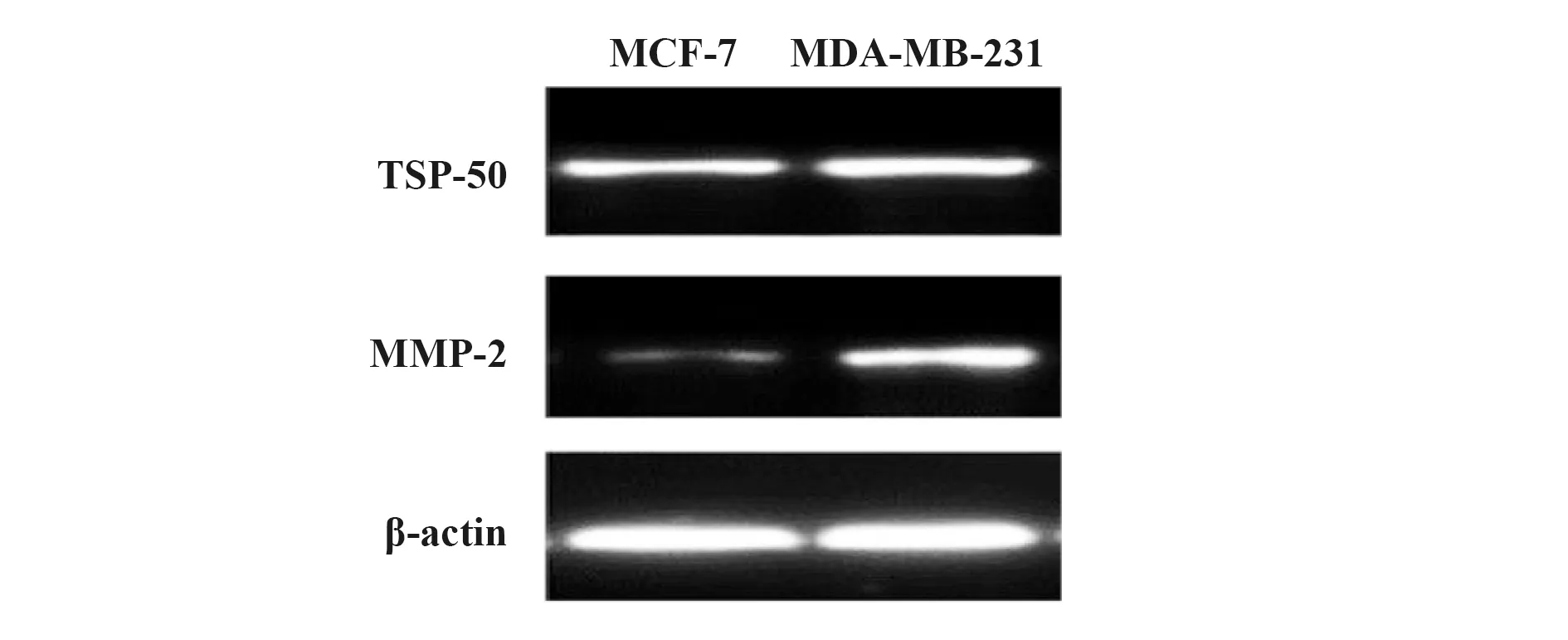
图2 乳腺癌细胞中TSP50和MMP-2表达Fig.2 TSP50 and MMP-2 expression on breast cancer cell lines

图3 分裂增殖的乳腺癌细胞TSP50表达(×400)Fig.3 Expression of TSP50 in proliferative breast cancer cells(×400)

图4 Gen对乳腺癌细胞生长的影响Fig.4 Effect of Gen on growth of breast cancer cell linesNote:Compared with control,*.P<0.05,**.P<0.05.

图5 Gen对MCF-7细胞周期的影响Fig.5 Effect of Gen on cell cycle in MCF-7 breast cancer cells

图6 Gen对MDA-MB-231细胞周期的影响Fig.6 Effect of Gen on cell cycle in MDA-MB-231 breast cancer cells
2.4MTT还原法检测不同浓度Gen对乳腺癌细胞生长的影响 2.5~10 μmol/L Gen促进乳腺癌细胞生长,25~100 μmol/L Gen对乳腺癌生长呈抑制作用。Gen对MCF-7细胞20%生长促进的浓度为5~10 μmol/L,20%生长抑制浓度为12.5~25 μmol/L,而50%生长抑制浓度为50~100 μmol/L,见图4。
2.5流式细胞术检测Gen对乳腺癌细胞周期的影响 与对照组相比,5 μmol/L Gen 导致MCF-7细胞S期和G2M期细胞增加;25 μmol/L Gen 导致MCF-7细胞G2M期细胞增加;而100 μmol/L Gen处理后,G0G1期细胞增加,而S期和G2M期细胞减少;与对照组相比,100 μmol/L Gen导致MDA-MB-231细胞G0G1期细胞百分率提高,5 μmol/L和25 μmol/L Gen对细胞周期无明显影响,见图5、6。

图7 Gen对MDA-MB-231细胞凋亡的影响Fig.7 Effect of Gen on apoptosis in MDA-MB-231 breast cancer cells
2.6双染法检测Gen对乳腺癌细胞凋亡的影响 当浓度≥25 μmol/L时,Gen对乳腺癌及乳腺上皮细胞生长增殖的抑制作用明显,因此采用双染法检测细胞凋亡情况。结果表明,MCF-7和MDA-MB-231细胞在25 μmol/L Gen诱导后活细胞百分率差异无统计学意义,见图7。
3 讨论
流行病学调查显示,乳腺癌的发病年龄持续降低,成为“最年轻”的癌症[7]。本研究发现,不同浓度的Gen对受体分布不同的乳腺癌细胞产生的效应不同,低浓度(≤10 μmol/L)Gen促进乳腺癌细胞增殖,高浓度Gen抑制乳腺癌细胞增殖,与文献[8]结论相同。细胞周期结果显示,Gen对MCF-7的细胞周期具有推进作用。Lucki等[9]发现这种效应可能由酸性神经鞘氨醇酶基因(acid ceramidase,ASAH1)转录增加所导致,体外试验证实低剂量(≤10 μmol/L)Gen作用下的MCF-7细胞增殖更迅速,尤其是培养体系中不存在雌激素时促进作用更加明显。
Gen摄入对于ER+乳腺癌患者可能是不容忽视的危险因素。原花青素是一类广泛存在于自然界的植物多酚,在水果、红酒中大量存在,作为抗炎、抗肿瘤成分存在于日常饮食,可通过上调Caspase途径诱导乳腺癌MCF-7细胞凋亡,通过促进FoxA1表达,诱导三阴性乳腺癌MDA-MB-231细胞凋亡,逆转耐药细胞株MCF-7/ADR的耐药性[10]。在结肠癌、肝癌细胞中原花青素可通过PI3K/Akt途径抑制肿瘤细胞增殖和促进凋亡。PB1是二聚体形式的原花青素亚型,Karabulut等[11]发现,PB1的抗炎作用主要通过下调MAPK通路及NF-κB通路的活性实现。Gen与PB1联合作用实验表明,PB1可下调受低浓度Gen刺激的MCF-7细胞中TSP50表达量,并且相关膜分子及细胞增殖实验的结果也呈现相似抑制作用,可能通过MEK-Erk信号通路实现[12]。
MMP-2是基质金属蛋白酶的成员,具有降解细胞外基质,促进肿瘤增生和转移等作用,被认为是恶性肿瘤细胞侵袭和转移的标志之一[13],使用其上游分子MEK1/2抑制剂U0126对MZK-Erk信号通路进行阻断,可观察到该促进作用消失甚至逆转,表明MEK-Erk信号通路可能是Gen促进MCF-7细胞增殖与转移的重要路径,NF-κB激活后可使肿瘤细胞无限制的增殖,利用基因敲除技术证明TSP50升高与NF-κB活化密切相关,而NF-κB也是MEK-Erk信号通路的下游分子之一,说明Gen可能通过该信号通路活化促进细胞增殖和转移[14,15]。本研究中,Gen对TSP50的促进作用与Erk1/2磷酸化水平增加密切相关。
综上所述,高剂量的Gen可抑制乳腺癌细胞的增殖,低浓度(≤10 μmol/L)的Gen可通过MEK/Erk信号通路上调乳腺癌细胞TSP50蛋白的表达,又能使乳腺癌干细胞表型特性分子增加,起到促进乳腺癌细胞增殖的作用;基于我国大众饮食习惯,Gen等植物性雌激素对人体健康的影响应得到重视,尤其是对未成年人和绝经期妇女的潜在风险。

