敲减CDKL5对人胶质母细胞瘤细胞表观遗传学的影响①
张惊宇 郑永慧 初婷婷
(黑龙江省医学科学院,哈尔滨 150081)
近期有研究发现CDKL5敲除鼠的运动协调性差、少动、视力差,惊厥处理时脑电图异常,视觉诱发反应下调,这与雷特综合征和自闭症的表型相似[1]。敲除鼠的神经干细胞增殖更快,新生颗粒神经元凋亡水平更高,导致分化的成熟神经元减少,树突严重萎缩,皮层更薄[2]。敲除CDKL5虽然抑制神经元的分化,却不影响胶质细胞的分化[3]。敲除鼠脑中Akt、AMPK、PKC和MAKP信号通路受到影响,其中主要抑制Akt及下游mTOR、RSK和GSK-3β的磷酸化。抑制GSK-3β的活性可改善CDKL5敲除的神经干细胞向神经元分化的缺陷[4]。此外,在成纤维细胞中,CDKL5通过调控剪切调控蛋白的磷酸化状态来控制核小斑的形态,核小斑能持续为活性转录位点提供剪切因子,且确定CDKL5影响选择性剪切[5]。CDKL5还调控基因表达。在CDKL5突变的诱导型多能干细胞中,GluD1(glutamate D1 receptor)的表达下调。GluD1能诱导皮层神经元的抑制性突触前分化,与神经疾病有关。 CDKL5的表达受到表观遗传学调控。神经系统中(脑纹状体和前扣带皮层、PC12细胞)MeCP2和DNA甲基转移酶都抑制CDKL5的表达[6,7],而MeCP2和Dnmt1正是CDKL5的激酶底物[8]。
1 材料与方法
1.1材料 细胞培养板购自美国corning公司;所有培养基及添加剂均购自美国Gibco公司;BCA蛋白定量试剂盒购自碧云天公司;载体pLKD-UBC-GFP-U6-shRNA购自纽恩生物科技公司;CDKL5(ab22453)购自Abcam公司;GAPDH购自Sigma-Aldrich公司;Dnmt1购自Cayman公司。
1.2方法
1.2.1细胞培养 人胶质母细胞瘤细胞系U87添加1%非必需氨基酸和1%(1 mmol/L)丙酮酸钠;所有细胞均置于37℃恒温培养箱中培养,CO2浓度5%。
1.2.2质粒构建 构建CDKL5 shRNA所用的载体为pLKD-UBC-GFP-U6-shRNA。实验涉及的shRNA序列为shCDKL5 R:5′-CCGGAGTGAGAGCTAAAG-GCATTTTCAAG-3′,F:5′-AGAAATGCCTTTAGCTCTCACTTTTTTTG-3′。干扰质粒和融合质粒委托纽恩生物技术公司包装制成慢病毒颗粒浓缩液。
1.2.3mRNA提取和qPCR检测 RNAiso试剂裂解U87细胞,氯仿抽提总RNA溶于无酶水(无DNA酶、无RNA酶)中,利用反转录试剂盒将RNA反转录为cDNA进行PCR。检测的MeCP2,Dnmt1,GAPDH q-PCR引物序列来源于NCBI。
1.2.4蛋白免疫印迹 分别提取细胞蛋白和组织蛋白,BCA定量后进行蛋白免疫印迹检测,上样量为(45 μg/孔)。蛋白质经SDS-聚丙烯酰胺凝胶电泳分离后转移到硝酸纤维素膜(NC膜)上(200 mA电流,室温转膜2 h),用含5%脱脂奶粉的TBS-T室温封闭2 h,将稀释后的一抗稀释液敷于膜上,4℃过夜。清洗一抗后,1∶1 000加入辣根过氧化物酶标记的抗鼠二抗,室温孵育1 h,清洗二抗后,用ECL化学发光反应进行显色。
1.3统计学处理 SPSS18.0软件进行统计学处理,t检验分析组间差异。P<0.05表示差异有统计学意义。
2 结果
2.1CDKL5在人胶质母细胞瘤细胞系U87中的表达情况 结果显示,CDKL5在人胶质母细胞瘤细胞U87中高表达,通过shRNA敲减CDKL5后,其表达量显著降低,表明敲减是有效的,为后续实验提供基础(图1)。
2.2敲减CDKL5引起表观遗传标记物表达的改变 由于组蛋白修饰所调控的表观遗传学对于神经干细胞的分化具有重要作用,本研究检测了胶质母细胞瘤细胞中组蛋白H3的修饰情况。结果显示,敲减CDKL5引起mRNA(图2A)和蛋白(图2B)水平上的表观遗传因子Dnmt1的下调和MeCP2的上调。以上结果表明,CDKL5有助于维持胶质母细胞瘤细胞中的表观遗传学特征。

图1 CDKL5在人胶质母细胞瘤细胞系U87中的表达Fig.1 CDKL5 protein expression in U87 cell lines
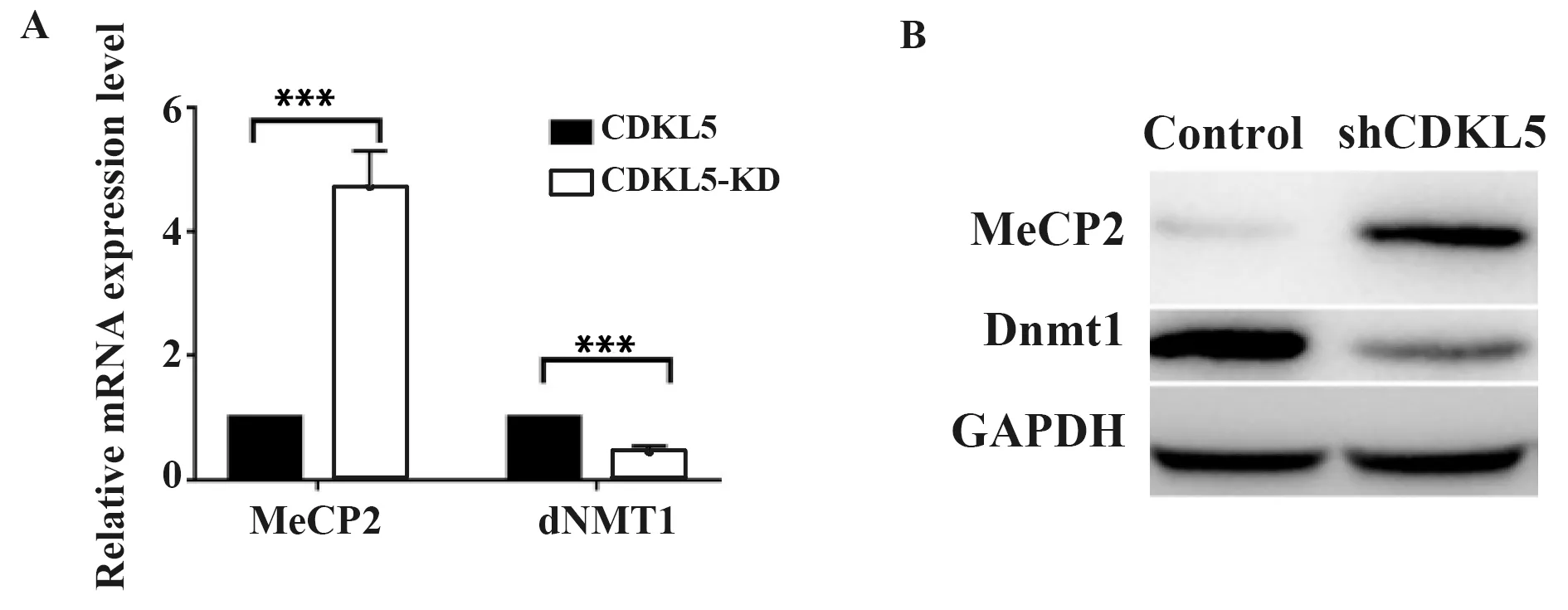
图2 敲减CDKL5引起表观遗传标记物表达的改变Fig.2 Knockdown of CDKL5 induces expression changes of epigenetic markersNote:A.mRNA level,***.P<0.001;B.Protein expression level.
3 讨论
本研究发现,敲减胶质母细胞瘤中的CDKL5改变多个表观遗传标志,包括组蛋白H3的赖氨酸修饰和Dnmt1、MeCP2的表达。异常的组蛋白赖氨酸甲基化与肿瘤的关系已很明确[9]。抑制IDH1突变体、Dnmt1、KDM1等表观遗传相关蛋白来回调异常的组蛋白赖氨酸甲基化和乙酰化能成功诱导胶质瘤细胞分化并抑制其生长[10-12]。在所有的组蛋白H3赖氨酸修饰中,H3K4me1/2/3、H3K9me1和H3K9ac与基因表达激活有关,而H3K9me2/3与基因沉默有关,因此,敲减CDKL5引起的H3K4me2、H3K9ac上调和H3K9me3下调或能重新激活抑癌基因的表达,同时沉默癌基因,诱导胶质瘤分化,从而降低胶质瘤的恶性程度[13]。
Dnmt1和 MeCP2都是CDKL5的激酶底物。其中Dnmt1是维持CpG岛甲基化和组蛋白H3修饰模式的关键酶,参与有丝分裂、耐药、自我更新等多种肿瘤相关事件[14]。Dnmt1能调控基因表达,而Dnmt1的表达也受到启动子甲基化和赖氨酸甲基化依赖性蛋白稳定性的调控。CDKL5直接调控胶质瘤中表观遗传修饰的机制尚不清楚,我们推测可能部分与Dnmt1有关。CDKL5促进Dnmt1 N端(1-290aa)的磷酸化,但具体的磷酸化位点未知。此序列范围内有三个重要的丝氨酸磷酸化位点,其中Akt磷酸化S127和S143位点,PKC磷酸化S127位点,CDK1/2/5磷酸化S154位。这几个位点所在的小段区域与Dnmt1的活性有关,其中S127位磷酸化避免Dnmt1/PCNA/UHRF1复合物的形成,降低Dnmt1的甲基转移酶活性和DNA整体甲基化,促进胶质瘤发展;S154位磷酸化主要促进Dnmt1的活性[15],S143位磷酸化抑制相邻K142位的SET7依赖性单甲基化,从而免受泛素-蛋白酶体降解。胶质母细胞瘤中存在CDKL5与Dnmt1的相互作用,理应存在Dnmt1的磷酸化修饰。敲减CDKL5也下调Dnmt1的mRNA水平,故其蛋白水平的下调应非S143磷酸化下调引起的蛋白降解所致。CDKL5无法调控Dnmt1的转录,其mRNA水平下调更可能归因于整体表观遗传变化连带引起的Dnmt1启动子甲基化上调、对应组蛋白修饰变化或对应转录因子表达上调,而整体表观遗传变化是否由Dnmt1推动尚不知晓,需要深入研究。MeCP2通过结合甲基化的CpG岛来抑制靶基因转录,MeCP2参与神经分化,而维甲酸不仅能上调MeCP2的表达,也能诱导胶质母细胞瘤C6细胞向神经元方向分化,表明MeCP2与胶质瘤分化有潜在联系。敲减CDKL5引起Dnmt1的下调和MeCP2的上调结果表明,CDKL5可能参与维持胶质母细胞瘤细胞中的表观遗传学特征,为未来的研究提供了实验基础。

