响应面法优化脯氨酸羟化酶转化反应工艺条件
罗素亚 郑豆豆 何广正 张琳琳 徐书景 鞠建松
(河北师范大学生命科学学院,石家庄 050024)
反式-4-羟基-L-脯氨酸(L-羟脯氨酸,trans-4-hydroxy-L-proline)是胶原蛋白中特有的一种亚氨基酸,属于非必需氨基酸,是羟化酶对L-脯氨酸羟基化修饰的产物,具有增强结缔组织韧性和弹性的功效[1]。胶原蛋白含量最为丰富的材料是骨胶和明胶,骨胶、明胶中L-羟脯氨酸含量为10%-10.5%,脯氨酸含量为12%-13%[2]。人体中L-羟脯氨酸失衡会引发诸如老年痴呆、营养不良、组织纤维化、软骨组织和韧带组织韧性降低等症状[3]。目前,针对L-羟脯氨酸的研究和开发正受到食品、医药及美容等相关行业的广泛关注[4-5]。此外,由于反式-4-羟基-L-脯氨酸具有两个手性中心,易于衍生化,药理活性多样,因此,L-羟脯氨酸可作为医药原料药的手性中间体,正被广泛应用于合成抗高血压、抗肿瘤、培南类新型抗生素等多种新型创制类药物[6]。受这些因素的影响,反式-4-羟基-L-脯氨酸的需求量逐年上升,市场潜力巨大。
我国目前生产反式-4-羟基-L-脯氨酸主要采用化学水解提取工艺,该工艺以动物胶原蛋白为主要原料,通过强酸水解、亚硝酸氧化和离子交换等过程制备L-羟脯氨酸,其收率仅为4%-7%[4],且存在着“三废”排放量大、原料消耗量大、纯度低及能耗高等不足;国外生产L-羟脯氨酸的主要方法为发酵法,即生物转化法,该方法以L-脯氨酸和α-酮戊二酸为原料,辅以Fe2+、抗坏血酸盐,通过脯氨酸羟化酶催化产生L-羟脯氨酸。目前用于生物法转化的脯氨酸羟化酶(L-Proline 4-hydroxylase,P4hy,EC 1.14.11.57)主要来自指孢囊菌(Dactylosporangiumsp.)RH1,该基因(GenBank:D78338.1)的GC含量为73.63%,异源表达时主要以包涵体呈现,且催化活性低,影响了该酶的推广和应用[5,7]。
本实验室在不改变P4hy的氨基酸序列条件下,通过密码子优化将其GC含量降低至61.45%,所构建表达载体pET-P4hy在分子伴侣质粒pG-KJE8的协同下,可溶性蛋白含量明显提高,催化反应转化率为72.8%[8]。本实验以表达载体pET-P4hy为研究对象,优化蛋白表达条件和转化反应条件,采用响应面法预测催化反应的最适条件,进一步提高其催化反应转化率、降低生产成本,为生产反式-4-羟基-L-脯氨酸奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和试剂 大肠杆菌BL21(DE3)用于蛋白表达,分子伴侣质粒pG-KJE8购自TaKaRa公司,质粒pET-P4hy由本实验室构建[8],标准品L-脯氨酸和反式-4-羟基-L-脯氨酸购自Sigma公司,2-(N-吗啡啉)乙磺酸钠(MES)、三羟甲基甲胺基乙磺酸(TES)、哌嗪-N,N-二(2-乙磺酸)(PIPES)和三(羟甲基)氨基甲烷(Tris-HCl)等化学试剂为分析纯。异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素和氯霉素均购于Solarbio公司。
1.2 方法
1.2.1 重组菌诱导条件优化
1.2.1.1 诱导温度优化 将表达载体pET-P4hy转化至带有分子伴侣质粒pG-KJE8的大肠杆菌BL21(DE3)中,37℃过夜培养后挑取单一菌落培养,随后将种子液以10%的接种量转接到含有卡那霉素(40 μg/mL)和氯霉素(25 μg/mL)的LB液体培养基中,37℃ 180 r/min振荡培养至OD600为0.5-0.7时,加入诱导剂IPTG(0.1 mmol/L),分别在不同温度下(16℃、20℃、24℃、28℃和32℃)诱导培养6 h,4℃1 000 r/min离心10 min收集菌体。
将1 g 菌体重悬浮于10 mL转化反应液[200 mmol/L L-脯 氨 酸、200 mmol/L α-酮 戊 二 酸、6 mmol/L 硫酸亚铁、2 mmol/L L-抗坏血酸、80 mmol/L MES缓冲液(pH 6.5)和1% Nonidet P-40]中,每组3个平行实验,28℃,140 r/min振荡培养,间隔一定时间取样,离心去除菌体,通过HPLC(Wondasil C18,4.6 mm×250 mm,5 μm)检测反应液中L-羟脯氨酸的转化率(以标准品的含量和所对应的峰面积作标准曲线,计算酶蛋白催化生成L-羟脯氨酸的转化效率),确定其最适诱导温度。
1.2.1.2 IPTG浓度优化 按1.2.1.1所述条件培养重组菌,改变诱导剂浓度(0、0.05、0.1、0.2和0.3 mmol/L),于28℃继续培养6 h,离心收集菌体。以全细胞为催化剂,参照1.2.1.1所述方法检测反应液中L-羟脯氨酸的转化率,确定最佳诱导剂浓度。
1.2.2 转化反应条件优化
1.2.2.1 转化反应温度优化 在28℃,0.2 mmol/L IPTG下诱导培养重组菌6 h,离心收集菌体。称取1 g菌体,悬浮在10 mL转化反应液中,置于不同反应温度(20℃、24℃、28℃、32℃和37℃)下恒温孵育,按照1.2.1所述方法检测L-羟脯氨酸的转化率,确定最适转化温度。
1.2.2.2 反应缓冲液及其pH值优化 取1.2.1所培养的菌体1 g,分别重悬于80 mmol/L的MES、TES、PIPES和Tris-HCl缓冲剂中,缓冲液pH为6.0、6.5、7.0、7.5和8.0,转化反应液中其他成分与1.2.1一致,于28℃ 140 r/min振荡反应60 h,通过HPLC检测上清中L-羟脯氨酸的转化率,确定转化反应的最适缓冲液及pH值。
1.2.2.3 缓冲液浓度的筛选 称取1.2.1所培养的菌体1 g,重新悬浮于10 mL转化反应液中,改变MES和TES缓冲液的浓度(0、20、40、80、120、160、200和240 mmol/L),转化反应液的其余成分与1.2.1相一致,参照1.2.1所述方法检测L-羟脯氨酸的转化率,确定缓冲液的最佳浓度。
1.2.2.4 底物配比优化 α-酮戊二酸是脯氨酸羟化酶辅底物,其浓度高低可能对脯氨酸羟化酶的催化活性产生一定的影响[9]。称取1.2.1所述菌体1 g,悬浮于10 mL转化反应液中(缓冲液浓度参照1.2.2.3中的最佳浓度),其中 L-脯氨酸终浓度固定为200 mmol/L,倍比降低α-酮戊二酸的浓度,使之与L-脯氨酸的浓度之比分别为1/1、1/2、1/4、1/8、1/12和1/16,检测反应液中L-羟脯氨酸的转化率,筛选α-酮戊二酸的最佳浓度。
1.2.2.5 表面活性剂浓度筛选 表面活性剂具有增加细胞通透性的功能,有利于底物与酶蛋白接触,从而提高酶的催化效率[10-11]。前期实验检测发现,分别向转化反应液中添加表面活性剂CTAB、SDS、Tween 20、Trixton X-100和Nonidet P-40后,仅Nonidet P-40表现出对酶蛋白的催化活性有一定影响,而其他4种表面活性剂的影响较小。因此,参照1.2.2.4中的最佳底物配比,调整转化反应液中表面活性剂Nonidet P-40的浓度,检测产物L-羟脯氨酸的转化率,确定Nonidet P-40的最佳浓度。
1.2.3 响应面法优化P4hy转化反应条件 响应面分析法(Response Surface Methodology,RSM)是20世纪中后叶发展起来的优化试验条件的统计学方法,现已经广泛应用于微生物发酵条件的优化[12-13]。响应面法可同时对影响生物产量的各因子水平及其交互作用进行优化与评价[14-15],因此可快速有效地确定多因子系统的最佳条件。
根据Box-Benhnken中心组合试验设计原理,综合单因素所得实验结果,采用响应面分析法优化P4hy转化反应条件(缓冲液pH值,转化反应温度和振荡速度),分析各因素的主效应和交互效应,绘制响应面立体分析图,寻求最佳水平,进而确定最佳工艺条件。
2 结果
2.1 重组菌诱导条件优化
2.1.1 诱导温度的优化 通过HPLC检测发现,20℃和28℃下诱导所得重组菌的转化率随转化反应时间的延长呈现先快后缓的上升态势(图1-A),当反应达68 h时,20℃和28℃诱导所得重组菌的转化率接近85%,其他3个温度下诱导获得的重组菌转化率均低于50%;当反应达100 h,5个诱导温度下重组菌的转化率均可达100%。由此可见,20℃和28℃是较为理想的诱导温度,但考虑到28℃接近于室温,实验可操作性较好,因此,确定诱导温度为28℃。
2.1.2 IPTG浓度优化 在不同IPTG浓度下诱导所得重组菌的产物转化率如图1-B所示:产物转化率均随反应时间的延长而逐渐增加,其中未加诱导剂的重组菌转化反应的转化率增幅最小,72 h时其转化率仅为20%;IPTG为0.2 mmol/L时产物转化率增幅最快,反应进行至60 h时,产物转化率接近100%;而在相同反应时间下,其它浓度下重组菌的转化率均低于65%,说明重组菌诱导所需IPTG的最佳浓度为0.2 mmol/L。
2.2 优化转化工艺条件
2.2.1 转化反应温度的优化 重组菌在不同转化反应温度下的产物转化率随时间变化而不断增长(图2-A)。在28℃下,产物转化率的增长更为快速,当反应时间达60 h和80 h时,反应产物转化率分别达97%和100%;而在24℃和32℃下,当反应进行至36 h后,产物转化率也呈急剧上升态势,但最终二者的产物转化率仍然没有达到100%。因此,最适反应温度为28℃。
2.2.2 缓冲剂种类及pH值筛选 由图2-B可见,当以Tris-HCl作为缓冲液时,产物转化率一直徘徊于30%左右,而其他缓冲体系下产物转化率则随着pH值的增加(pH 6.0-6.5)而快速增长:当pH为6.5时,各缓冲溶液体系下的反应产物转化率均达到最大值(MES,100.0%;TES,95.8%;PIPES,93.1%);当pH值继续上升(pH 6.5-8.0),产物转化率呈现下降趋势,其中,缓冲体系为MES时,重组菌的转化率下降较为缓慢;由于MES缓冲体系在pH为6.5-7.0范围内均具有较高的产物转化率,因此,MES是较为理想的缓冲剂,其次是TES。
2.2.3 缓冲剂浓度的筛选 由图2-C和图2-D可见,当缓冲液MES和TES的浓度处于120-240 mmol/L之间时,产物转化率随反应时间的延长呈快速上升趋势;当MES和TES浓度为120、240或200mmol/L时,反应60 h后产物转化率可达100%;当缓冲液浓度介于0-80 mmol/L之间,产物转化率的增长较为缓慢,当反应60 h时,其产物转化率均低于90%。综合考虑转化反应成本,确定MES和TES缓冲液的最适浓度均为120 mmol/L。
2.2.4 优化底物配比 经HPLC检测,在不同的底物配比下,重组菌的产物转化率均随反应时间的延长而增加(图2-E)。当反应延长至60 h时,底物α-酮戊二酸与L-脯氨酸浓度之比分别为1/1、1/8和1/12时,产物转化率均接近100%;不过,与其他底物配比相比较,底物之比为1/1时反应产物转化率上升趋势更加接近线性上升状态,说明底物配比为1/1较为有利于生产L-羟脯氨酸。
2.2.5 Nonidet P-40浓度优化 通过检测,在含有不同浓度的Nonidet P-40时,产物转化率随反应时间延长而呈不同程度的增长态势(图2-F)。当反应时间介于0-24 h,Nonidet P-40浓度为1.0%时,其产物转化率增长速度较快;然而当反应时间介于24-48 h,与另外两个浓度相比(1%和2%),Nonidet P-40浓度为1.5%时的反应产物转化率增长最快;当反应时间为36 h,Nonidet P-40浓度为1.5%时,其产物转化率率先达到最高值(100%),而其他浓度下则在反应进行至48 h才达到最高值。由此可见,Nonidet P-40的浓度采用1.5%为佳。

图1 重组脯氨酸羟化酶诱导条件优化
2.3 Box-Benhnken试验设计及响应面结果
综合单因素实验结果,采用三因素三水平法转化反应温度(A:24℃,28℃和32℃)、缓冲液pH值(B:6.0,6.5和7.0)和振荡速度(C:100,140和180 r/min)等三因素进行研究,实验设计及结果见表1、表2和图3。表1为不同水平因素下产物转化率的响应面值,根据表1实验结果,通过design expert 7.1.6软件处理确定回归方程为:Y=73.49-11.72A-62.51B+17.73C-3.71AB-5.00AC+5.13BC-25.69A2-37.08B2-23.93C2;表2为该模型的可信度分析结果:其决定系数R2= 0.996 7,F值为235.60(P<0.000 1),说明所构建模型存在显著性差异,单因素和双因素(AB、AC和BC)均对产物转化率有显著的影响。图3是三因素对脯氨酸羟化酶转化率交互影响效应分析立体图,通过岭嵴分析,转化反应的最适pH值为6.6,温度为27℃,转速为152 r/min。
为了验证预测值以确定最优条件,采用上述最优条件进行验证,重复3次所得的产物转化率都达到了100%,说明响应面法获得的模型与实际数据拟合度好。
3 讨论
L-羟脯氨酸在医药、生化、美容业等方面有着较为广泛应用,市场需求逐年上升,因此,L-羟脯氨酸生产工艺的开发受到科研工作者的关注。综合考虑环境污染、产品纯度和生产成本等因素的影响,采用生物转化法生产L-羟脯氨酸无疑是较为理想的方法之一。

图2 转化反应条件优化
目前国内外主要采用指孢囊菌RH1来源的脯氨酸羟化酶催化L-脯氨酸产生L-羟脯氨酸,由于该基因GC含量过高,该酶在工业生产中的应用受到很大影响[5,7]。针对这个问题,国内外科研工作者进行了广泛而深入的探究。Klein等[5]通过分子伴侣GroEL/GroES促进了酶蛋白P4hy的可溶性表达,以所构建的重组菌为催化剂,催化反应72 h后L-羟脯氨酸的转化率为63%。刘合栋等[16]采用高频密码子替换、调整基因mRNA二级结构、引入色氨酸串联启动子及调整发酵补料策略等技术手段,最终使催化反应转化率提高至81.1%。蔡萌萌等[17]通过探究发酵过程不同阶段的溶氧水平对L-羟脯氨酸产量的影响,提出了分阶段溶氧控制策略,最终使L-羟脯氨酸产量达45.3 g/L,糖酸转化率达到20.7%。Liu等[18]采用增大溶氧量、添加蛋白酶降低发酵液中可溶性蛋白含量等手段优化发酵工艺,最终发酵获得L-羟脯氨酸的含量为45.7 g/L,糖酸转化率为18.1%。张琳琳等[8]通过优化基因p4hy的密码子,降低其GC含量,并在分子伴侣质粒pG-KJE8的协同作用下提高了蛋白的可溶性表达,催化反应转化率提高至72.8%。Wang等[19]通过基因挖掘技术从3株菌中筛选获得了一个催化活性最好的脯氨酸羟化酶基因(alp4h),将该基因转入L-脯氨酸生产菌株后,所构建的工程菌株产L-羟脯氨酸的产量为3.57 g/L,采用补料发酵处理36 h后L-羟脯氨酸含量为45.83 g/L;Zhang等[20]通过敲除大肠杆菌中L-脯氨酸代谢相关基因以及其他影响转化反应的基因构建工程菌株,经过补料发酵法生产获得L-羟脯氨酸浓度为31.0 g/L。这些结果说明了从影响酶蛋白催化反应的内在因素和外在因素进行优化或调控在一定程度上提高脯氨酸羟化酶的反应产物转化率,具有较好的应用开发潜力;不足的是上述研究普遍存在反应转化率低、反应终产物成分复杂等不利因素。
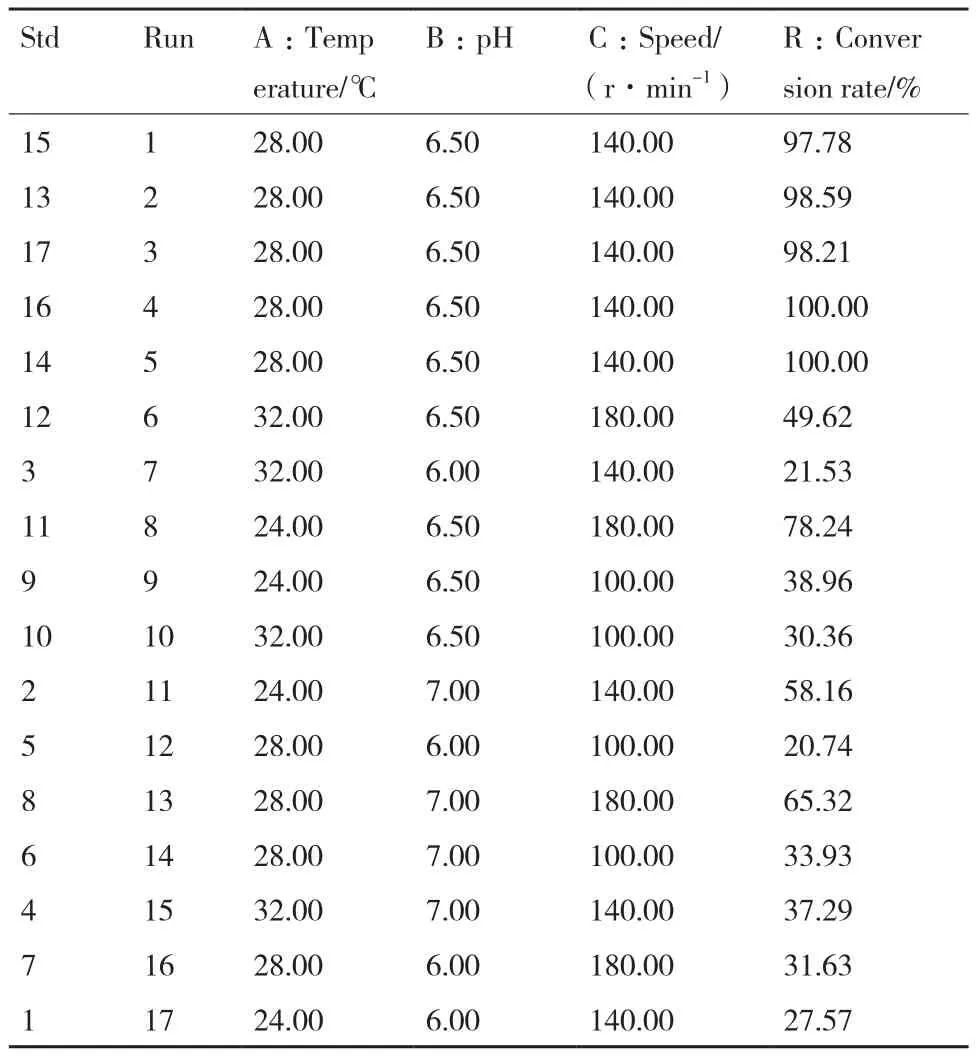
表1 转化反应温度、pH和振荡速度三因素试验设计及结果

表2 转化反应温度、pH和振荡速度三因素试验模型的可信度分析

图3 产物转化率与转化反应温度(A)、pH(B)和振荡速度(C)的响应面图
为了进一步提高酶蛋白P4hy的催化反应转化率,降低生产成本,本实验以张琳琳等[8]的实验结果为基础,以影响催化反应的外在因素为研究对象,通过单一因素优化法初步筛选获得了转化反应的最佳条件:蛋白表达最适诱导温度为28℃,IPTG浓度为0.2 mmol/L;转化反应最适温度为28℃,缓冲液为MES(120 mmol/L,pH 6.5-7.0),L-脯氨酸与 α-酮戊二酸浓度均为200 mmol/L(1∶1),表面活性剂Nonidet P-40的浓度为1.5%。随后,以单因素分析所得的最佳优化条件作为Box-Benhnken实验设计的中心点,对影响转化反应的因素做进一步优化,通过Design Expert 7.0.3统计软件预测了影响转化反应三因素的最适条件:转化反应温度为27℃,振荡速率为152 r/min,转化反应液pH值为6.6。验证结果表明,在预测的最佳条件下,转化反应进行48 h后即可将反应底物L-脯氨酸全部转化为L-羟脯氨酸,产物转化率达100%,实现了产物的高效转化。
4 结论
通过单一因素优化法初筛、响应面法预测和实验验证,确定了最佳蛋白表达条件和催化反应条件,实现了在48 h内将反应底物L-脯氨酸全部转化为L-羟脯氨酸(100%),确保了产物L-羟脯氨酸的高效转化,同时也消除了反应底物L-脯氨酸对产物分离纯化造成的干扰问题,为该产品的工业化生产奠定了良好的实验基础。

