DNA/银纳米簇介导的功能核酸生物传感器研究进展
杨敏 李舒婷 杨文平 李相阳 许文涛
(1. 北京农学院食品科学与工程学院,北京 100083;2. 北京食品营养与人类健康高精尖创新中心 中国农业大学,北京 100083)
贵金属纳米团簇是由 Au、Ag和Pt 等贵金属元素组成的分子聚集体,一般由几个到几十个原子组成。金属纳米团簇的理化性质对其物理尺寸有强烈的依赖性,当尺寸接近电子的费米波长(金和银约0.5 nm),连续的密度态分裂成类似于分子的不连续的能级,与激发光相互作用时电子能够在能级之间转换,进而能发出强烈的荧光[1],显现出独特的电学和光学性能[2]。其中,以DNA为模板的银纳米簇(Ag NCs)由于其高荧光量子产率(> 50%),良好的光稳定性,低毒性,生物相容性,易合成等优点而引起了广泛关注[3]。基于此,本文对DNA / Ag NCs在生物传感器及其应用方面的研究展开综述,并着重介绍了其在细胞成像及抑菌方面的应用,最后总结了DNA / Ag NCs生物传感器目前存在的不足和未来发展的趋势,以期为研究者提供借鉴。
1 DNA/银纳米簇的制备及基本性质
1.1 DNA/银纳米簇的制备方法
DNA,特别是胞嘧啶碱基C与银离子之间有强烈的亲和性[4],有证据表明迄今为止最成功的AgNCs就是用 DNA 为模板合成的,这种强烈亲和性使得银离子能够维持双链DNA的胞嘧啶之间C-C的错配[5]。并且该方法制备条件温和,制备的银纳米簇荧光性质稳定,生物相容性好,这些优点使得DNA稳定的银纳米簇的研究最为广泛。
Zheng等[6]首次报道了用DNA为模板合成荧光银纳米簇,以含有12个碱基5'-AGGTCGCCGCCC-3'的DNA序列为模板,磷酸缓冲液为反应体系的缓冲液,NaBH4作为还原剂,在冰浴条件下合成了荧光银纳米簇,制备出的荧光银纳米簇稳定性好、溶于水、颗粒均匀。该Ag NCs在400 nm-550 nm有强的紫外吸收峰,在630 nm左右有荧光发射,质谱数据显示所合成的Ag NCs只有1-4个Ag原子。后续的多次研究又强调了碱基种类、碱基序列以及 DNA的二级结构对合成DNA稳定的Ag NCs的关键作用[7-10]。随后 O’Neill等[11]报道了用发卡状 DNA(环上含 3-12个C)合成发荧光的Ag NCs,结果表明,环上C的数量可以调节所得Ag NCs的稳定性和荧光。因此,很多用于合成 DNA / Ag NCs 的模板都是富含胞嘧啶的单链DNA(ssDNA)或者是包含一段C环的发夹结构 DNA 和双链DNA(dsDNA)。之后,Huang等[12]发现含错配碱基对的双链DNA 也被用于位点特异性的Ag NCs的合成,分子规模的Ag NCs位于错配碱基对附近,而整体DNA还保持完整结构。
1.2 DNA/银纳米簇的表征
由于合成Ag NCs的DNA寡核苷酸的单分散性,使用电喷雾质谱(Electrospray ionization mass spectrometry,ESI-MS)可以精确地确定纳米团簇的化学计量学[13]。紫外-可见吸收光谱可以用来测定Ag NCs的最大吸收波长;荧光光谱可通过荧光分光光度计来获得,从而获得Ag NCs的荧光发射情况;Ag NCs的形貌和大小可借助透射电子显微镜(Transmission electron microscopy,TEM)来观察和测量[14]。紫外可见光谱和圆二色光谱均可用来探讨Ag NCs的结构变化及其荧光变化机制[15]。
2 多色DNA/银纳米簇的调控机制
Ag NCs周围的配体/碱基环境是决定荧光发射颜色的重要因素,成核序列不同以及靠近Ag NCs的序列(增强子序列)不一样,Ag NCs产生的荧光都可能会不一样。目前DNA / AgNCs的荧光发射有四种主要的颜色,分别为红、黄、蓝、绿,如图1所示。此外还有近红外发射光。据报道,DNA / AgNCs由一个由Ag+离子包围的核心/群中性Ag原子组成。中性原子的数目决定了原子团簇的发射波长,而Ag+离子将核心和DNA碱基“黏合”在一起[16-17]。Copp等[18]先前证明绿色和红色发射往往分别与4个和6个中性核心银原子有关。此后,该团队又基于质谱分析,发现DNA / Ag NCs的红色发射极含有6个中性的Ag原子和8个Ag+离子,绿色发射极含有4个中性的Ag原子。这意味着两个Ag原子从原始红色发射极的核心氧化成Ag+,从而导致荧光颜色的转变[19]。
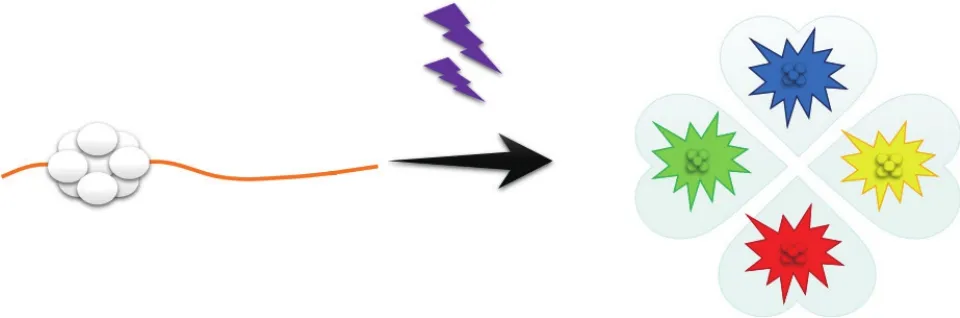
图1 DNA/银纳米簇4种主要的荧光颜色
Dickson课题组[20]以不同的DNA序列为模板合成的具有不同颜色的荧光发射的荧光银纳米簇光谱,如表1所示,这些银纳米簇模板都以C12为基础,通过变动中间部分的碱基类型和顺序,合成的荧光银纳米簇的荧光发射光谱从可见光区域跨越到近红外区域。
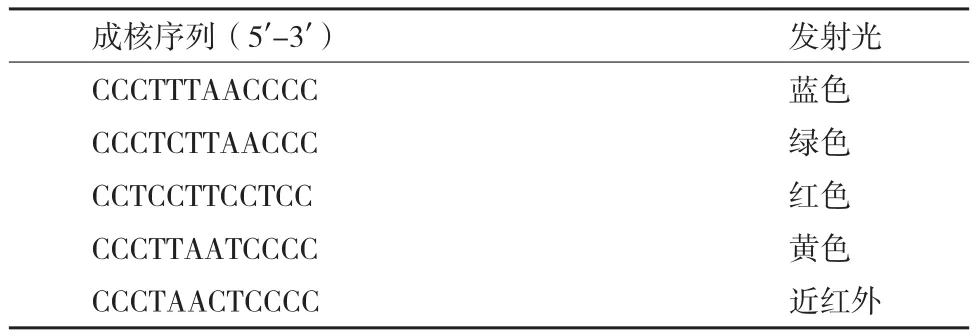
表1 五种不同单链DNA序列为模板稳定的银纳米簇的发射光
Sengupta等[21]小组利用3种不同序列的DNA(dT12、dT4C4T4和dC4T4C4)探讨了银纳米簇的激发波长对碱基序列的选择性。光谱分析表明以聚T碱基的DNA为模板合成的银纳米簇发出蓝色或绿色荧光,而以聚C碱基的DNA为模板的银纳米簇除了可以发出蓝、绿荧光,还可以发出红色荧光。对dC4T4C4进行了研究表明簇的形成取决于寡核苷酸的浓度,较高的浓度有利于红色荧光的产生,在较低浓度的dC4T4C4中,一种蓝色/绿色的荧光纳米簇占主导地位。
2011年,Yeh团队[22]表明当DNA / Ag NCs与富含鸟嘌呤的DNA链靠近时,可以使Ag NCs的荧光从无到有,发出强的红色荧光,或使红色荧光增强,这依赖于Forster能量转移作为荧光开/关(on /off)切换机制,且鸟嘌呤N7位点在观察到的红色荧光增强中起关键作用。当Ag NCs与富含胸腺嘧啶的DNA链邻近时,产生绿色荧光增强,而富含腺嘌呤的DNA链邻近时没有产生任何可测量的荧光增强。
Li等[23]的研究表明,在充满高密度葡聚糖的拥挤环境中制备的银纳米团簇与水溶液相比,具有更小的粒径和更高的荧光量子产率。Cerretani等[24]的研究表明,5'-TTCCCACCCACCCCGGCCCGT-3'能稳定红色和绿色发射极,并可通过加入H2O2或NaBH4引发两团簇之间的切换。此外,一些非荧光中间体物质的形成会限制两个发射器之间的完全可逆性。
3 DNA/银纳米簇介导的功能核酸传感器
3.1 DNA/银纳米簇介导的“turn-on”型功能核酸荧光生物传感器
核酸探针是指带有标记物的序列已知的核酸片段,它可以与其互补的核酸序列杂交形成双链。以DNA为模板生成的Ag NCs是目前一种新兴的荧光探针,它比半导体量子点具有更小的体积,并且能比常用的有机染料有更好的光稳定性和亮度[16]。当Ag NCs足够小时,它们表现出很强的光吸收和发射能力,这使得它们几乎成为单分子光谱中理想的荧光基团[22]。另外,Ag NCs由于其光谱特性高度依赖于DNA的序列和结构,已被研究者广泛应用于构建功能核酸荧光生物传感器来进行生物分析。
3.1.1 无信号放大策略 在2011年,Kun等[25]发现DNA双链中的碱基缺失位点(AP位点)可以作为Ag NCs生成的支架,在含AP位点的DNA双链中,荧光Ag NCs的形成对AP位点表面的胞嘧啶和位点侧面的鸟嘌呤具有高度选择性。基于Ag NCs形成对AP位点微环境的依赖性,作者构建了一个“signalon”荧光传感平台用于DNA单核苷酸多态性(Singlenucleotide polymorphism,SNP)的检测。当存在靶标链时,靶标链与探针结合,在AP位点处可形成Ag NCs,在670 nm波长处发出强荧光;当靶标链发生单碱基突变时,在AP位点处无法生成Ag NCs,无荧光产生。荧光Ag NCs对AP位点周围序列的强烈依赖性已成功地用于鉴定癌症抑制基因p53的密码子177中的突变。
Zhu等[26]开发了一种新型的DNA / Ag NCs探针,用于基于TdT介导的聚合和支架链置换反应的原位凋亡细胞检测和成像。为了制备开启荧光DNA/ AgNC探针,应用含有两个结构域I和II的单链DNA S1。富含胞嘧啶的结构域I对Ag+表现出强亲和力,可以容易地制备荧光核酸稳定的Ag NCs。由于结构域II与BHQ标记的DNA S2部分杂交,猝灭剂位于Ag NCs附近,通过荧光共振能量转移(FRET)有效淬灭DNA / Ag NCs的荧光。在凋亡细胞的细胞核中,TdT分别使用DSB和dATP作为引物和底物,将poly-dA添加到DSB的3'-OH末端。然后,细长的poly-dA链与DNA / Ag NCs探针的3'ploy-T突出端杂交,并启动前端链置换。由靶poly-dA DNA链引发的链置换从DNA / Ag NC探针释放猝灭剂标记的DNA,导致DNA / Ag NCs的显著荧光点亮,用于敏感检测细胞凋亡。该方法可以在体外检测至少20个凋亡细胞。
3.1.2 有信号放大策略
3.1.2.1 鸟嘌呤接近 根据鸟嘌呤靠近使得荧光增强呈现的是一种“turn-on”的模式,当不存在目标分析物时,荧光银纳米簇与富含鸟嘌呤的增强序列是呈现完全分离的状态,所以背景荧光信号非常低。Yeh等[27]发现以CCCTTAATCCCC为模板合成的银纳米簇,当模版延长部分序列与一段包含有富G序列的DNA杂交后,能够得到荧光强度增强了500倍的红色荧光银簇。在此基础上,该团队还设计一个变色的银纳米簇探针(cNCB),在银纳米簇、富G序列和待测序列同时存在时产生橘色的银纳米簇荧光,而当待测序列的其中一个碱基发生突变后会产生红色的银纳米簇荧光,两种不同情况下合成的银纳米簇荧光发射波长却相差几十纳米,因而实现对单碱基突变的检测[28]。
Li等[29]提出了一种结合诱导荧光激活法来检测α-淀粉酶,使用两种适体(Apt15和Apt29),并通过序列元件进行修饰。使用12个核苷酸序列将第一个适体与5'末端的纳米簇成核序列连接起来。第二个适体通过互补序列与3'末端的富含G的突出端连接。两个适体探针与靶蛋白的结合启动与每个适体连接的互补接头序列之间的杂交,从而使富含G的突出端与Ag NCs紧密接近,导致显著的荧光增强。通过该方法,对于人α-凝血酶,实现了1 nmol/L的检测限和5 nmol/L-2 μmol/L的线性动态范围。
3.1.2.2 金属离子 Zhang等[30]报道了基于DNA /Ag NCs的信号增强荧光适体传感器,用于同时检测赭曲霉毒素A(Ochratoxin a,OTA)和黄曲霉毒素B 1(AFB 1)。在添加Zn2+后,荧光强度明显增加,从而使OTA的检出限低至0.2 pg/mL,AFB1的检出限低至0.3 pg/mL。Lee等[31]用Ag+来触发DNA/ Ag NCs的荧光从弱红色转换为强绿色来检测Ag+。Ag+通过在两个Cyt12/ Ag NCs之间形成桥,诱导Cyt12/ Ag NCs二聚体结构的形成,这种二聚体的形成使Cyt12-Ag NCs的荧光从红色变为绿色。使用这种Ag+触发的荧光转换可检测到浓度低至10 nmol/L的Ag+。
3.1.2.3 与其他纳米材料结合 Khan等[32]开发了一种基于适配体银纳米簇(DNA / Ag NCs)/二硫化钼纳米片(MoS2)的荧光检测真菌毒素T-2的方法。使用的DNA链包含3段,包括稳定银簇片段(C12)、连接片段和T-2毒素适配体片段。以此DNA合成发红色荧光的银纳米簇会吸附到二硫化钼纳米片表面,通过荧光共振能量转移(Fluorescence resonance energy transfer,FRET),造成荧光猝灭。而目标物存在时,由于适配体作用,会把银簇从纳米片表面拉开,FRET作用失效,荧光恢复。基于此原理,对T-2进行了灵敏性检测。动态定量范围为0.005 ng/mL-500 ng/mL,检测线为0.93 pg/mL。
3.2 DNA/银纳米簇介导的“turn-off”型功能核酸生物传感器
3.2.1 生物大分子 Yang等[33]利用DNA纳米银簇(DNA / Ag NCs)的荧光特性,开发了一种能够高特异性检测靶miRNA存在的DNA / Ag NCs探针。首先设计了一条DNA序列,它具有针对靶miRNA的特异性互补序列和用于产生红色发射Ag NCs的12个核苷酸的支架。当存在靶miRNA时,DNA /Ag NCs探针的发射显着低于不存在靶miRNA或其他miRNA的情况。
作为生物硫醇,Cys在其参与可逆氧化还原反应、解毒和代谢过程中起着至关重要的作用。Wang等[34]开发了一种简单的Cys检测方法,检测系统由DNA / Ag NCs和Cys检测靶组成。DNA链由成核序列和富含G的适体序列组成,富含G序列的存在可以显着增强Ag NCs的荧光信号,利用此DNA链作为模板合成一种具有强荧光信号的银簇纳米材料。在Cys或其他生物硫醇的存在下,由于S-Ag键的产生,DNA / Ag NCs的荧光可以被强烈猝灭。该方法对Cys的线性检测范围为0.1 nmol/L-100 nmol/L,检测限为0.05 nmol/L。
3.2.2 金属离子 Peng等[35]设计了一种新的荧光寡核苷酸稳定的银纳米团簇(DNA / Ag NCs)探针,用于灵敏检测汞和铜离子。该探针含有两个定制的DNA序列。一种是信号探针,其含有富含胞嘧啶的序列模板,用于Ag NCs合成和两端的连接序列。另一种是富含鸟嘌呤的序列,用于信号增强和与信号探针的连接序列互补的连接序列。杂交后,基于DNA / Ag NCs在富含鸟嘌呤的DNA序列附近的荧光增强效应,杂交的双链DNA / Ag NCs的荧光增强了200倍并且比单链DNA / Ag NCs稳定。在Hg2+或Cu2+存在的情况下可以猝灭其荧光,因此可以用作检测汞和铜离子的新型荧光探针,线性检测6.0-160.0和6 nmol/L-240 nmol/L范围内的汞和铜离子,检测限分别为2.1 nmol/L和3.4 nmol/L。
3.2.3 小分子 Ding等[36]提出了DNA模板铜/银纳米簇(DNA-Cu / Ag NCs)荧光探针用于选择性检测 S2-。 用 DNA 模 板(5'-CCCTTAATCCCC-3') 合成具有优异荧光特性的DNA-Cu / Ag NCs荧光探针。然而,一旦引入含有S2-的溶液,由于硫离子与银和铜原子具有强亲和力,荧光DNA-Cu / Ag NCs探针的结构变化诱导其荧光淬灭。通过DNA-Cu / Ag NCs检测的荧光强度的变化定量检测S2-的浓度。所提出的方法允许在10 pmol/L-1 mmol/L的S2-浓度范围内使用,检测线为3.75 pmol/L。
3.3 DNA/银纳米簇介导的“比率型”功能核酸荧光生物传感器
大多数Ag NCs只具有单一的荧光信号,阻碍了Ag NCs探针的实际应用和发展。因此,具有多个发射峰的变色龙Ag NCs为敏感的比率目标检测提供了一种新的可能性。Zhou等[15]设计了一种新型的变色龙DNA模板Ag NCs,其荧光颜色可以通过互补DNA、非荧光辅助Ag NCs和Mg2+的调控在黄色、橙色和红色之间进行切换。以A20-C55为模板的Ag NCs(A20-C55-NC)在磷酸盐缓冲溶液中具有强黄色荧光(Y信号)。当通过模板杂交靠近无荧光辅助Ag NCs时,Y信号减少而新的红色发射(R信号)上升,导致Ag NCs溶液从黄色到红色的显著颜色变化;另一方面,A20-C55-NC与互补DNA(T20)的杂交大大增强了Y信号;而A20-C55-NC在Mg2+存在下同时显示出具有相同强度的R和Y信号;因此,变色龙Ag NCs实现了可控的多色荧光变化,无论是在双链还是发夹形结构,比率探针都显示出具有纳摩尔敏感性的信号响应指数生长。
Wang等[37]构建了一种为单一荧光团的新型比率荧光纳米传感器已成功构建,用于超灵敏和特异性检测Pb2+。G-DNA的G1区段与R-DNA的R1区段杂交,形成含有Pb2+依赖的DNAzyme的双链体。G-DNA的G2区段模板化Ag NCs(G-DNA / Ag NCs)发射绿色荧光。同时,G2-1的片段与R2-1片段的杂交,不仅有助于稳定Pb2+依赖的DNAzyme的构型而且还使R2富G序列接近形成的G-DNA / Ag NCs,将绿色发射G-DNA / Ag NCs转化为红色。dsDNA/ Ag NCs含有Pb2+依赖的DNAzyme的rA切割位点,在Pb2+存在下,特异性DNA片段将从dsDNA/ Ag NCs释放,导致DNA / Ag NCs从红色变为绿色,由于Pb2+可以连续切割rA位点,因此从红色到绿色发射的信号变化被放大。该传感器从0.001 nmol/L-10 nmol/L表现出良好的线性关系,Pb2+测定的检出限为1.0 pmol/L,低于大多数检测Pb2+生物传感器。
3.4 DNA/银纳米簇介导的功能核酸电化学生物传感器
电化学生物传感器因具有操作简单、稳定性好、灵敏度高、可实时监测等优点,在食品安全、环境检测、转基因测定、医药工业等领域日益得到了科研工作者的重视。而金属纳米粒子一般具有较好的导电性能,催化性能及吸附能力,可以大大提高传感器的灵敏度。Jie等[38]利用双功能Ag NCs和多重扩增策略,合成了新型Ag NCs并将其用作多功能电化学发光和电化学信号探针。在长dsDNA模板修饰的电极上原位合成了大量Ag NCs,放大了电化学发光信号,用于灵敏检测凝血酶。DPV峰电流显示出与1.0 fmol/L-10.0 nmol/L的目标浓度的对数线性依赖性,测限在3σ时为0.1 fmol/L。
Quan等[39]开发了一种基于银纳米团簇(Ag NCs)/辣根过氧化物酶(Horseradish peroxidase,HRP)纳米复合物(Ag NCs-HRP)的纳米探针,用于癌胚抗原(Carcino-embryonic antigen,CEA)的电化学检测。通过含有CEA适体和C12的DNA模板合成Ag NCs。随着HRP吸附到Ag NCs上,形成了可以与CEA特异性结合的纳米探针(Ag NCs-HRP)。将抗CEA抗体,CEA和纳米探针依次装配到电极表面后,电极表面的HRP可催化3,3'-二甲氧基联苯胺(DB)聚合形成PDB绝缘聚合物薄膜。因此,Fe(CN)63-/4-溶液中电极的氧化还原电流减小,并且降低的氧化还原电流与检测到的CEA浓度成比例,实现了对CEA检测的高灵敏度。降低的电流与CEA在1 pg-10 ng/mL范围内的浓度呈对数关系,检测限为0.5 pg/mL。
3.5 DNA/银纳米簇介导的其他类型功能核酸生物传感器
3.5.1 温度传感器 大多数的温敏材料只有单一的信号响应,没有更好的荧光稳定性和对比度。Oemrawsingh和 Zhao等[40-41]的研究为 Ag NCs的荧光受温度变化的调控提供了明确的证据,但荧光Ag NCs对温度并没有明显的线性响应。Zhou等[42]首次报道了一种新型的双荧光温度敏感型DNA模板化Ag NCs对,成功地指示了活细胞的温度,并且证明了温度诱导的荧光响应是由于DNA模板的杂交和去杂交引起的Ag NCs对的整合和分离。用两个富含C的DNA支架合成银纳米簇(A1-NC,A2-NC),由于A1和A2具有互补序列,使A1-NC,A2-NC彼此靠近,从而获得了对温度敏感的银纳米簇对(A-NCP)。A-NCP在 640 nm(A-FL640) 和 570 nm(A-FL570)处呈现两个明亮的发射带,而B-NCP在685 nm(B-FL685)和620 nm(B-FL620)处实现荧光峰值。随着温度的升高,A-NCP(A-FL570)的荧光发射增加,A-FL640减少;B-NCP(B-FL685和B-FL620)的荧光发射同时降低。因此,A-NCP荧光颜色显示出从橙色到黄色的变化,而B-NCP的荧光颜色从橙色变为无色,实现了对应于15-45℃温度的敏感变化。此外,发夹型(AH和BH)模板合成的银纳米簇的荧光对温度也有类似的响应效果。
3.5.2 石英晶体微量天平生物传感器 Zhou等[43]开发了一种新型石英晶体微量天平(QCM)生物传感器,以DNA / Ag NCs作为高效信号放大器,实现了对核酸进行高灵敏度和无标记的检测。用探针DNA对QCM进行修饰,使其特异性地捕获目标DNA。然后,将DNA模板化的Ag NCs组装起来,通过与DNA骨架相连的Ag+增强QCM传感器的灵敏度,然后氢醌诱导Ag NCs的还原形成。用TEM和AFM进一步证实了DNA模板化Ag NCs的形成。结果表明,在这种放大模式下,QCM传感器的频率响应高达87倍。频率响应与DNA浓度在0.6 nmol/L-30 nmol/L范围内呈线性关系,检出限为0.1 nmol/L。
3.5.3 智能逻辑生物传感器 作为信号转导器,DNA / Ag NCs优于有机染料和量子点,因为DNA /Ag NCs的使用不仅避免了DNA与信号指示剂的共价标记,而且更容易被引入DNA逻辑系统[44]。这些内在特性赋予DNA / Ag NCs在并行/级联逻辑门和计算电路的开发中具有前景的应用。
Zhang等[45]构造了基于银纳米团簇(Ag NCs)/氧化石墨烯(GO)的一系列逻辑电路以执行非算术功能,包括3位、4位和5位奇数/偶数检查,由此产生的设备可以区分0-31范围内的偶数和奇数十进制数。另外,这些装置可以在生物基质中稳定地执行它们的逻辑操作,表明基于Ag NCs / GO的系统可以在复杂的生物环境中操作。Fan等[44]结合GO对DNA模板化Ag NCs的猝灭能力和G-四链体增强的卟啉染料荧光强度,首次构建了无标签、无酶的2-to-1、4-to-2编码器和1-to-2解码器。此外,Lin等[46]首次将DNA / Ag NCs的多路复用器用作智能生物传感器,以高灵敏度识别大肠杆菌和金黄色葡萄球菌致病基因,在通用平台上集成多个DNA逻辑门,实现了先进的逻辑功能。该研究简单易用,为多分子器件的集成和智能诊断提供了一种有指导意义的方法。
4 DNA/银纳米簇介导的功能核酸生物传感器的应用
4.1 DNA/银纳米簇用于胞内成像
在过去的20年中,具有分子样能级的少数原子贵金属纳米团簇已经成为具有显著光电性质的新型荧光团[47]。由于DNA / Ag NCs易于合成的途径,良好的光稳定性和生物相容性以及高量子产率的优良特性,使其成为许多应用的有力候选者,特别是在生物成像方面[48]。
4.1.1 细胞成像 灵敏、特异的肿瘤细胞检测不仅对肿瘤的早期诊断,而且对肿瘤转移的研究具有重要意义。Ai等[49]利用AS1411为模板来合成银纳米团簇以发掘其潜在应用。在形成银纳米团簇后,AS1411仍然保持其结构并且能够与癌细胞中的核仁蛋白结合。同时,这种结合可以极大地增强银纳米团簇的荧光强度。该性质可直接用于HeLa细胞的生物成像。
Li等[50]受到真核细胞核中普遍存在的端粒含有重复DNA序列TTAGGG的启发,基于DNA /Ag NCs在细胞核内的原位荧光激活作用,开发了一种新颖、简便、无标记、特异性和通用的细胞核成像方法。NC-a模板化的Ag NCs和富含G的b序列将通过与DNA探针C-ab互补而聚集在一起。从而使Ag NCs的荧光激活。此外,研究者还根据端粒的重复序列TTAGGG设计了具有不同富含G序列的5个探针。结果表明,在C-ab存在下,所有五种探针均可作为Ag NCs的有效荧光增强剂,从而进一步验证了无荧光的Ag NCs可以通过端粒序列激活。然后用CEM细胞作为模型,流式细胞术测定显示无荧光的Ag NCs可以快速进入细胞并且在没有洗涤的简单孵育后,荧光被强烈激活,实现了原位细胞成像。
Yin等[51]提出了一种基于识别诱导的适配体构象改变从而使富含鸟嘌呤的DNA序列靠近DNA /Ag NCs,利用荧光增强效应来检测癌细胞的策略。DNA探针是发夹结构,由3'端的目标特异性适配体序列、富含鸟嘌呤的DNA序列和5'端的臂段(表示为识别探针)组成。另一个作为信号探针,包含一个用于Ag NCs模板合成的序列和一个与识别探针的ARM段互补的链接序列。适体与癌细胞的识别和结合迫使识别探针进行构象改变,进而启动识别探针的臂段与信号探针的连接序列之间的杂交。然后Ag NCs靠近富含G的DNA,从而增强荧光。实验结果表明,该策略采用特异性适配体sgc8c能对CCRF-CEM细胞进行特异性成像,在200 μL结合缓冲液中检测到低至150个CCRF-CEM细胞。
4.1.2 酶活检测 Huang等[52]构建了一种新型荧光报告基因,可以实现端粒酶活性的检测。此外,探针成功用于区分正常细胞和癌细胞,并监测用抑制模型药物治疗后的实时端粒酶活性反应。低荧光的H-Ag NCs探针设计含有3个功能性DNA支架(H序列):Ag NCs的模板序列polyC、T5环、9个碱基的互补序列。探针中的端粒DNA可以在端粒酶存在的情况下延伸,得到几个重复的TTAGGG序列,然后重复序列与探针中的互补序列杂交形成自发夹结构,由于富含G序列接近而导致 Ag NCs显着的荧光增强。基于荧光增强,可以检测和成像细胞内端粒酶活性。相反,如果细胞中端粒酶活性不足,底物不能延长,则无法观察到H-Ag NCs探针的荧光。
4.2 DNA/银纳米簇的抑菌作用
一定的时间内,银纳米抗菌剂可以使某些细菌、真菌或病毒等微生物的生长繁殖保持在必要水平以下。纳米银可通过3种机制破坏细菌膜:首先,从纳米银中释放出的Ag+可以在细菌膜中迁移,从而导致细胞死亡;其次,细胞质中的巯基或细胞质中的磷基团与Ag+之间的相互作用会导致活性氧(ROS)的产生,从而抑制DNA的复制能力。最后,细胞膜和银纳米之间的静电相互作用形成了可作为运输屏障的壁坑[53-54],从而使细胞出现功能障碍而死亡。
Yang等[55]首次使用支链DNA作为支架来调节银纳米团簇(super-Ag NCs)的形成,其空间结构被精确设计和构建。ssDNA的互补黏端的杂交合成分支的DNA / Ag NCs,实现了具有可调形状和臂长的超级Ag NCs,包括Y、X和(Y-X)形超级Ag NCs。超级Ag NCs表现出优异的抗菌性能,浓度为20 μmol/L的(Y-X)-super-NC可使细菌生长延迟至8 h。超级Ag NCs增强抑菌效果的原因可能是超级NCs提供更高浓度的Ag+并且其分支结构增加了Ag+与细菌接触以及与细菌表面黏附的机会。
Javani等[56]探讨了 DNA / Ag NCs在革兰氏阳性和革兰氏阴性细菌中的抗菌特性。在测试了9种具有不同序列和长度的寡核苷酸后发现,抗菌活性取决于所用寡核苷酸的序列。将Ag NCs按荧光颜色分组为蓝色、黄色和红色发射体,结果表明,蓝色发射体产生的抗菌活性较差,而黄色和红色发射体则具有与硝酸银相似的活性。并基于以上发现制备了三聚体结构,其中含有提供最佳抗菌活性的序列,其可以抑制亚微摩尔范围内革兰氏阳性和阴性细菌的生长。
5 总结与展望
本文介绍了基于DNA / Ag NCs开发的一系列生物传感器,总结了其在分析检测、体内成像及抑菌方面的应用。总的来说,DNA / Ag NCs介导的生物传感器可以检测生物体内特定酶的活性、某一段基因序列、重金属,真菌毒素等多种靶标分子,还可以基于细胞成像进行癌细胞以及酶活的检测。此外,DNA / Ag NCs的形状以及DNA模板序列对其抑菌作用都有影响。
目前对于DNA / Ag NCs生物传感器的研究仍处于探索阶段,如何有效的控制DNA / Ag NCs核的生长速率,提高材料的性能还需要继续研究。现有的研究在DNA / Ag NCs荧光的转变以及增强的机制还不够清晰,对DNA / Ag NCs的形貌调控和纳米尺寸上的排布还不够精准。另外,尽管银纳米簇具有许多优良的物理化学性质,如尺寸小,水溶性好,耐漂白性能强和生物毒性小等,但稳定性仍是限制其应用的主要因素之一,因此,合成稳定的银纳米簇也是未来研究工作中的重要课题之一。
虽然DNA / Ag NCs生物传感器已经拓展出成百上千种应用,但衍生出的检测方法主要基于对DNA模板的精巧设计,未来可在其他方面进一步探究。如与新型纳米材料、复合纳米材料等结合,赋予DNA / Ag NCs更多优良的性质并研究其杂化规律,建立新的传感方法。
DNA / Ag NCs在生物成像方面的应用仍处于起步阶段,在未来的研究中可以用其来感测细胞内活性物质如三磷酸腺苷(ATP)等。此外,还可以进一步利用其成像特性来进行药物筛选以及药物的定向投递,拓展其在医学领域的应用。
为了提高Ag NCs的抗菌效率,可以通过将Ag NCs与商品化抗生素结合来开发有效的抗菌材料。另外,Ag NCs的一个独特特性是它们显示出强发光性。这可以促进可追溯抗菌剂的开发,除了监视它们与细菌细胞壁的相互作用外,发光信号还可以用于检测其细胞内的积累。最后,还可以借助Ag NCs的发光来研究抗菌机理。银属于重金属,对细胞有与一定的毒害作用。在临床实验中,准确了解Ag+的释放量,可以最大程度地减少基于Ag的抗菌剂可能引起的细胞毒性,还需要对DNA / Ag NCs进行更加深入的研究,解决这些细节问题。

