抗逆元件及其在高效微生物细胞工厂构建中的应用进展
常瀚文 郑鑫铃 骆健美 王敏 申雁冰
(工业发酵微生物教育部重点实验室(天津科技大学)天津市工业微生物重点实验室 天津市微生物代谢与发酵过程控制技术工程中心天津科技大学生物工程学院,天津 300457)
微生物作为细胞工厂能够将各种原料转化生成药物、生物燃料、生物材料和化学品。但生产过程中,菌株常常面临各种胁迫条件,如极端的温度和pH、渗透压、氧化压力、有机溶剂、高浓度底物、有毒的产物或副产物等。在这些胁迫条件下,菌株的生长性能和代谢活力明显受到抑制,有时甚至完全丧失,这严重影响了其生产效率。因此,强化菌株的胁迫耐受性(也称鲁棒性)是提高微生物细胞工厂产量(Titer)、转化率(Yield)和生产速率(Productivity)的迫切需要。

图1 微生物在胁迫条件下的主要适应行为
提高菌株胁迫耐受性的传统方法主要包括驯化和物理化学诱变,但这些方法存在周期长、工作量大、人力和物力投入较大、定向性差、优良表型易丢失且难以进行水平转移等缺点。相比之下,利用现代分子生物学技术导入或改造抗逆元件是更为直接和有效的方法。大量研究表明,微生物胁迫条件下的适应行为非常复杂,与细胞的组成结构、生理性质、代谢途径和调控过程等密切相关,如细胞壁和细胞膜、细胞形态、外排泵、热激蛋白、DNA修复、氧化应激、相容性溶质、能量代谢、信号转导以及调控网络等(图1)。更值得注意的是,微生物的适应行为不仅依赖于具体的胁迫条件(如胁迫的种类和剂量),还表现出明显的菌种特异性(革兰氏阴性细菌、革兰氏阳性细菌、酵母和其他真菌等)和菌株特异性(同一个种的不同菌株有时表现出完全不同的适应行为),有时甚至会出现完全相反的情况,这大大提高了抗逆元件挖掘和应用的难度。目前,抗逆元件筛选的一般方法主要包括:(1)出发菌株和进化菌株的基因组测序分析;(2)出发菌株或进化菌株在无/有胁迫条件下的各种组学数据(如转录组学、蛋白质组学、代谢组学、脂质组学)分析;(3)天然耐受菌株的基因组文库构建(图2)。抗逆元件的应用领域也从典型的模式微生物逐步扩展到非模式微生物或工业生产菌株。本文将着重综述近年来抗逆元件及其在高效微生物细胞工厂构建中的应用实例,并探讨存在的机遇和挑战。

图2 抗逆元件筛选的主要方法和一般过程
1 细胞壁和细胞膜调控相关基因
表1汇总了近年来细胞壁和细胞膜调控相关基因在改善微生物胁迫耐受性及其生产性能方面的研究进展。
1.1 细胞壁合成和代谢相关基因
细胞壁是微生物与外界环境分隔的重要生物学屏障。UDP-N-乙酰胞壁酸(UNAM)是原核生物细胞壁的主要成分肽聚糖的合成前体之一,UDP-N-乙酰氨基葡萄糖烯醇式丙酮酸转移酶(MurA)是合成该物质的关键酶。研究者利用一株耐醇性能优良的植物乳杆菌(Lactobacillus plantarum)的已知基因组信息,通过Cre-lox系统在大肠杆菌(Escherichia coli)染色体上进行随机整合,构建整合型突变文库筛选乙醇抗逆基因。结果发现,植物乳杆菌来源的UDP-N-乙酰氨基葡萄糖-1-羧基乙烯基转移酶的murA2基因的过表达不仅增强了大肠杆菌MG1655对乙醇、正丁醇、异丁醇的耐受性,而且使乙醇工业生产菌株大肠杆菌KO11在发酵过程中保持良好活力,进而合成更多的乙醇[1]。
1.2 细胞膜合成和代谢相关基因
细胞膜是外界胁迫条件作用细胞的主要靶点,也为酶的组装和功能提供合适的基质。细胞膜脂的主要成分包括磷脂、鞘脂、甾醇和膜蛋白,其组成和结构的变化直接影响细胞膜的完整性(Integrity)、流动性(Fluidity)和通透性(Permeability)。近年来,细胞膜合成和代谢相关基因的操作在增强微生物胁迫条件下的耐受性,进而改善其生产性能方面表现出良好的效果。
美国爱荷华州立大学的Jarboe课题组分别通过磷脂酰丝氨酸合酶PssA[2]和顺反异构酶Cti的表达[3],证实了磷脂酰乙醇胺(PE)和反式不饱和脂肪酸含量的增加均能增强大肠杆菌MG1655对C8有机酸的耐受性,进而提高菌株的辛酸和总脂肪酸产量。其中,PssA过表达导致的耐受性增加主要与细胞膜完整性的增加、胞内pHi的提高(PE的增加抑制了C8进入细胞膜疏水核心区)、细胞膜和疏水核心区厚度的增大密切相关。而来源于铜绿假单胞菌(Pseudomonas aeruginosa)的Cti的表达增强了细胞膜刚性,对细胞膜厚度和完整性没有影响。PssA过表达最优菌株对酸处理木质纤维素过程中产生的相关抑制剂(如呋喃类化合物、弱羧酸类化合物和酚类单体等)也表现出更强的耐受性,进而产生更多的辛酸和总脂肪酸。两个工程菌株对其他生物产品的耐受性也明显增强,进而促进了更多产物的合成(如Cti表达菌株的苯乙烯产量比对照菌株提高了10.4%)。值得注意的是,它们对主要的工业生产胁迫条件也表现出更高的耐受性。
II型脂肪酸(FAS II)合成过程中4个相关基因fabA、fabB、fabD、fabF的过表达能提高大肠杆菌MDB5菌株的正丁醇耐受性。但这些基因在调控菌株的醇类物质耐受性方面表现出不同的效果。值得注意的是,脂肪酸合成速率重要限速酶FabD(丙二酸单酰CoA∶ACP转酰基酶)的拷贝数从1增加到3时,菌株的正丁醇耐受性明显增强,当拷贝数增大到4时,菌株的耐受性反而下降,这可能是因为蛋白过量表达容易引起聚集,从而降低其催化活性[4]。酰基-酰基载体蛋白硫酯酶负责水解饱和或不饱和脂肪酸上的酰基-ACPs产生游离脂肪酸,因此,对胞内脂肪酸合成的通量具有调控作用。但不同来源的硫酯酶具有不同的底物偏好性。地芽孢杆菌(Geobacillussp.)Y412MC10的硫酯酶(GeoTE)主要水解中等链长、不饱和脂肪酸的酰基ACPs。加州月桂(Umbellularia californica)的硫酯酶(BTE)主要水解饱和C12-酰基ACPs,也能水解不饱和的C12、饱和或不饱和的C14-酰基ACPs。研究者将上述底物偏好性不同的硫酯酶分别导入大肠杆菌RL08ara后发现,GeoTE单独表达菌株对游离脂肪酸表现出最强耐受性,这与其具有更好的细胞完整性和较低的不饱和脂肪酸含量密切相关。该菌株培养8 h后能合成更多的游离脂肪酸,但培养24 h后,脂肪酸产量反而低于BTE单独表达菌株和GeoTE/BTE共表达菌株,这说明存在着其他代谢或者调控障碍[5]。乙酰辅酶A羧化酶是脂肪酸合成过程中的关键酶,其突变体Acc1S1157A在酿酒酵母BY4741的表达使菌株的辛酸最小致死浓度提高1倍。这种耐受性的增强与脂肪酸链平均长度增大和脂肪酸含量变化(如硬脂酸和油酸含量的增加、棕榈酸和棕榈油酸含量的下降)共同导致的细胞完整性增加密切相关。此外,突变菌株对其他高价值生物产品和各种膜抑制剂的耐受性也明显增强[6]。2-酰基-甘油磷酰乙醇胺酰基转移酶/酰基-ACP合成酶(Aas)是催化中链脂肪酸生成中链乙酰-ACPs,以及该中间物生成2-酰基-甘油磷酰乙醇胺(2-acyl-GPE)的关键酶,对于中链脂肪酸在细胞膜上的插入具有重要作用。大肠杆菌ΔfadD和ΔfadDBTE表达菌株中aas基因的敲除提高了菌株的中链脂肪酸耐受性,进而提高了菌株合成中链脂肪酸的水平。这是因为aas的敲除减少了游离中性脂肪酸在细胞膜磷脂的插入,使得胁迫下的细胞磷脂组成能恢复到正常水平。之后通过敲除aas和表达fadR的组合操作,中链脂肪酸的产量比出发菌株(大肠杆菌ΔfadDBTE)提高了约50%[7]。OLE1编码的Ole1p(Δ-9-脂肪酸去饱和酶)催化饱和脂肪酸(如C16∶0和C18∶0)的去饱和反应。它的过表达提高了酿酒酵母对醋酸等各种胁迫物质的耐受性,但不能改变菌株对高温和低温的耐受性。该蛋白主要通过组成性激活高渗透压甘油(High osmolarity glycerol,HOG)通路中的Hog1激酶,促进质子外排、增强细胞膜完整性和降低胞内H2O2含量等方式提高菌株的胁迫耐受性[8]。非直链脂肪酸(如环丙烷脂肪酸和支链脂肪酸)含量的多少直接影响细胞膜的流动性。研究发现,环丙烷脂肪酸合成酶(CFA)的表达通过提高环丙烷脂肪酸(cycC19∶0)及其前体物质油酸的含量,降低细胞膜流动性,增强了乳酸乳球菌(Lactococcuslactis)亚种TOMSC161的冷冻和干燥胁迫耐受性[9]、长双歧杆菌(Bifidobacterium longum)JDY1017dpH和短双歧杆菌(Bifidobacterium breve)的耐酸性[10]。
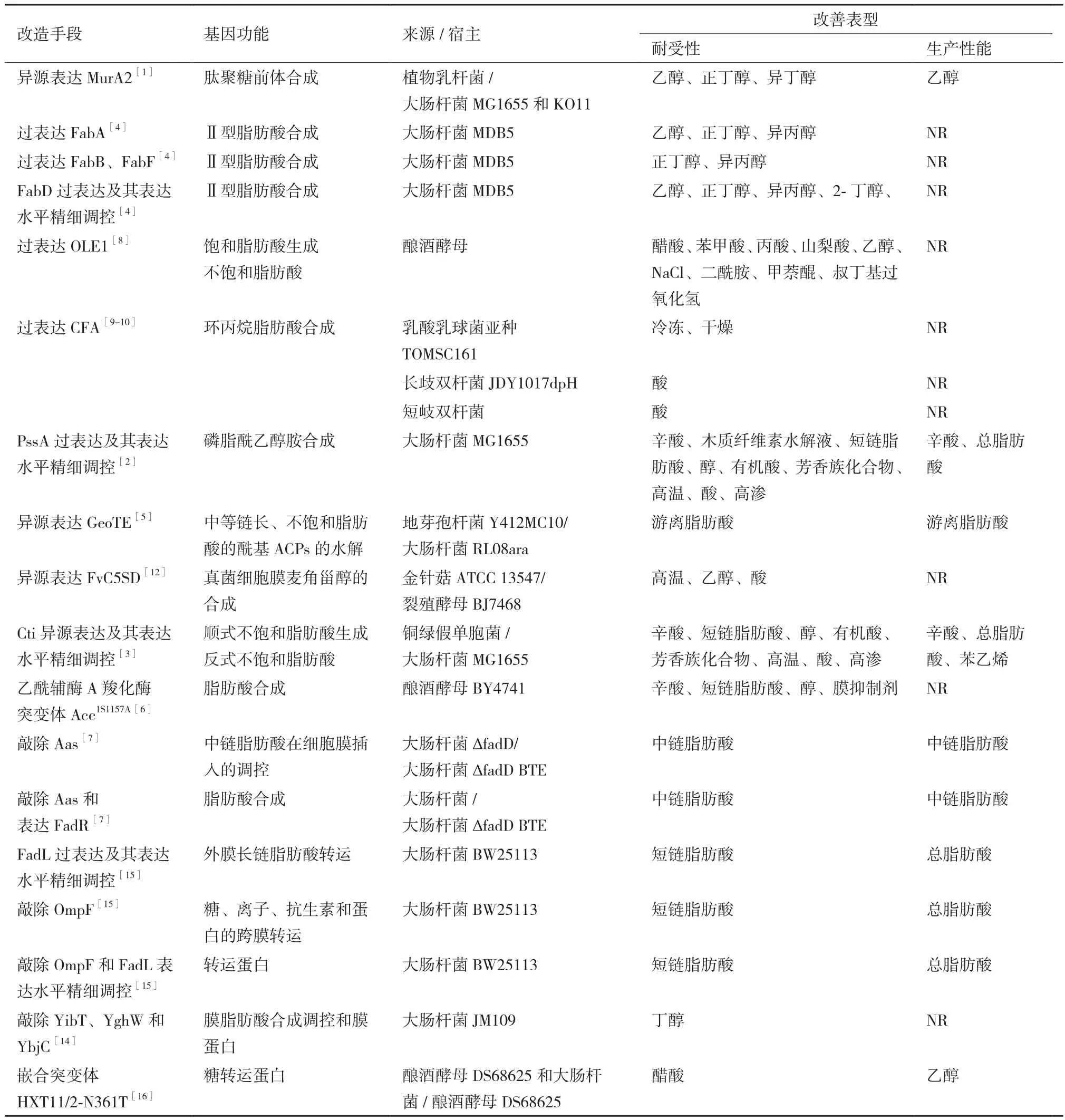
表1 细胞壁和细胞膜调控相关基因改善宿主生物耐受性和生产性能的小结
甾醇类物质是影响细胞膜刚性的重要组分。真菌麦角甾醇合成途径的最后5步反应的关键酶(C-24甾醇甲基转移酶Erg6、C-8甾醇异构酶Erg2、C-5甾醇去饱和酶Erg3、C-24甾醇还原酶Erg4和C-22甾醇去饱和酶Erg5)编码基因的敲除通过降低细胞膜的刚性,增强了酿酒酵母BY4742对环乙酰亚胺的敏感性,而这种敏感性可通过外源添加麦角甾醇得到修复[11]。金针菇(Flammulina velutipes)ATCC 13547的C-5甾醇去饱和酶导入裂殖酵母(Schizosaccharomyces pombe)BJ7468后,通过增大细胞膜中麦角甾醇和油酸的含量(约1.5倍)增强了菌株对高温、乙醇和低pH的耐受性[12]。
1.3 膜蛋白
大肠杆菌中的Mla转运途径通过从外膜小叶中移除磷脂来维持细胞膜的不对称性,进而维持细胞膜的完整性。MlaD是Mla途径的周质组成部分,拥有一个哺乳动物细胞侵袭(Mammalian cell entry,MCE)结构域。通过生物信息学分析,研究者在大肠杆菌中发现了另外两个具有MCE结构的操纵子PqiABC和YebST。MlaD单独敲除导致菌株对SDSEDTA表现出敏感性,而在Δmla上同时敲除上述两个操纵子才能使得菌株对SDS-EDTA变得敏感。这种敏感性通过PqiBC的回补能恢复,而YebT由于毒性,其回补并不能获得相同的效果。因此,PqiABC和YebST具有和Mla转运途径类似的功能,对于维持细胞膜完整性具有重要作用[13]。通过比较大肠杆菌耐受菌株和野生型菌株在丁醇胁迫下的转录表达谱发现,野生型菌株中yibT和yghW(影响细胞膜脂肪酸合成)和ybjC(假定内膜蛋白)的转录水平显著下调,这3个基因的敲除均能增强了菌株的丁醇耐受性[14]。
外膜蛋白OmpF作为三聚体存在于细胞外膜中,调控糖、离子、抗生素和蛋白的跨膜转运。FadL是一个外膜长链脂肪酸转运蛋白,主要负责外源疏水性长链脂肪酸进入胞内,尤其是棕榈酸(C16∶0)和油酸(C18∶1),但不能和短链脂肪酸( 外排泵是一类通过质子动力将有毒分子排到胞外的膜转运蛋白。革兰氏阴性菌中的外排泵通常由3个蛋白组成:负责底物识别和质子交换的内膜蛋白、外膜通道蛋白、用于连接内膜和外膜并维持其稳定性的周质融合蛋白。目前,报道较多的外排泵主要包括恶臭假单胞菌(Pseudomonas Putida)的TtgABC、TtgDEF、TtgGHI和SrpABC和大肠杆菌的AcrAB-TolC。它们都属于耐药结节分化(Resistance-Nodulation-Division,RND)家族的疏水/两亲的外排泵(Hydrophobe/amphiphile efflux,HAE1),能够将有机溶剂或者亲脂化合物排除胞外。但不同外排泵的底物特异性明显不同,如AcrB的底物识别范围较广(包括洗涤剂、抗生素和有机溶剂),而TtgB的底物特异性较高。表2汇总了近年来外排泵在改善微生物胁迫耐受性及其生产性能方面的研究进展。 2011年,Dunlop等[17]从已测序的细菌基因组中挖掘所有HAE1泵的信息,利用生物信息学技术通过对比TtgB的底物识别区域筛选出43个潜在的外排泵基因,将它们分别导入大肠杆菌DH1的AcrAB敲除菌株后,分析工程菌株在不同胁迫下的生长性能。结果发现,增强菌株耐受性的优良外排泵来源于完全不相干的细菌,且效果完全不同。耐受性增强的菌株表现出更好的生产能力,如泊库岛食烷菌中YP_692684的表达增强了大肠杆菌的柠檬烯耐受性(约8%),进而提高了柠檬烯的产量(约60%)。恶臭假单胞菌P8(ATCC 45491)的SrpABC中SrpB发挥着最主要的作用,其在大肠杆菌K12 MG1655单独表达后改善菌株正丁醇耐受性的效果与三基因共同表达类似,这可能是因为SrpB是一个跨膜蛋白,它的过表达能够帮助稳定细胞膜,从而提高菌株的耐受性[4]。 研究者通过对酿酒酵母BY4741在不同链烷烃胁迫(如壬烷(C9)、癸烷(C10)和十一烷(C11)和十二烷(C12))下的转录组学数据和过表达菌株的耐受性能分析,发现外排泵Snq2p和Pdr5p通过降低胞内的烷烃浓度增强了菌株对C10和C11的胁迫耐受性。与革兰氏阴性菌中的RND外排泵利用质子或钠离子梯度作为能量不同,外排泵Snq2p和Pdr5p属于酵母多效性耐药蛋白亚家族(Pleiotropic drug resistance(PDR)protein subfamily) 的 ATP偶联盒超家族外排泵(ATP-binding cassette,ABC),主要利用ATP作为能量。尽管组学数据表明4个外排泵基因(YOR1、SNQ2、PDR5和PDR15)的表达水平在C9和C10胁迫条件下被诱导,但它们的过表达并不能提高菌株对C9的耐受性。YOR1和PDR15的表达均不能提高菌株对C10和C11的耐受性。这可能是因为不同的外排泵表现出不同的底物结合效率,也暗示着在烷烃胁迫下,酿酒酵母中的其他的适应行为(如一般压力响应、细胞膜的调整)发挥着更为重要的作用[18]。采取类似的研究思路,Foo等[19]发现MdlB(假定的ABC转运蛋白超家族的耐多药转运体亚基)是提高大肠杆菌异戊烯醇耐受性的抗逆元件。耐受性能更强的MdlB过表达菌株合成异戊烯醇的产量提高了12%,但对其他醇类物质(如乙醇、异丙醇、正丁醇、异丁醇、正戊醇、异戊醇)的耐受性没有明显改善。 2015年,研究者发现大肠杆菌外排泵AcrAB敲除菌株中的基因回补后能提高菌株对多个α-烯烃(如苯乙烯、1-己烯、1-辛烯、1-壬烯)的耐受能力,进而提高菌株生产α-烯烃(如苯乙烯)的能力。AcrAB和AcrAB-TolC的过表达能提高野生型大肠杆菌的1-己烯耐受性,但TolC的单独过表达则没有效果。对负责底物结合的内膜蛋白AcrB进行随机突变后发现,6个氨基酸位点的突变增强了菌株的1-己烯耐受性,且突变位点之间存在一定的协同效应。AcrB突变体的表达能略微提高菌株的胆盐耐受性,但其对苯乙烯耐受能力没有明显影响[20]。类似的,通过定向进化和胁迫条件下的筛选,研究者获得了能提高大肠杆菌正辛烷和α-蒎烯耐受性[21]或者正丁醇、异丁醇和其他直链醇(直到正庚醇)耐受性[22]的AcrB优良突变体。其中,Foo和Leong认为突变体拓宽了底物进入通道,改变了底物外排动力学特性,促进了AcrB与外膜通道蛋白TolC的组装,进而增强了菌株耐受性[21]。Fisher等[22]发现,AcrB优良突变体能提高野生型大肠杆菌MG1655的正丁醇耐受性,但不能提高大肠杆菌MG1655ΔacrB的耐受性,这可能是因为野生型AcrB的缺失导致AcrB突变体同型三聚体无法形成,从而无法发挥外排泵的正常功能。 表2 外排泵改善宿主生物耐受性和生产性能的小结 2016年,Boyarskiy等[23]利用大肠杆菌中能够负向响应外排泵AcrB表达水平的内源启动子(葡萄糖酸激酶的野生型启动子PgntK)组成的负向反馈调节系统,实现了优良外排泵突变体AcrBv2的表达水平的自动优化,通过减少外排泵过量表达对菌体的毒害作用,提高了大肠杆菌BW25113的丁醇耐受性(约40%)和丁醇产量(约35%)。 热激蛋白(Heat shock proteins,HSPs)主要负责蛋白的初期折叠、跨膜转运、寡聚蛋白结构的组合或分解、促进不稳定蛋白的降解以阻止其聚集等。当细胞面临胁迫条件时,大量热激蛋白被诱导产生或者表达水平明显上调,从而阻止蛋白聚集,并协助受损蛋白的重新折叠。表3汇总了近年来热激蛋白在影响微生物胁迫耐受性及其生产性能方面的研究进展。 热激蛋白GroESL由GroEL(单体为60 kD)和辅因子GroES(10 kD左右)组成。研究发现,大肠杆菌中GroEL-GroES参与到约300个蛋白的折叠和再折叠,其中,GroEL能和约250个不同的蛋白相互作用,包括13个必需蛋白[24],而GroEL缺陷的大肠杆菌中30%左右的蛋白会被错误折叠[25]。 Suo等[26-27]先后发现,内源的GroESL的过表达能分别提高酪丁酸梭菌(Clostridium tyrobutyricum)ATCC 25755 的丁酸耐受性[26]和拜氏梭菌(Clostridium beijerinckii)ATCC 25755对木质素水解产生的各种抑制物的耐受性,包括酚类化合物(如阿魏酸、p-香豆酸、香草醛)、呋喃类衍生物(如糠醛和5-羟甲基糠醛)和弱酸(如甲酸和乙酰丙酸)。利用游离细胞和固定化细胞作为催化剂进行补料分批发酵时,过表达GroESL的酪丁酸梭菌的丁酸产量比野生型菌株分别提高了28.2%和15.2%。过表达GroESL的拜氏梭菌能够在分别利用玉米秸秆和稻草秸秆水解液作为底物的发酵体系中保持活力,其丁酸产量比野生型菌株分别提高了26.5%和19.4%。此外,GroESL在大肠杆菌BL21中的过表达提高了菌株对产物藤黄酚的耐受性,且存在一个最适表达水平。耐受性能增强的菌株能获得更高的藤黄酚产量。这可能是因为GroESL的表达能调控σ32(该因子能控制热激蛋白的转录水平,负责大肠杆菌对各种胁迫条件产生响应)的合成和活性[28]。 2015年,研究者将丙酮丁醇梭菌(Clostridium acetobutylicum)ATCC 824中的groES和groEL导入拜氏梭菌NCIMB 8052后发现,重组菌株对阿魏酸的耐受性明显增强,其在阿魏酸胁迫条件下的丁醇产量比野生型菌株提高了15%[29]。与内源的或者来源于普通微生物的GroESL相比,来源于极端微生物的元件因为在严苛环境下经过了长时间的驯化和进化而表现出更好的效果。如来源于极端耐辐射微生物-乌鲁木齐奇异球菌(Deinococcus wulumuqiensis)R12的GroESL在改善丙酮丁醇梭菌ATCC 824的各种胁迫耐受性上的效果要比内源GroESL更为显著。糠醛胁迫条件下,表达极端微生物来源的GroESL菌株的丁醇产量最高(9.5 g/L),其次是表达内源的GroESL菌株(8.8 g/L),二者比对照菌株分别提高了35.7%和25.7%[30]。但研究者也发现,不同来源的热激蛋白在不同宿主表达时具有不同的效果。如对于革兰氏阴性菌大肠杆菌,内源groESL的过表达提高了菌株的乙醇耐受性,但却不能增强高温耐受性;导入溶剂耐受菌-恶臭假单胞菌的groESL能明显增强菌株在47.5℃(OD600提高约69%)和5%乙醇(OD600提高约64%)胁迫下的生长性能;导入腾冲嗜热厌氧菌(Thermoanaerobacter tengcongensis)MB4的groESL则降低了菌株的生长性能和胁迫耐受性。对于革兰氏阳性菌丙酮丁醇梭菌,内源groESL的过表达只是略微促进了丁醇的合成,但并不能减轻玉米芯水解液对菌株生长的抑制作用;导入腾冲嗜热厌氧杆菌的groESL显著提高菌株在玉米芯水解液胁迫条件下的生长性能(OD600提高约4倍),进而合成更多的丁醇;导入在恶臭假单胞菌的groESL则对丙酮丁醇梭菌在玉米水解液下的菌体生长和丁醇生产无明显影响。这种现象可能是因为革兰氏阳性菌(丙酮丁醇梭菌、腾冲嗜热厌氧杆菌)和阴性菌(恶臭假单胞菌、大肠杆菌)的分子机制和生理背景之间存在不同的匹配方式[31]。 大肠杆菌里的DnaK由一个高保守的N-端ATPase域(44-45 kD)和一个C端结构域组成,结构域中的孔道结构为蛋白折叠提供场所。DnaK需要与辅分子伴侣DnaJ(Hsp40的同系物)和GrpE(核苷酸交换因子)共同作用完成DnaK的循环,因此,三者形成的复合物DnaK-DnaJ-GrpE能帮助正常生长条件下蛋白的初期折叠,且在损伤蛋白的重新折叠中发挥着重要作用[32]。 表3 热激蛋白影响宿主生物耐受性和生产性能的小结 2019年,Vandani等[33]从嗜碱芽孢杆菌(Bacillus halodurans)Guj1中克隆得到dnaK并预测了其三维结构,DnaK的导入显著提高大肠杆菌对盐和碱的耐受性。内源和来自于大肠杆菌JM109的DnaK分别在乳酸乳球菌NZ9000中进行表达后,均能显著提高菌株的耐高温性能。尽管大肠杆菌DnaK在乳酸乳球菌中的表达量较低且并不能影响乳酸乳球菌中内源DnaK蛋白的表达量,但它在改善菌株高温耐受性上的效果更明显,并能同时提高菌株对多种非生物压力的耐受性。高温(40℃)下,对照菌株几乎不能生长和产生乳酸,但表达大肠杆菌DnaK的重组菌株仍能表现出良好的发酵性能,乳酸的产量和生产速率达到了对照菌株30℃下的水平[34]。 极端耐辐射微生物-乌鲁木齐奇异球菌R12中DnaK在丙酮丁醇梭菌ATCC 824的表达增强了菌株对丁醇、糠醛、氧化压力和酸的耐受性。糠醛胁迫条件下,DnaK表达菌株的丁醇产量比对照菌株提高了52.8%。值得注意的是,内源的DnaK在丙酮丁醇梭菌的过表达反而使菌株失去了生长活力[30]。类似的,来源于热泉的短小芽孢杆菌(Bacillus pumilus)B3[35]和嗜酸和嗜热极端微生物-酸热环酸芽孢杆菌(Alicyclobacillus acidoterrestris)DSM 3922T[36]中的DnaK的表达均显著增强大肠杆菌对酸或高温的耐受性。恶臭假单胞菌KT2442-R2中DnaK的点突变(445位精氨酸突变为脯氨酸)通过提高内源σ32和其他热激蛋白的表达增强了菌株对甲苯的耐受性[37]。但也有报道认为,单独表达中链球菌(Streptococcus intermedius)NCDO2227的DnaK并不能完全回补大肠杆菌内源DnaK敲除引起的热敏感性,只有导入完整的DnaK系统(DnaK-DnaJ-GrpE)才能使菌株的耐受性完全恢复[38]。类似地,研究者发现来源于嗜热微生物-热葡糖苷酶地芽孢杆菌(Parageobacillus thermoglucosidasius)DSM 2542的DnaK-DnaJ-GrpE复合物能显著改善核黄素生产菌株枯草芽孢杆菌(Bacillus subtilis)446的高温和渗透压(10% NaCl)耐受性,进而提高菌株的核黄素产量[39]。 小分子热激蛋白是存在于所有生物体的超级家族,其结构要比其他的热激蛋白更具有多样性。小分子热激蛋白是不依赖于ATP的分子伴侣,能够阻止非天然蛋白的聚集,帮助部分折叠已变性的蛋白,阻止由于胁迫条件造成的不可逆的蛋白聚集。 小分子热激蛋白Hsp20(BL0576)在长双歧杆菌NCC2705的过表达提高了菌株的耐盐和耐高温性能,进而增强了菌株在高温和盐胁迫下的产酸性能。此外,该小分子热激蛋白的过表达还能提高长双歧杆菌对胆盐、低pH和低温(4℃)的耐受性[40]。秀丽隐杆线虫(Caenorhabditis elegans)中一个分子量17 kD的小分子热激蛋白(CeHSP17)导入大肠杆菌后菌株能在50℃下生长,这主要是因为该热激蛋白能维持高温下细胞外膜的稳定性,从而保护细胞质内蛋白[41]。类似的小分子热激蛋白还有集胞藻属(Synechocystis)的 Hsp17[42]和结核分枝杆菌(Mycobacterium tuberculosis)的 Hsp16.3[43]。 2019年,研究者发现来源于嗜热微生物-热葡糖苷酶地芽孢杆菌(Parageobacillus thermoglucosidasius)DSM 2542的两个热激蛋白Hsp20-3、Hsp20-2能显著改善核黄素生产菌株枯草芽孢杆菌446的高温和渗透压(10% NaCl)耐受性。39℃和43℃下,两个工程菌株的核黄素产量比对照菌株提高了23%-66%且发酵周期进一步缩短。这一结果与工程菌株在对应温度下表现出更高的细胞活力是相符的[39]。热激蛋白 IbpA在大肠杆菌DH1(ATCC 33849)的过表达提高了菌株的异戊烯醇耐受能力,进而提高了菌株的异戊烯醇产量(约16%)[19]。嗜热微生物-腾冲嗜热厌氧杆菌MB4中的3个热激蛋白TTE2469(编码泛素)、GroS2(属于Hsp10家族)和IbpA(属于Hsp20家族)能够提高酿酒酵母INVSc1的高温耐受性,使得菌株的发酵温度范围拓展到28-35℃,发酵周期缩短为72 h,β-香树脂醇的产量提高约28%。这些热激蛋白的调控机制主要涉及细胞壁完整性的维持、海藻糖的积累和能量产生途径的激活[44]。酪丁酸梭菌ATCC 25755的多个热激蛋白(grpE,dnaJ,htpG)的表达水平在丁酸胁迫后均显著上调,且表达水平与丁酸浓度呈现出正相关性。分别构建过表达菌株后发现,htpG的过表达能提高菌株的丁酸耐受性,grpE没有效果,而dnaJ的过表达呈负向作用[26]。 微生物在面临外界胁迫时胞内的DNA会受到不同程度的损伤,如双链结构的断裂和破坏、碱基或碱基对被切除或替换等,由此引发细胞周期延迟或阻滞甚至细胞死亡等。因此,DNA修复是细胞应对胁迫条件的重要生理过程。天津科技大学骆健美课题组通过分析简单节杆菌CGMCC14539在亚致死乙醇浓度下的蛋白质组学数据和过表达菌株的耐受性能,确定了DNA重组/修复蛋白RecA和DNA解旋酶UvrD是增强菌株有机溶剂耐受性的抗逆元件[45]。干酪乳杆菌(Lactobacillus casei)的DNA修复蛋白RecO在乳酸乳球菌NZ9000中的异源表达显著提高了菌株对酸、盐和氧化胁迫的耐受性,但却不能增强菌株对乙醇和高温胁迫的耐受性。3%NaCl胁迫下,具有更强耐盐性能的RecO表达菌株表现出更好的乳酸发酵性能[46]。 正常生理条件下,机体中的各种抗氧化防御机制可以使得胞内氧化还原水平维持在一定的动态平衡。而受到胁迫条件时,这种平衡被打破从而使细胞向氧化损伤破坏的方向发展,这种现象被称为氧化应激。目前,生物体内抗氧化防御系统主要包括抗氧化酶系统(如过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶和抗坏血酸过氧化物酶等)、小分子抗氧化剂(如半胱氨酸、谷胱甘肽、维生素C等)。 大肠杆菌氧化应激响应中参与损伤修复的铁氧化还原蛋白-NADP还原酶Fpr的过表达增强了大肠杆菌DH1(ATCC 33849)的异戊烯醇耐受性,进而提高了菌株的异戊烯醇产量[20]。天津科技大学骆健美课题组通过超氧化物歧化酶SOD和过氧化氢酶KatG的过表达,提高了简单节杆菌(Arthrobacter simplex)CGMCC14539的有机溶剂的耐受性[45]。酿酒酵母BY4741中的线粒体过氧化氢酶编码基因cta1、胞质过氧化氢酶编码基因ctt1、γ-谷氨酰半胱氨酸合成酶编码基因gsh1、谷胱甘肽合成酶编码基因gsh2以及谷胱甘肽还原酶编码基因glr1的过表达对菌株胁迫耐受性的影响表现出明显的基因特异性和胁迫特异性。其中,cta1提高菌株5-羟甲基糠醛(HMF)耐受性的效果优于ctt1,但二者提高菌株糠醛耐受性的效果类似;glr1的过表达略微提高了菌株对HMF的耐受性但显著提高了菌株对糠醛的耐受性;gsh1的过表达对菌株的HMF耐受性无明显影响但却显著提高了菌株的糠醛耐受性;gsh2的过表达对菌株的HMF和糠醛耐受性均无明显影响。此外,氧化压力调节蛋白Yap1的突变也能提高菌株的糠醛和 HMF 耐受性[47]。 研究者通过比较柠檬烯耐性突变株FM003和大肠杆菌BW25113的全基因组序列发现,耐性突变株的烷基氢过氧化物酶AhpC上发生了一处点突变(L177Q)。敲除和回补实验证明,AhpCL177Q突变体能增强菌株对柠檬烯及其氧化物(主要是柠檬烯氢过氧化物)的耐受性[48]。来源于乳酸乳球菌的NADH氧化酶编码基因noxE在酿酒酵母BY4741中的表达提高了菌株的耐盐能力。与对照菌株相比,工程菌株在有氧发酵条件下表现出更少的甘油合成、更快的葡萄糖消耗和菌体生长,进而合成更多的乙醇。NADH氧化酶的过表达降低了胞内的ROS水平(约10%),改变了胞内乙醇和甘油代谢、硫胺素合成、细胞死亡等多个途径相关基因的转录水平,并通过上调全局转录因子HAP4的表达水平影响了其他途径(如氧化磷酸化、锌代谢、己糖转运蛋白)相关基因的转录水平,但却并没有激活高渗透压甘油途径。综上所述,NADH氧化酶的过表达改变了菌株发酵过程的胞内代谢,从而增强了其胁迫耐受性[49]。 相容性溶质是一类高度水溶性、不带静电荷、没有活性基团,不影响重要细胞活动和代谢的有机小分子,其在胞内的大量积累不会影响蛋白质、核酸等生物大分子的功能,且能够维持细胞内外的渗透平衡。因此,胞内相容性溶质的变化是微生物应对胁迫条件的重要适应行为。表4汇总了近年来相容性溶质调控相关基因在影响微生物胁迫耐受性及其生产性能方面的研究进展。 海藻糖是一类广泛存在于真菌、细菌、昆虫和植物中的非还原性糖,由两分子葡萄糖基组成(α-D-吡喃葡糖-1-1α-D-葡萄糖苷)。细菌中常见的海藻糖合成途径有3条,第一条为TPS/TPP途径,otsA编码的6-磷酸海藻糖合成酶(TPS)催化葡萄糖生成6-磷酸海藻糖,再通过otsB编码的6-磷酸海藻糖酯酶(TPP)去磷酸化生成海藻糖,该途径最早被发现也存在最为广泛。第二条为TS途径,该途径由海藻糖合成酶(TreS)催化,将麦芽糖异构化为海藻糖。第三条为 TreY/TreZ途径,麦芽糖糊精首先通过麦芽寡糖基海藻糖合成酶(TreY)转糖基化为麦芽寡糖基海藻糖,之后被麦芽寡糖基海藻糖水解酶(TreZ)水解释放出海藻糖。 表4 相容性溶质调控相关基因影响宿主生物耐受性和生产性能的小结 天津科技大学骆健美课题组系统分析了简单节杆菌CPCC 140451在乙醇胁迫下的胞内海藻糖、甘油、脯氨酸、谷氨酸4种相容性溶质的含量变化情况。亚致死浓度下,随着乙醇浓度的增大,海藻糖和甘油的含量增加而脯氨酸和谷氨酸的含量减少。海藻糖合成基因otsA、otsB和treS的过表达均能提高简单节杆菌的乙醇和甲醇耐受性,其中,otsB的效果优于treS和otsA,这一结果与菌株的胞内海藻糖含量是一致的。乙醇耐受性能更强的工程菌株在高浓度底物和乙醇的转化体系中表现出更好的细胞活力,这使得其生产性能明显改善。此外,简单节杆菌中这3个海藻糖合成相关基因的表达也能提高大肠杆菌的多种胁迫耐受性。海藻糖的保护机制与维持更好的细胞完整性和细胞稳定性、更强的活性氧簇清除能力和更高的能量水平密切相关[50]。大肠杆菌otsBA操纵子的过表达不仅改善了菌株在含有精制甘油的合成培养基时的发酵性能,而且提高了菌株直接利用粗甘油发酵得到的产物水平。这种发酵性能的改善与菌株对疏水性产物β-胡萝卜素、底物粗甘油中单一杂质粗脂肪酸、过氧化叔丁醇以及粗甘油混合物表现出更强的耐受性密切相关[51]。嗜酸丙酸杆菌(Propionibacterium acidipropionici)CGMCC 1.2232的基因组测序结果表明,该菌株含有两个假定的海藻糖合成途径OtsA-OtsB和TreY-TreZ。通过敲除菌株构建和海藻糖含量分析,研究者发现在嗜酸丙酸杆菌的海藻糖合成途径中OtsA比TreY发挥着更为重要作用。与野生型菌株相比,海藻糖含量提高的otsA过表达菌株的丙酸耐受性最高,丙酸转化率提高了11%[52]。研究者在乳酸乳球菌NZ9000中分别共表达乳酸乳球菌内源基因TrePP、β-pgm和来自费氏丙酸杆菌(Propionibacterium freudenreichii)的海藻糖磷酸酯酶otsB三个基因,以及大肠杆菌的otsBA操纵子。结果发现,NZ9000(pNZtpo)菌株和NZ9000(pNZotsBA)在pH 3胁迫下的存活率相当,均高于对照菌株。在低温(4℃)和高温(45℃)的条件下,菌株存活率按从高至低的顺序均为NZ9000(pNZotsBA)>NZ9000(pNZtpo)>对照菌株。这种耐受性的增强与其他的一般压力响应无关(如热激蛋白和DNA损失),而是直接与海藻糖的存在有关,但海藻糖含量增加的工程菌株并没有对冷冻和干燥表现出更强的耐受性[53]。 酵母中尿苷二磷酸葡萄糖(UDPG)依赖的海藻糖合成途径(系统I)主要包含tps1编码的6-磷酸海藻糖合成酶TPS、tps2编码的6-磷酸海藻糖酯酶TPP,对TPS1和TPS2具有调控作用的TPS3,以及tsl1编码的海藻糖合成蛋白复合体TSL1。海藻糖的水解主要受到nth1和nth2基因编码的中性水解酶和ath1基因编码的酸性水解酶的调控。 tps1在酿酒酵母10151中的过表达增强了菌株的耐高温性,进而提高了菌株在38℃下的发酵性能。过表达菌株发酵24 h时的乙醇产量与其在30℃下的水平相当,而对照菌株的乙醇产量急剧下降,仅为过表达菌株的45%[54]。ATH1在酿酒酵母TCY1中表达活性的下降增强了菌株的乙醇耐受性,缩短了发酵周期,提高了乙醇的生产速率[55]。 与单个基因的操作相比,多基因的组合操作在调控海藻糖含量上表现出更明显的优势。2016年,研究者在酿酒酵母BCRC 21685(SC)中构建tps1过表达菌株SCT和tps1过表达nth1敲除菌株SCTΔN。无/有乙醇胁迫的条件下,SCTΔN菌株的海藻糖含量最高。当培养基中的葡萄糖浓度超过15%时,SCTΔN菌株表现出最好的发酵性能,这与该菌株具有最强的乙醇和葡萄糖耐受性相关[56]。分别在酿酒酵母ZS中构建tps1基因过表达菌株ZSptps1,ath1缺失菌株ZSΔath1和tps1基因过表达ath1缺失突变株ZSpTΔA。结果发现,在葡萄糖含量为270 g/L的浓醪发酵过程中,尽管所有菌株的发酵速率都有所降低,但3株工程菌株的发酵性能(发酵速率、乙醇产量和葡萄糖消耗速率)均明显高于野生型菌株。这种发酵性能的改善与工程菌株对高渗和乙醇具有更强的耐受性密切相关,而菌株的耐受性与其胞内海藻糖含量是一致的[57]。研究者在酿酒酵母FY834分别构建了nth1,nth2,ath1三基因敲除菌株nth1Δnth2Δath1、tps1过表达的三基因敲除菌株和tps2过表达的三基因敲除菌株。在乙醇、高温和冷冻的胁迫条件下,积累更高海藻糖含量的工程菌株的比生长速率均高于野生型菌株,其中,tps1过表达的三基因敲除菌株的耐受性最强。但海藻糖的积累并不能提高菌株对氧化胁迫的耐受性[58]。 依赖腺苷二磷酸葡萄糖(ADPG)的海藻糖合成途径(系统II)是面包酵母中海藻糖积累的第二条重要途径,主要与麦芽糖利用有关。酵母中的麦芽糖代谢受到麦芽糖渗透酶、麦芽糖酶和调节蛋白的调节,其中,麦芽糖酶比麦芽糖渗透酶发挥着更为重要的作用。研究者将麦芽糖酶编码基因maL62和6-磷酸海藻糖合成酶基因tps1分别导入面包酵母BY14(B)和它的nth1敲除菌株(B-N)。结果发现,对于不同遗传背景的菌株,maL62的单独过表达可通过增加tps1的活力提高胞内的海藻糖含量,但其效果不如tps1的单独过表达。在预发酵冷冻和长期冷冻的两种胁迫条件下,maL62的过表达增强细胞耐受性的效果与tps1过表达类似,这说明maL62过表达导致的细胞冷冻耐受性的提高不仅仅与海藻糖合成有关,还可能涉及到其他途径(如热激蛋白Hsp90)。所有的工程菌株中,同时过表达maL62和tps1且敲除nth1的菌株(B-N+T+M)具有最强的冷冻耐受性,这与其含有最高的海藻糖含量密切相关。冻融胁迫下,maL62的过表达菌株的发酵性能显著提高,冷冻耐受性最好的菌株(B-N+T+M)的发酵性能最好[59]。 L-脯氨酸是一种亚氨基酸,其可以在高渗调节剂下防止蛋白质和细胞物质变性。研究者发现,L-脯氨酸合成过程关键酶γ-谷酰基激酶突变体pro1D154N通过提高L-脯氨酸合成过程中催化前两步反应的γ-谷酰基激酶和γ-谷酰基磷酸还原酶的活性,促进胞内脯氨酸的积累,脯氨酸浓度更高的突变菌株增强了酿酒酵母的乙醇耐受性。在清酒酵母菌株XUW-TRP的基础上,敲除了利用L-脯氨酸的PUT1基因并将野生型PRO1等位替换为pro1D154N后,重组菌株(XUDput1-MT)的L-脯氨酸含量和乙醇耐受性进一步增强,但二者的乙醇发酵性能无明显差异。作者认为这可能是因为乙醇耐受性取决于菌株的培养条件和压力响应,而且菌株在实验室静态和清酒酿造条件下的代谢情况也完全不同。此外,乙醇耐受性因菌株而异,实验室菌株和清酒酵母具有完全不同的遗传背景[60]。 微生物应对胁迫条件时,胞内的多个能量依赖过程都会参与其适应行为,如外排泵和热激蛋白,此外,对胞内大分子的损伤进行修复或者再合成的过程也需要更多能量的产生。表5汇总了近年来能量调控相关基因在影响微生物胁迫耐受性及其生产性能方面的研究进展。 糖酵解途径(Embden-meyerhof parnas,EMP)中的两个关键酶6-磷酸果糖激酶和丙酮酸激酶的编码基因pfkA和pykA在丙酮丁醇梭菌ATCC 824分别进行过表达和共表达。结果表明,所有工程菌株的发酵性能均明显高于野生型菌株,其中,pfkA和pykA共表达菌株的丁醇生产速率和丁醇产量要高于两个单独过表达菌株,这主要是因为该菌株具有最高的丁醇耐受性,而这种耐受性的增强与基因过表达后导致的胞内ATP含量的增加密切相关[61]。通过比较大肠杆菌丁醇耐受菌株和野生型菌株在丁醇胁迫下的转录表达谱发现,乙醛酸醛连接酶编码基因gcl和乙醇酸氧化酶的离子-硫亚基编码基因glcF的转录水平急剧上调。两个基因在大肠杆菌JM109中的过表达均能显著提高菌株的丁醇耐受性,这可能是两个酶通过调节乙醛酸和丙酮酸等用于补充TCA循环的中间代谢物的水平直接增强了胞内的TCA 循环[14]。 嘌呤核苷酸是胞内能量的主要载体,也参与到维持细胞正常功能的各种酶促反应中。2019年,上海交通大学赵心清课题组通过转录组学数据和过表达菌株的性能分析发现,参与嘌呤从头合成途径的3个基因ADE1、ADE13、ADE17在提高酿酒酵母BY4741胁迫耐受性上发挥正向调控作用,提高了菌株对纤维素水解液中各种抑制剂(如醋酸、羟甲基苯甲醛、苯酚、香草醛、丁香醛)的耐受性。其中,ADE17基因(编码的酶同时拥有5-氨基咪唑-4-甲酰胺核苷酸(AICAR)转甲酰基酶和化水解酶的活性)效果最好,它的过表达还能提高菌株对高温、高渗和丙酸的耐受性。与对照菌株相比,ADE过表达菌株在醋酸胁迫(pH 4.5)、模拟的木质纤维素水解液和真实的玉米秸秆水解液等多个条件下表现更好的生长性能和发酵性能,其中,耐受性能最强的ADE17过表达菌株的效果最好[62]。磷酸核糖焦磷酸是体内嘌呤、嘧啶和嘧啶核苷酸从头合成和补救合成的重要底物。研究者将磷酸核糖焦磷酸合成酶复合物的一个亚基PRS3在酿酒酵母(Saccharomyces cerevisiae)工业菌株PE-2(NCYC 3233)中过表达后发现,菌株在醋酸胁迫下利用木糖或葡萄糖为唯一碳源的生长和耗糖能力显著增强。这种耐受性的增加与PRS3过表达能更好的维持胁迫下的细胞完整性密切相关。与对照菌株相比,过表达菌株在利用毛泡桐(Paulownia tomentosa)各种水解产物(如醋酸、糠醛、羟甲基糠醛等)发酵时表现出更好的细胞活力、耗糖能力和乙醇生产能力[63]。 V-ATPase是一种广泛存在于真核生物细胞内膜系统、具有高度保守性的质子泵,主要利用ATP水解产生的能量将细胞质的H+泵入液泡使其酸化,从而维持胞内的pHi平衡。酵母V-ATPase是由14个亚基组成的复合酶,其中,RAV2、DBF2和VMA41/CYS4/NHS5是负责酶的组装或调控酶活的基因。研究者将这3个基因在巴斯德酵母(Saccharomyces pastorianus)衍生菌株中分别过表达后发现,菌株在8%(V/V)乙醇胁迫下的细胞存活数均提高了两个数量级。乙醇耐受性的提高使得菌株在利用高糖培养基和浓醪麦芽汁的发酵过程中具有更高的生产速率,其中,DBF2的效果最为明显。但这3个基因的过表达并不能增强菌株对酵母发酵过程中的另一个常见压力-高渗的耐受性,说明过表达菌株的浓醪发酵性能的改善主要与其乙醇耐受性的增强密切相关[64]。钾泵TRK1和质子泵PMA1在酿酒酵母中的过表达表现出不同的效果,前者提高了菌株的乙醇产量(约18%),后者则没有明显效果,但两者同时过表达产生一定协同作用,菌株的乙醇产量提高了约27%,该发酵结果与菌株在生产过程中面临胁迫条件时表现出的细胞活力是相符的。将这两个基因在不同遗传背景的菌株(商业化菌株和实验室菌株)中过表达后,也明显改善了菌株对不同底物(葡萄糖或者木糖)的发酵性能。其中,K+的吸收产生了主要的电动势,H+的外排主要产生响应电流。这种胞外更多钾离子的泵入和胞内更多H+的泵出缩小了跨膜离子浓度差,降低了胁迫下的离子泄露速率,进而提高了菌株的乙醇耐受性[65]。 表5 能量调控相关基因影响宿主生物耐受性和生产性能的小结 信号转导途径对细胞功能起到开关调控作用。因此,在菌株应对胁迫条件时发挥重要作用。研究者通过分析在丁醇耐受性和生产性能上存在明显差异的丙酮丁醇梭菌ATCC 55025和突变株JB200的基因组学数据发现,突变株JB200的cac3319基因发生了一个碱基缺失,这使得该基因编码的组氨酸激酶(一个双组分信号转导蛋白)的C端发生严重截断(原有长度的75%),导致活性中心序列完全丢失,进而引起酶的功能丧失。通过敲除和回补实验,验证了组氨酸激酶Cac3319的失活是突变株具有更高丁醇耐受性和生产性能的主要原因。与野生型菌株ATCC 55025相比,具有更高丁醇耐受性的敲除菌株HKKO的丁醇产量和生产速率分别提高了44%和 90%[66]。 通过对醋酸敏感的酿酒酵母突变株的基因筛选,研究者发现ypk1基因突变导致其功能的失活是菌株醋酸敏感性增强的原因。Ypk1是蛋白激酶AGC家族的成员,位于细胞质膜上的雷帕霉素靶蛋白TORC2能使其C端结构域的特定位点磷酸化,导致活性大幅度提高,而这种TORC2-Ypk1的激活作用受到醋酸胁迫的诱导。TORC2-Ypk1的信号模块通过激活L-丝氨酸:棕榈酰基-CoA酰基转移酶,促进了鞘脂的合成。通过化学方法(添加鞘脂类物质合成的化学抑制剂)、基因方法(构建对应的突变菌株)和培养基中外源添加的方法,进一步证明了鞘脂合成对菌株醋酸耐受性的必要性。这些结果说明,TORC2-Ypk1通过调节鞘脂合成在酿酒酵母的醋酸耐受性中发挥正向调控作用[67]。也有报道认为,TORC2-Ypk1和鞘脂的合成对于胁迫条件下酿酒酵母胞内ROS水平维持在可耐受的范围是非常重要的[68]。 与单个或多个功能基因、特定或局部的转录因子相比,位于生物体金字塔式代谢调控网络顶端的全局转录因子能从全基因水平上进行转录调控,在改善复杂的耐受性表型上表现出更大优势。大肠杆菌的全局转录因子-环腺苷酸受体蛋白(Cyclic amp receptor protein,CRP)和 RpoD(σ70)是报道较多的全局转录因子。近年来,其他全局转录因子在调控微生物耐受性方面也表现出良好效果。 Crz1p是能特异性结合位于大部分压力响应基因启动子上的钙调磷酸酶-依赖响应因子保守序列的锌指转录因子。Crz1p作为一个能调控多个靶基因表达水平的全局转录因子,首次在酿酒酵母中被发现,随后在许多低等真核生物中也有报道。 酿酒酵母工业菌株HS13中分别过表达内源的转录因子Crzlp或者来源于戴尔有孢圆酵母(Torulaspora delbrueckii)的结构类似物TdCRZ1均能提高菌株的盐和冷冻耐受性,与野生型菌株相比,耐受能力更强的Crzlp和TdCRZ1表达菌株利用预冷的、高糖面团发酵时表现出更好的生产性能。此外,过表达植物中的Crzlp结构类似物-Cys2/His2-类型的锌指蛋白STZ和FTZ[来源于拟南芥(Arabidopsis thaliana)]也能提高酿酒酵母的耐冷冻能力[69]。通过敲除和过表达实验,研究者验证了光滑假丝酵母(Candida glabrata)ATCC 2001中Crzlp对于菌株在酸性条件(pH2.0)下的生长是必不可少的。在不添加pH缓冲剂的酸性发酵体系下,Crzlp过表达菌株由于耐酸性能的增强,其菌体干重和丙酮酸产量分别比野生型菌株提高了48%和60%。pH 2胁迫下,Crzlp过表达菌株中C18∶1脂肪酸的含量和麦角甾醇含量比野生型菌株分别增加了16%和40%,这种膜脂组成的变化是增强细胞膜的完整性和流动性的重要原因。此外,Crzlp的过表达增强了菌株酸性胁迫下的H+-ATPase活性,这促进了胞内质子的泵出,减少了胞内的酸化[70]。 HAA1能直接或者间接地调控80%与醋酸响应相关的基因,是酿酒酵母在醋酸胁迫下负责转录组重构的全局转录因子。研究者发现,HAA1的过表达能增强实验室酿酒酵母BY4741的醋酸胁迫耐受性,这与该基因能够上调细胞壁和细胞膜代谢相关基因的表达水平密切相关,如参与鞘脂类代谢的蛋白YPC1、细胞壁相关的分泌糖蛋白YGP1、细胞膜转运蛋白TPO2和TPO3、负责SNF1磷酸化的蛋白激酶TOS3等。菌株耐酸性能的增强使得其发酵木糖产生乙醇的性能明显提高,如50 mmol/L醋酸胁迫下,过表达菌株的乙醇产量和转化率比对照菌株分别提高了156%和23.1%,当醋酸浓度提高到100 mmol/L时,对照菌株已不能生成乙醇而过表达菌株的乙醇产量为 0.8 g/L[71]。2018 年,Cunha 等[63]利用该转录因子的过表达提高了工业酿酒酵母PE-2(NCYC 3233)在醋酸胁迫下利用木糖或葡萄糖为唯一碳源的生长性能及其对应的糖耗能力。该工作将酿酒酵母能够耐受的最大醋酸浓度由2.4 g/L增大到4 g/L[71]。这种耐受性能的改善与细胞壁完整性的增强密切相关。利用未经脱毒处理的毛泡桐水解物(添加葡萄糖和木糖作为营养物质)进行发酵时,过表达菌株表现出更强的葡萄糖和木糖消耗能力、更高的生物量和乙醇产量。 FadR和MarR分别是控制胞内脂肪酸合成和多重药物抗性的全局转录因子。FadR的单独过表达提高了大肠杆菌ΔaasΔfadDBTE表达菌株的中链脂肪酸耐受性,进而使得中链脂肪酸产量比出发菌株提高了约30%[7]。FadR和MarR在大肠杆菌BW25113的单敲除均增强了菌株对正己烷和正己烷/环己烷混合物的耐受性。其中,FadR的敲除促进了饱和脂肪酸(如棕榈酸)的合成,抑制了不饱和脂肪酸合成关键酶(如FabA和FabB)的活性,导致的饱和脂肪酸/不饱和脂肪酸比值的增大减少了细胞膜对有机溶剂的通透性,进而降低了有机溶剂在胞内的积累。而MarR的敲除对胞内饱和脂肪酸和不饱和脂肪酸的比值没有影响,它主要通过激活全局转录因子MarA的表达上调了外排泵的活力,促进了有机溶剂的泵出。此外,这2个基因的单独敲除还改变了数百个基因的表达水平。值得注意的是,共同敲除菌株的有机溶剂耐受性要明显高于单个基因敲除菌株,这说明二者之间存在着协同作用[72]。 研究者通过驯化的方法提高了大肠杆菌对木质纤维素快速热解过程中产生的热解糖浆的耐受性。比较进化菌株(TJE1)和亲本菌株(KO11+lgk)的基因组序列信息后发现,CsrA(一个全局碳源存储调节子,影响多个基因的的翻译)的编码基因发生了突变。将进化菌株中的CsrA突变体替换亲本菌株中的野生型CsrA后,菌株的热解糖浆耐受性显著提高,其主要原因是CsrA突变体通过降低胞外聚合物蛋白的合成增强了胁迫下的细胞膜完整性[73]。 中介体是RNA聚合酶II通用转录的重要组分,主要由头部、中部、尾部和细胞周期蛋白依赖性激酶8(CDK8)4个模块组成,在真核mRNA合成的活化和阻抑中发挥重要作用。江南大学刘立明课题组先后报道,中介体尾部亚基Med15B[74]和Med3[75]的过表达能增强光滑假丝酵母ATCC 2001的酸胁迫耐受性。过表达菌株中的油酸(C18∶1)含量、总的磷脂含量、麦角甾醇含量和不饱和脂肪酸/饱和脂肪酸的比值均出现上调,进而提高了菌株在酸胁迫下的细胞膜完整性和流动性。此外,基因过表达导致的H+-ATP酶活的提高能促进胞内质子的泵出,使胞内H+维持在较低水平。耐受性增强的过表达菌株在没有pH缓冲剂的发酵体系下,细胞干重和丙酮酸产量比亲本菌株均显著提高。 氨基酸脱羧反应是细菌简单分解代谢途径的一部分,前体氨基酸从培养基中被吸收,进入细胞质发生脱羧反应后再以氨基衍生物的形式分泌到培养基中。脱羧反应中质子被消耗,CO2被释放,前体的吸收和产物的跨膜分泌都需要转运交换模式介导从而产生电子。因此,脱羧反应和电子交换的偶联会产生了一个质子推动力,它由跨膜的pH梯度ΔpH(胞内碱性)和电位梯度ΔΨ(胞内负电)组成,为细胞次级代谢提供能量。 研究者发现,单核细胞增多性李斯特氏菌(Listeria monocytogenes)的谷氨酸脱羧系统的敲除降低了菌株在胃酸胁迫下的耐受性[76],屎肠球菌(Enterococcus faecium)的酪氨酸脱羧系统[77]与菌株在pH 2.5胁迫下的耐受性相关。大肠杆菌的谷氨酸脱羧酶(GadBC)导入恶臭假单胞菌S16后能显著提高菌株的耐酸性能。pH 5.5条件下,重组菌株对苯甲酸或尼古丁表现出更好降解能力(48 h降解90%),而野生型菌株完全失去了降解能力。这可能是因为谷氨酸脱羧酶的表达不仅能保证胞内pHi的平衡,也能暂时提高胞内γ-氨基丁酸的含量,通过跨膜电势的翻转抵消质子的不正当进入,这一策略与极端嗜酸微生物的酸胁迫响应非常类似[78]。 嗜热链球菌(Streptococcus thermophilus)CHCC 1524编码组氨酸脱羧途径的hdcAPB操纵子(包括组氨酸脱羧酶编码基因hdcA、组氨酸/组胺交换基因hdcP、HdcA成熟因子基因hdcB)导入乳酸乳球菌NZ9000后,在组氨酸存在的条件下,过表达菌株能够在pH 3的酸胁迫下存活2 h而野生型菌株则快速死亡。这种耐受性的提高与组氨酸脱羧途径提高胞内的pHi,阻止胞内酶的变性密切相关。值得注意的是,组氨酸脱羧途径和糖酵解途径在提高菌株的耐酸性能上存在着协同效应,二者共同作用使得菌株在pH 2.5极端条件下的存活率提高了约10倍[79]。研究者将谷氨酸脱羧酶(GAD)和谷氨酸脱氢酶(GDH)的编码基因gadB和gdh分别在詹氏丙酸梭菌(Propionibacterium jensenii)ATCC 4868过表达后发现,菌株的丙酸胁迫耐受性和发酵性能均明显增强。与野生型菌株相比,gadB过表达菌株在丙酸胁迫下的存活率提高了10倍多,丙酸产量提高了22%。丙氨酸脱羧酶系统的过表达不仅能促进质子消耗和CO2产生,更好的维持胞内pHi平衡。而且改变了胞内参与氨基酸代谢和三羧酸循环的多个基因的表达水平以及胞内的氨基酸池[80]。 抗逆元件的发现和应用是改善微生物胁迫耐受性,进而提高其生产性能的有效手段。极端微生物在自然胁迫条件下的长期驯化,拥有了一套特殊、高效的胁迫响应机制。因此,该类微生物中的抗逆元件常常具有更好的应用效果(如热激蛋白)。但目前研究者对极端微生物特有的胁迫响应机制的认识还不全面,针对其基因组和胞内代谢网络建立的大规模分子改造和合成的技术尚处于起步阶段,极大地制约了极端微生物中抗逆元件的发现和应用。 大量文献证明,通过对同一类抗逆元件中重要基因的操作(过表达、敲除和突变)能显著提高微生物的抗逆性能。多数情况下,多基因的组合操作比单基因的操作具有更明显的效果。如酿酒酵母的钾泵TRK1和质子泵PMA1的共表达[65]、丙酮丁醇梭菌糖酵解途径中的pfkA和pykA的共表达[61]、大肠杆菌的全局转录因子FadR和MarR的共敲除[72]、大肠杆菌的外膜蛋白OmpF的敲除和转运蛋白FadL的表达[15]、酵母的海藻糖合成相关基因的表达(如otsA、otsB、treS、tps1和tps2)和海藻糖水解相关基因的敲除(如nth1、nth2和ath1)[56-59]等[7,63]。但也有一些例外的情况,如单独表达硫酯酶GeoTE的重组大肠杆菌的游离脂肪酸耐受性高于单独表达硫酯酶BTE重组大肠杆菌和共表达菌株,其中,GeoTE表达菌株的细胞存活数比BTE表达菌株和共表达菌株分别高出1和2个数量级[5]。外排泵SrpB过表达提高恶臭假单胞菌正丁醇耐受性的效果与SrpABC三基因共表达时相似,二者均高于其他两个基因的单独过表达[4]。 综合文献报道,我们发现多种方法均能改善微生物的同一种抗逆性能,如研究者采取了调控细胞壁和细胞膜、相容性溶质、能量代谢、DNA修复、氧化应激、热激蛋白等多种方法增强了不同微生物的乙醇耐受性。但这些方法具有各自的特点。其中,针对热激蛋白、氧化应激、DNA修复等与一般胁迫响应相关元件的操作方法,能更直接作用于菌株的抗逆性能,且不易对胞内的其他生理系统和代谢过程产生影响,而且,这类元件更易从极端微生物中获得效果更好的基因。而针对细胞壁和细胞膜、相容性溶质和能量相关元件的操作方法,容易对菌体生长、胞内多个代谢途径甚至产物合成产生影响,尤其是基因之间复杂的相互作用。因此,在靶点选择和操作方式上难度更大。一般来说,多种方法同时使用的效果更好,如酿酒酵母的转录因子HAA1与磷酸核糖焦磷酸合成酶PRS3的共表达产生协同作用,其耐受性能、糖耗能力和乙醇产量均高于两个基因单独表达的情况[63]。研究者将人工转录因子(ATF)、脂肪酸合成基因(fabD)、离子吸收蛋白(FeoA)这些单个表达时均表现出良好效果的不同类型的抗逆元件进行组合表达后发现,菌株的最大丁醇耐受浓度提高到2%,而单独表达人工转录因子的菌株的最大丁醇耐受浓度为1.5%[4]。但由于不同类型元件之间的合作机制尚未完全解析,一些组合操作的效果仍无法解释,如外排泵元件(SrpABC)和脂肪酸合成基因共表达时,菌株在丁醇胁迫下的生长性能反而受到明显抑制,这一结果与单个元件表达均提高菌株耐受性的现象完全相反[4]。这些报道都充分说明了抗逆机制的复杂性,也对高效微生物细胞工厂的构建提出了更大的挑战。此外,实际应用时,还应考虑多种方法同时操作后对菌株生长、生理代谢和产物合成造成的过大负担和不利影响。 目前,针对大量的非模式微生物或工业生产菌株的高效、稳定的遗传操作系统还比较缺乏,尤其是用于基因表达水平精细和动态调控或者多基因/大片段同步操作的分子工具。此外,抗逆元件的定向进化、组合操作时多个元件表达水平之间的平衡和优化也是需要重点考虑的问题。大量结果表明,利用比较组学数据筛选出来的显著差异基因不一定具有良好的抗逆效果,菌株胁迫耐受性能的增加也不总能提高其生产性能。因此,需要采取系统生物学的思想,通过多组学技术、代谢工程操作和高通量筛选技术相结合的方法,挖掘大量具有重要应用潜力的抗逆元件。这不仅能推动微生物胁迫耐受机制的深入认识和全面解析,而且为高效微生物细胞工厂的构建提供良好的理论指导和必要的调控元件。2 外排泵

3 热激蛋白
3.1 GroESL
3.2 DnaK
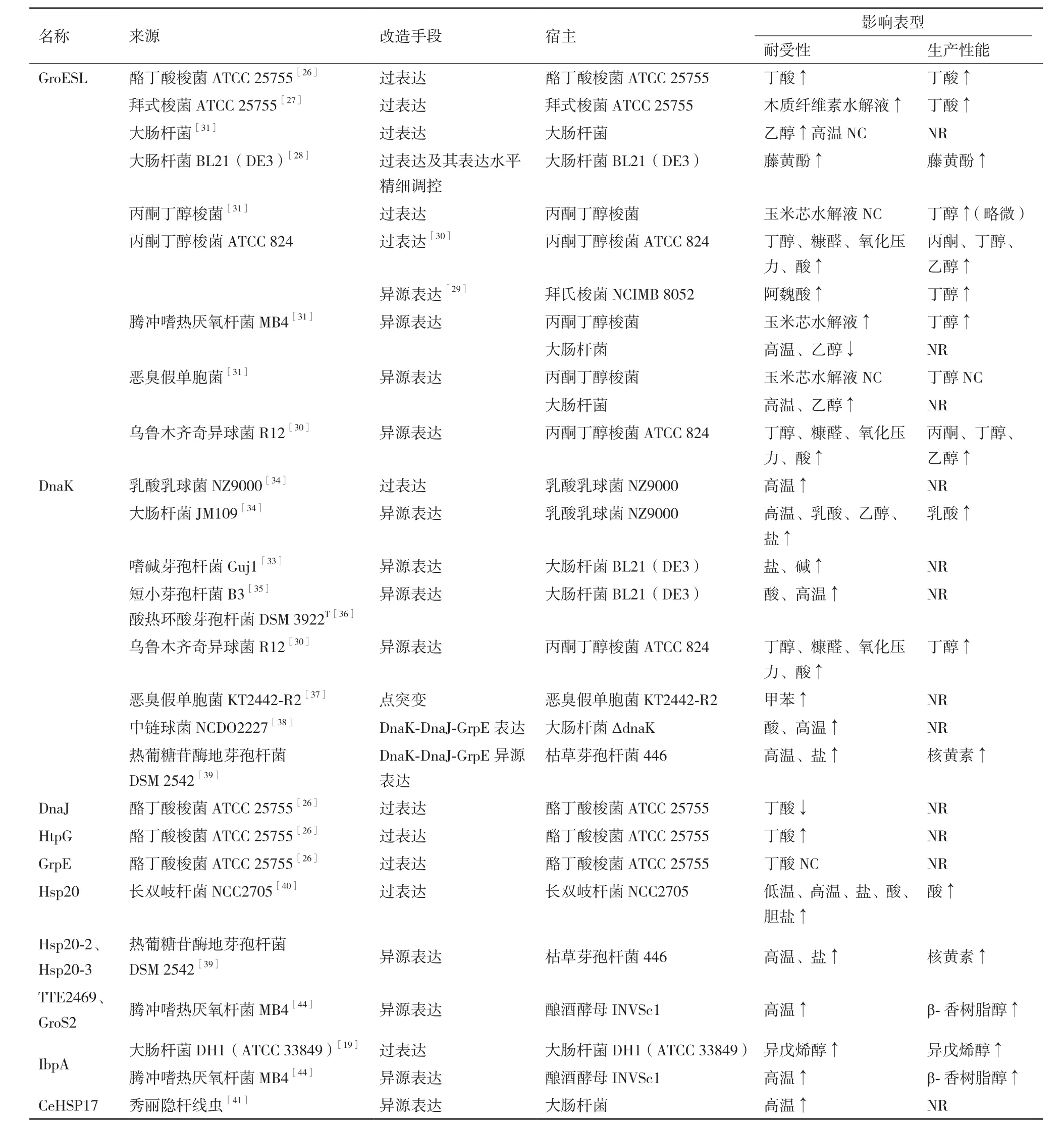
3.3 其他热激蛋白
4 DNA修复相关基因
5 氧化应激相关基因
6 相容性溶质调控相关基因
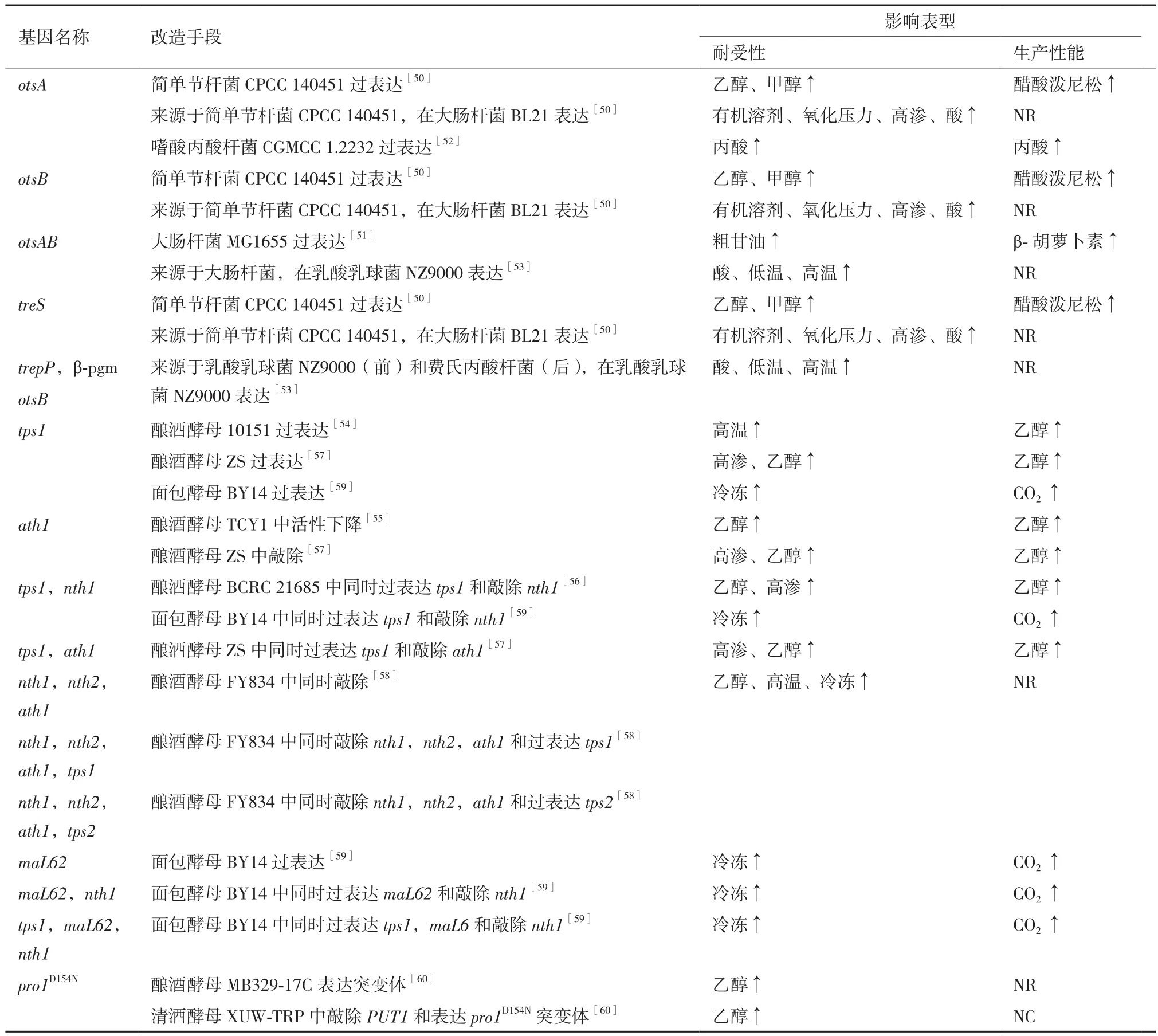
7 能量调控相关基因

8 信号转导
9 全局转录因子
9.1 Crz1p
9.2 HAA1
9.3 其他全局转录因子
10 其他基因
10.1 中介体(Mediator)
10.2 氨基酸脱羧途径
11 结语

