帕金森病伴抑郁患者静息态脑功能磁共振成像局部一致性研究☆
邱轶慧 聂坤 高玉元 王婉怡 许齐欢 张玉虎 王丽敏 王丽娟
帕金森病(Parkinson disease,PD)是常见的神经退行性疾病,抑郁是最常见的非运动症状之一,发病率高达40%[1],可能是PD发病独立危险因素[2],严重影响患者生活质量。但目前发病机制尚未明确,探讨其病理机制,实现临床前驱期对PD患者早期识别和治疗,可能可延缓疾病进展,提高患者生活质量。静息态功能磁共振 (resting state functional magnetic resonance imaging,rs-fMRI)通过测量血氧水平改变产生的磁共振信号变化间接反映神经元功能,为脑科学研究提供了一种无创伤、高分辨率的有效方法。既往研究显示帕金森病伴抑郁(Parkinson disease patients with depression,DPD)患者前额叶和边缘系统存在功能异常及连接改变[3-4]。局部一致性(regional homogeneity,ReHo)是rs-fMRI分析法之一,能够检测模型驱动方法无法发现的不可预测的血流动力学反应,将其量化疾病中大脑局部自发性活动,探讨异常活动与临床症状间的潜在关系具有一定优势。本研究拟采用ReHo分析法对DPD脑功能进行剖析,为进一步探索DPD的发病机制提供一定的科学依据。
1 对象与方法
1.1 研究对象入选2016年9月至2018年9月广东省人民医院神经科住院或门诊就诊的PD患者45例作为PD组,25例年龄、性别、受教育程度匹配的健康受试者作为对照组。PD组入选标准:① 根据2016年中国帕金森病诊断标准[5],纳入临床确诊的帕金森病或很可能的帕金森病,且由两位主治医师或以上职称的神经科医师独立诊断;② 近2个月未服用抗抑郁、焦虑药物;③ 稳定抗帕金森病药物大于28 d;④ 右利手;⑤ 能够独立或在家属协助下完成量表测评。PD组排除标准:①多系统萎缩、血管性帕金森综合征等其他神经系统疾病;②严重精神分裂等精神疾病;③严重呼吸系统、心血管系统、消化系统等内科系统疾病;④伴严重认知障碍不配合检查者。对照组入选标准:①无中枢神经系统疾病史或者头颅外伤史;②无严重呼吸系统、心血管系统、消化系统等内科系统疾病;③右利手。对照组排除标准:①具有焦虑、抑郁等严重精神类疾病患者;②认知障碍。所有受试者均签署知情同意书。
1.2 研究方法
1.2.1 临床资料收集 收集受试者性别、年龄、文化程度等一般资料。根据美国《精神疾病诊断与统计手册第 4版》(the Diagnostic and Statistical Manual of Mental Disorders,4th edition,DSM-IV)抑郁发作诊断标准将PD组分为DPD组22例及PD非抑郁(Parkinson disease patients without depression,NDPD)组23例[6]。采用运动障碍学会帕金森病统一评分量表第三部分 (the Movement Disorder Society Unified Parkinson Disease Rating Scale part III,MDS-UPDRS-III)[7]及改良 Hoeh-Yahr(H&Y)分级[8]对患者进行运动功能评分。抑郁及焦虑评估分别采用汉密尔顿抑郁量表 (Hamilton depression scale,HAMD)和汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)。认知功能评估采用简易智能状态检查量表 (mini-mental state examination,MMSE)。
1.2.2 MRI扫描采集 所有PD患者均于检查前暂停抗PD药物≥12 h。检查过程受试者保持清醒、安静、闭眼。MRI扫描设备采用 GE 3.0 T(Signa ExciteⅡ HD)超导型磁共振成像系统,8通道标准头线圈。采集受试者rs-MRI及3D T1加权序列。rs-fMRI:重复时间(TR)=2000 ms,回波时间(TE)=30 ms,视野 (FOV)=24 cm×24 cm,矩阵64×64,层面内分辨率为 3.75 mm×3.75 mm,层厚4 mm,间隔1 mm,层数30。共采集186个时相,采集时间约为 368 s,共获得5580幅图像。3D T1加权序列:TR=8.4 ms,TE=3.3 ms,矩阵 256×256,FOV=240×240 mm2,层厚 1 mm,共 146 层。
1.2.3 数据预处理 基于MATLAB 2012a平台,采用 DPABI_V3.0(http://www.rfmri.org/dpabi)软件包及 SPM8(http://www.fil.ion.ucl.ac.uk/spm)对数据进行预处理。过程包括数据格式转换、去除前面10个时间点、时间层校正、头动校正、空间标准化、去线性漂移和低频滤波、去除协变量、计算ReHo值、平滑等。ReHo是评估局部脑区功能状态的方法之一,反映局部脑区神经元活动同步性。其降低反映神经元活动同步性差,反之则提示区域内神经元活动一致性异常增强,推测可能为代偿反应。
1.3 统计学方法采用SPSS 22.0进行统计学分析。符合正态分布的计量资料以±s表示,多组数据比较采用单因素方差分析 (两两比较采用LSD-t检验),两组数据比较采用两独立样本t检验;非正态分布的计量资料以中位数 (四分位间距)表示,多组比较采用Kruskal-Wallis H检验(两两比较采用Bonferroni检验),两组独立样本之间比较采用Mann-Whitney U检验;计数资料采用检验。
影像学数据统计运用DPABI软件包。三组间各脑区ReHo差异采用one-way ANOVA检验(两两比较采用LSD-t检验),对所得结果进行GRF多重比较矫正;将性别、年龄、病程、受教育年限、左旋多巴等效剂量 (levodopa equivalents,LED)、MDS-UPDRS-III、H&Y 分级、MMSE、HAMA 评分及头动参数(Mean FD Jenkinson)作为协变量,对DPD各脑区ReHo值与HAMD评分进行相关性分析。检验水准α=0.05。
2 结果
2.1 一般资料三组性别、年龄、受教育年限、MMSE评分差异无统计学意义。NDPD与DPD组间病程、LED、H&Y 分级、MDS-UPDRS-Ⅲ评分差异亦未见统计学意义。DPD组较另外两组HAMD及HAMA评分显著增高(表1)。结果提示DPD患者同时合并焦虑障碍,这与既往研究相符[9]。
2.2 三组各脑区ReHo值比较DPD组与对照组对比,ReHo差异的脑区主要集中于额叶、顶叶及皮层下(包括基底节及边缘系统)。ReHo显著增加的脑区包括左侧额叶、左侧丘脑、右侧扣带回、左侧海马旁回及左侧顶叶上回。而右侧额中回、双侧中央后回、右侧颞中回、左侧舌回、右侧豆状壳核、左侧尾状核、左侧前扣带回和旁扣带回ReHo显著降低(表 2,图 1)。
NDPD组与对照组对比,ReHo差异的脑区主要集中于额叶、顶叶及枕叶。除外右侧三角部额下回与小脑部分脑区ReHo值显著增高,余脑区ReHo值显著降低(表3,图1)。NDPD及DPD组分别同对照比较,结果均显示右侧额中回、右侧颞中回、双侧中央后回、左侧尾状核ReHo值显著降低。由此推测,以上脑区功能紊乱可能是PD发病重要因素。
DPD与NDPD组间对比,DPD组额叶除外右侧三角部额下回ReHo值显著减低,左侧额中回及运动皮层,包括右侧中央前回、左侧辅助运动区、右侧中央旁小叶ReHo值显著增高,ReHo增高的脑区还包括顶叶中双侧楔前叶及皮层下右侧内侧和旁扣带回。DPD组枕叶中左侧枕中回、左侧舌回、右侧距状裂周围皮层皮层,边缘系统中左侧前扣带和旁扣带回及左侧岛叶ReHo较NDPD组显著降低。可见额叶、边缘系统、顶枕叶静息态功能异常可能是DPD重要影像学标识(表4,图1)。

表1 三组人口统计学及临床资料评估结果
2.3 DPD患者脑区ReHo值与抑郁评分的相关性分析
相关性分析显示,DPD组HAMD评分与左侧额中回(r=-0.644)、右侧楔前叶(r=-0.646)、左侧舌回(r=-0.563)ReHo 值显著负相关(P<0.05),与右侧中央前回 (r=0.602)、右侧中央旁小叶 (r=0.627)、左侧楔叶(r=0.801)ReHo 值呈正相关(P<0.05,见图2)。可见与DPD抑郁严重程度相关的脑区基本与DPD同NDPD组对比ReHo差异脑区重叠,以上脑区静息态功能异常可能是引起PD抑郁症状发生、发展的关键因素。

表2 DPD组与对照组对比ReHo差异的脑区

图1 三组间ReHo差异的脑区 A:DPD组与对照组的差异;B:NDPD组与对照组的差异;C:DPD组与NDPD组的差异。红色区域表示两组对比,ReHo显著增高的脑区,蓝色则反之
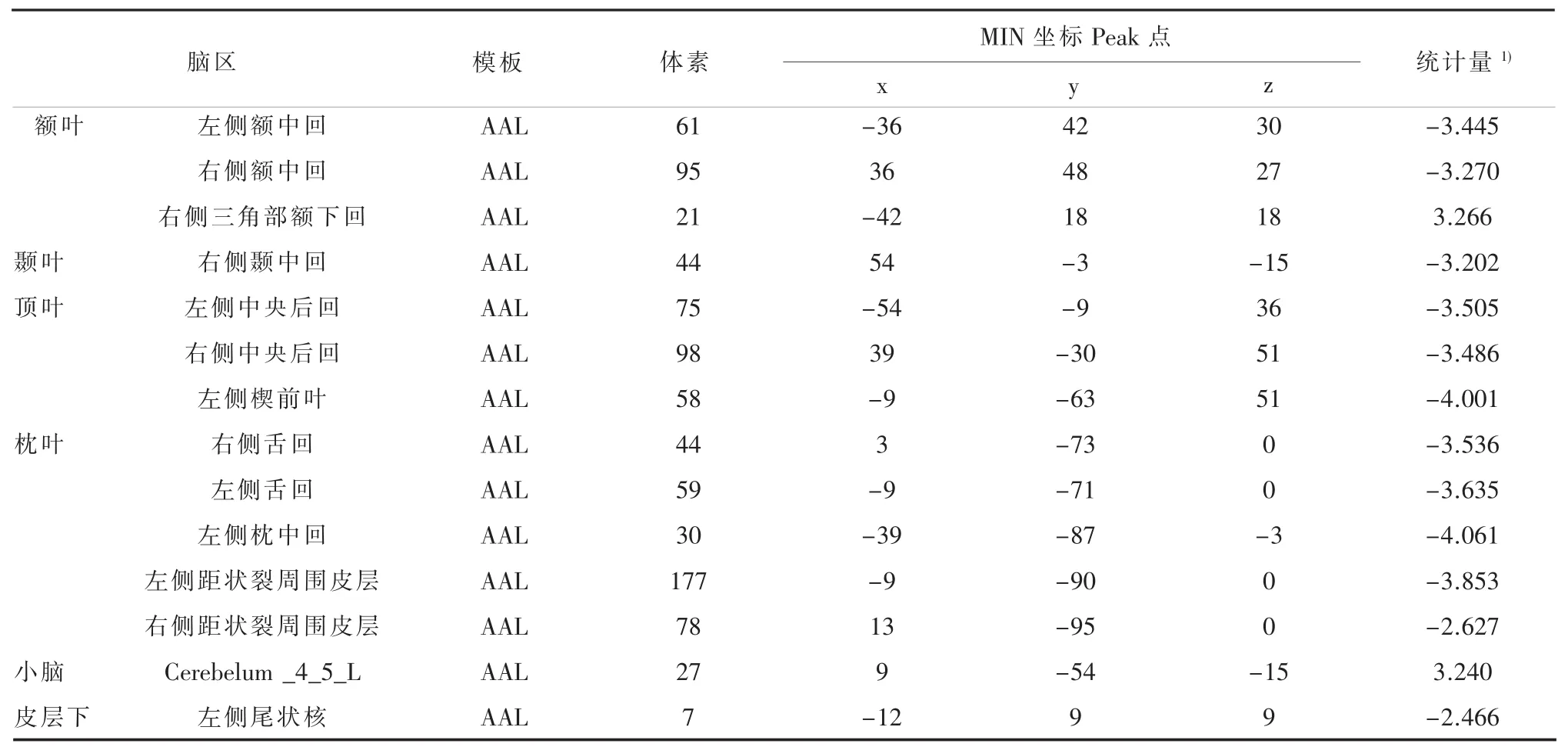
表3 NDPD组与对照组对比ReHo差异的脑区

表4 DPD组与NDPD组对比ReHo差异的脑区
3 讨论
本研究发现DPD组额叶中除外右侧三角部额下回ReHo值显著降低,左侧额中回及运动皮层中右侧中央前回、左侧辅助运动区和右侧中央旁小叶ReHo值显著增加,边缘系统(右侧内侧和旁扣带回、左侧前扣带回和左侧岛叶)、双侧楔前叶及枕叶均存在局部神经元活动同步性异常。同时,以上绝大部分脑区ReHo值与抑郁评分显著相关。

图2 DPD组ReHo信号与抑郁评分相关的脑区 红色区域代表其ReHo与HAMD评分正相关,蓝色区域代表ReHo与HAMD评分负相关
额中回与右侧三角部额下回为前额叶组成脑区,前额叶、扣带回、岛叶被认为是情绪调节的关键区域[9]。前额叶负责自上而下调节情绪和注意力,其功能异常与抑郁症过度自我关注[11]、消极自我归因[12]、反刍思维[13]三大自我加工异常相关。扣带回及岛叶是边缘系统重要组成部分。扣带回与岛叶、杏仁核、丘脑前核、腹侧纹状体等存在广泛纤维联系,与自主神经功能和情感行为相关[14-15]。脑内多巴胺神经元主要分布于中脑致密部和腹侧被盖区。腹侧被盖区多巴胺能神经元发出纤维投射到前额叶(例如眶额叶皮层和前扣带回)、边缘系统、腹侧纹状体,形成中脑边缘系统,其神经元损伤被认为是引起PD神经精神症状的关键因素[16-17]。此外,5-羟色胺亦在DPD发病中起重要作用。颅内5-羟色胺主要来自中缝核上部,其损伤可导致前额叶及皮层下如基底节、边缘系统相关脑区5-羟色胺神经支配减少,且PD抑郁严重程度与前扣带回5-羟色胺能神经失支配相关[17-19]。因此,我们认为,PD单胺神经系统退行性变可引起前额叶及边缘系统相关投射脑区神经递质缺乏,导致局部功能障碍,引起DPD发生及发展。
中央前回、辅助运动区、中央旁小叶是纹状体-丘脑-皮层环路(striato-thalamo-cortical,STC)及小脑-丘脑-皮层运动环路 (cerebello-thalamocortical,CTC)的重要皮层投射区[21-22]。黑质纹状体多巴胺能神经元退行性病变可引起STC及神经递质功能发生改变,导致丘脑运动核团对相应运动皮层的兴奋性减低,引起PD患者行动迟缓、肌强直[22]。近年研究发现CTC可代偿STC对运动调节所造成的损害。随着PD疾病进展,CTC募集增加,以克服STC的功能缺陷[22]。本研究临床资料分析结果显示,虽然DPD组与NDPD组运动障碍评分未见显著统计学差异,但NDPD组运动障碍严重程度较NDPD组轻(P=0.05,Z=-1.957)。既往研究采用二元logistic回归分析显示UPDRS-III评分是DPD的重要影响因素。更严重的运动症状可能会加重患者的心理和生理负担,从而增加内疚感和绝望感[24]。因此,我们认为DPD皮层运动区神经元活动同步性异常改变可能同病情进展加重相关。
本研究发现DPD双侧楔前叶局部神经元活动同步性异常增高,且右侧楔前叶ReHo值与HAMD评分呈显著负相关。楔前叶位于顶叶,与视空间等感知觉加工、情景记忆提取以及自我意识有关。其也是组成默认网络 (default mode network,DMN)的关键脑区。DMN在抑郁症发病机制中起重要作用,调节人脑对内外环境的监测、情绪的加工、自我内省、维持意识的觉知、情景记忆的提取等[24]。研究显示,重度抑郁症患者双侧楔前叶功能连接异常增高,抗抑郁治疗后临床症状显著改善,同时双侧楔前叶功能连接正常化[26]。我们认为,楔前叶功能状态有望成为为评估DPD抑郁严重程度的影像学手段。
DPD枕叶相关脑区局部神经元同步性活动异常及其与抑郁程度的相关性亦在本研究中发现。枕叶是视觉皮层中枢,DPD视觉皮层功能及结构异常已被既往研究报道。SPECT研究表明,DPD与NDPD相比,楔叶局部血流量较高,且与抑郁严重程度呈显著正相关[27]。另一项研究借助弥散张量成像磁共振方法分析显示,DPD抑郁障碍与左侧额枕下束连接降低有关[28]。视觉皮层被认为与感知、注意力和工作记忆相关,其功能障碍可导致信息处理的认知控制受损,最终导致抑郁症状[29]。我们考虑视觉皮层功能障碍可能在DPD的病理生理中扮演重要角色。然而,视觉障碍也是PD中的独立感觉症状,可作为PD与帕金森综合征鉴别要点[30]。因此,应进一步研究PD患者抑郁与视功能间的因果关系。
本研究采用静息态功能磁共振ReHo方法研究发现DPD前额叶、边缘系统、运动皮层、顶枕叶多脑区神经元活动同步性异常,且与抑郁严重程度显著相关。初步表明DPD发生发展与局部脑区功能紊乱相关,可能可作为DPD诊断及监测疾病进展的影像学标识。但本研究为单中心小样本研究,部分患者入组前规律服用抗PD药物,且仅从功能分离角度探讨脑区功能状态,未来需进一步扩大样本量,入组初诊未服药的PD患者,从功能整合及脑网络角角度更深入研究,为进一步全面而科学地探明DPD发病机制提供一定的科学依据。

