miR-122-5p通过ADAM10基因抑制卵巢癌细胞增殖、侵袭和转移的研究
徐兴远,龙晶,张祯晶
(1.中南大学湘雅医院 妇产科,湖南 长沙 410008;2.中南大学医学院 临床医学系,湖南 长沙 410008)
卵巢癌是常见的妇科恶性肿瘤之一,5 年生存率低于45%[1]。在卵巢癌早期,患者并无明显症状。当癌症进一步进展,相关症状才逐一显出[2]。尽管有手术治疗及放化疗等手段,卵巢癌的预后仍不容乐观。故此,寻找卵巢癌预防及治疗的方法迫在眉睫。
微小核糖核酸(micro ribonucleic acid,miRNA)是一类单链非编码核糖核酸,长度在18~24 个核苷酸之间。它们通过与信使核糖核酸(mRNA)的3'未翻译区(3'untranslated region,3'UTR)序列特异性结合,来对mRNA 进行转录后的负向调节,进而在诸多生物进程中起到关键作用[3]。
一方面,微小核糖核酸122-5p(microRNA-122-5p,miR-122-5p)是脊椎类物种的特定miRNA,它与许多恶性肿瘤如胃癌[4-5]、乳腺癌[6]等存在关联。另一方面,ADAM10 基因被证明参与了调节细胞表面蛋白功能的过程,它与参与肿瘤进展的诸多因子如表皮细胞生长因子(epidermal growth factor,EGF)、钙黏附蛋白E(E-cadherin)和炎症因子等相关[7]。
该研究阐明了miR-122-5p 在卵巢癌细胞增殖、转移及凋亡中的作用,并进一步证明了miR-122-5p是通过与ADAM10 基因的mRNA 直接作用来调节细胞功能的。综合而言,该研究证实miR-122-5p可以作为肿瘤抑制因子,有望成为未来的卵巢癌治疗的新靶点。
1 材料与方法
1.1 细胞培养
卵巢癌细胞系A2780 和SKOV3 购买于中科院生化细胞实验室(中国,上海)。培养液采用DMED 培养液加10% 胎牛血清(FBS)(购于Invitrogen 公司,美国),抗生素选用100 u/mL 的青霉素和100 μg/mL 的链霉素(购于Hyclone 公司,美国),细胞培养条件为37℃、5%二氧化碳的温箱。卵巢癌耐药株A2780/DDP 为自己培育,保存于最终浓度为1 μg/L 的顺铂溶液中,方法参见文献[6]。
1.2 RNA 提取及实时定量聚合酶链式反应
应用TRIzol 试剂(购于Invitrogen 公司,美国)根据标准流程提取RNA。关于ADAM10 的表达设计,通过第一链合成系统(Superscript First-Strand Synthesis System)(Invitrogen 公司)设计。应用的引物如下:正向引物5'-GCAATACTCGCCT TACGGCT-3',反向引物5'-TACACACCTTGGTAGT ACGCC-3';甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)正向引物5'-ACAACTTTGGTATCGTGGAAGG-3',反向引物5'-GCCATCACGCCACAGTTTC-3'。其中GAPDH 作为对照。miR-122-5p 定量检测通过TaqMan miRNA Assay(ABI 公司)按标准流程完成。U6 snRNA 作为内对照。实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)完成于ABI 7900HT 仪器。所有的试验均独立完成3 次。
1.3 质粒和慢病毒的构建
MiR-122-5p 过表达载体通过如下引物构建:正向引物5'-AAAGGATCCCAGGAGTTGTAAATCCG AGCCG-3',反向引物5'-AAAGAATTCTTCATAGGT CAGAGCCCTGTGCA-3',方法见文献[6]。编码ADAM10 蛋白的DNA 片段先经PCR 扩增再载入pcDNA3,1 载体(Clontech,Palo Alto,美国),应用的引物如下:正向引物5'-AAAGCTAGCATGTTA GGAACTGTGAAGATGGAAG-3',反向引物 5'-AAACTCGAGCTAGGAAGTGTTTAGGACGGGTCT-3'。Mir-122-5p 慢病毒通过用pPACKH1 Lentivector Packaging Kit(美国SBI 公司)共转染HEK293T获得,见文献[6]。为产生稳定的细胞株,细胞转染慢病毒24 h,并更换完全培养液。转染后96 h,用qRT-PCR 确认转染效率。
1.4 荧光素酶活性试验
含野生型或突变型ADAM10 基因的荧光素酶报告基因载体,与含miR-122-5p 的HEK293T 细胞共转染。转染后48 h 洗脱、裂解并通过双重荧光酶报告试剂(Promega,Madison,美国)按标准流程分析。
1.5 细胞活性、集落形成和细胞凋亡的测定
细胞活性通过细胞计数盒CCK8 计算。细胞种于96 孔板,1×103细胞/孔,容量100 μL 培养液。每孔加入10 μL CCK 试剂,分光光度计于450 nm 波长测定光密度(optical density,OD)值。
集落形成试验。细胞种于6 孔板,800 细胞/孔,孵育14 d。之后每3 日更换含10%FBS 的培养液,观察生成的细胞集落。超过40 个细胞的集落计算在内,观察四个象限,并计算平均值。另外,水晶紫染色后拍照以便展示。
细胞凋亡通过凋亡检测盒完成[Annexin V-PE Apoptosis Detection Kit(Millipore,美国)]。细胞标本收集后,用5 μL 膜连蛋白V-PE 和5μL PI 染色。通过流式细胞学检测细胞的凋亡,结果通过Cell-QuestTM Pro 软件分析。收集预处理的细胞,于70%浓度的乙醇在4℃过夜,后悬浮于1 mL 含1 mg/mL RNase(Sigma,St.Louis,美国)和50 μg/mL PI 试剂的PBS 溶液中,室温暗箱孵育30 min。
1.6 细胞迁移和侵袭试验
细胞迁移和侵袭能力测定采用标准的Transwell 试验。将3×104细胞置于100 μL 无血清培养液内,加入试验板的上层。600 μL 含10%FBS培养液置于下层。分别于12 或36 h 后,细胞固定并用0.05%水晶紫染色计数。显微镜下200 倍拍照以便展示。
1.7 Western Blot
细胞收集后裂解,共分离出60 μg 蛋白,置于10% 聚丙烯酰胺凝胶电泳后转膜。用1% 牛血清白蛋白(bovine serum albumin,BSA)于TBST 缓冲液中室温孵育1 h 封闭。加入ADAM10、BCL-2 及Cyclin D1 蛋白的抗体,和GAPDH 于4℃过夜。洗膜,加入羊抗兔、辣根过氧化物酶偶联的二抗室温孵育1 h。蛋白条带通过增强化学荧光试剂ECL(Millipore,MA,美国) 检测,并通过图像J(Image J)软件分析。
1.8 统计学方法
所有的统计学数据应用SPSS 19,0 软件进行分析计算。计量资料以均数±标准差()表示,应用t检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-122-5p 抑制卵巢癌细胞体外增殖
将卵巢癌细胞系SKOV3 和A2780 转染miR-122-5p,或转染空白载体作为各自对照组,并通过qRT-PCR 证实成功转染的效果(P<0.01),见图1。此后,评估转染后细胞的活性和增殖能力。结果表明,转染3 日后,与对照组相比,转染了miR-122-5p 的SKOV3 和A2780 细胞的活性明显降低(P<0.01),见图2;另外,细胞集落形成能力也大大降低了,见图3。总体上,这些结果证明了miR-122-5p 抑制卵巢癌细胞的体外增殖。
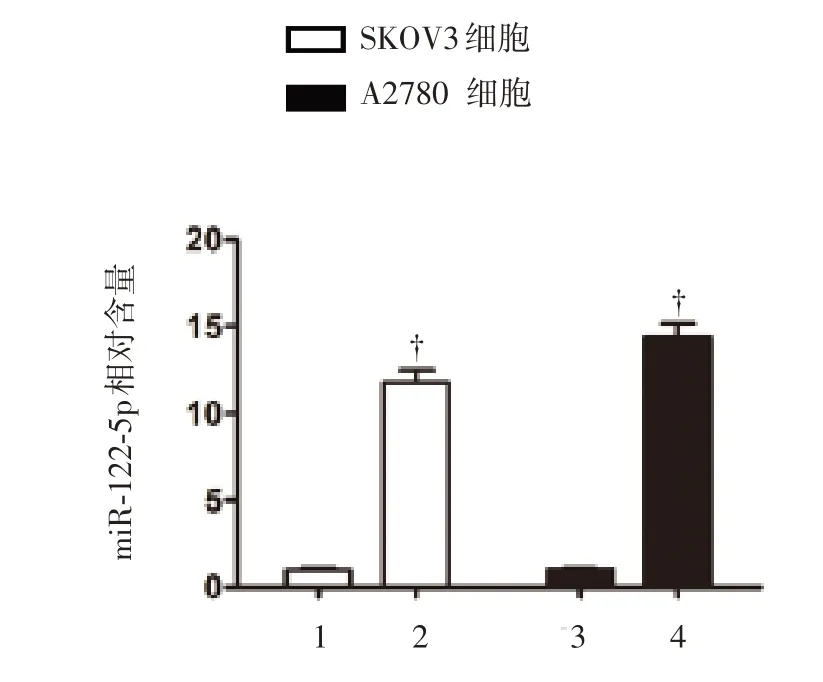
图1 SKOV3 和A2780 卵巢癌细胞转染miR-122-5p 的情况
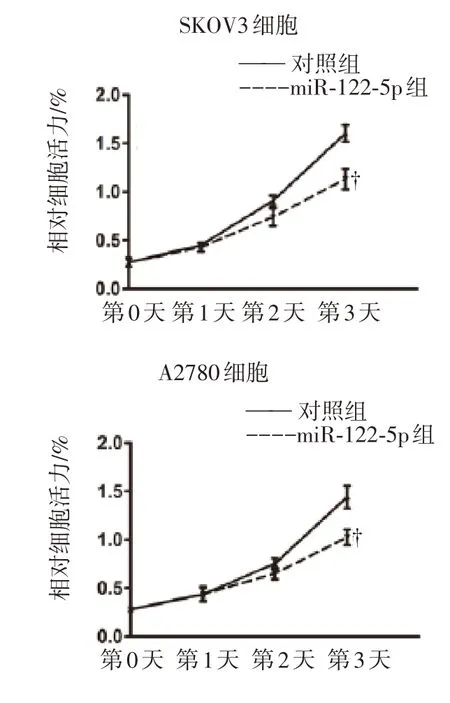
图2 SKOV3 和A2780 卵巢癌细胞转染miR-122-5p 后活性的变化

图3 SKOV3 和A2780 卵巢癌细胞转染miR-122-5p 后形成集落能力的变化
2.2 miR-122-5p 诱导卵巢癌细胞凋亡
上述证明了miR-122-5p 抑制卵巢癌细胞增殖,针对此点深入研究,阐述miR-122-5p 对卵巢癌细胞凋亡过程的影响。以转染空白载体作为对照组,转染miR-122-5p 后,SKOV3 和A2780 卵巢癌细胞的凋亡率明显增加(P<0.01),见图4。并且,转染miR-122-5p 后的SKOV3 和A2780 细胞较对照组有更高的Bax 表达和更低的BCL-2 及Cyclin D1表达,见图5。其中,Bax 是凋亡起始的重要蛋白,BCL-2 抑制细胞凋亡,Cyclin D1 促进细胞周期进展。
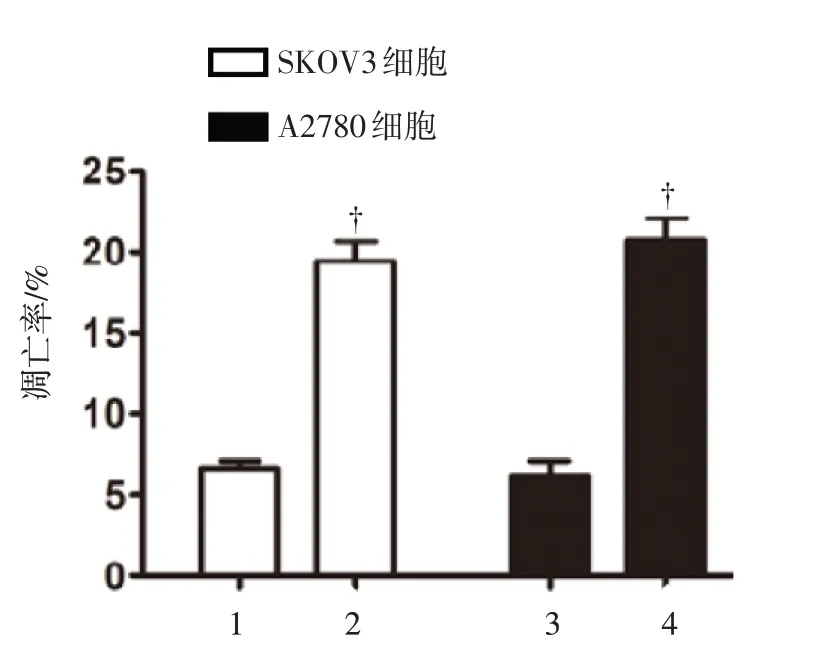
图4 SKOV3 和A2780 卵巢癌细胞转染miR-122-5p 后的凋亡率变化

图5 SKOV3 和A2780 卵巢癌细胞转染miR-122-5p 后Bax、BCL-2 及Cyclin D1 表达的变化
2.3 miR-122-5p 抑制卵巢癌细胞的体外侵袭转移能力
细胞增殖能力是评估肿瘤恶性程度的重要指标,但仍不全面,因为仍需考虑到肿瘤细胞的侵袭和转移能力。试验结果证明,以转染空白载体作为对照组,转染miR-122-5p 后的SKOV3 细胞和A2780 细胞的侵袭转移能力均大幅下降(P<0.01),见图6。
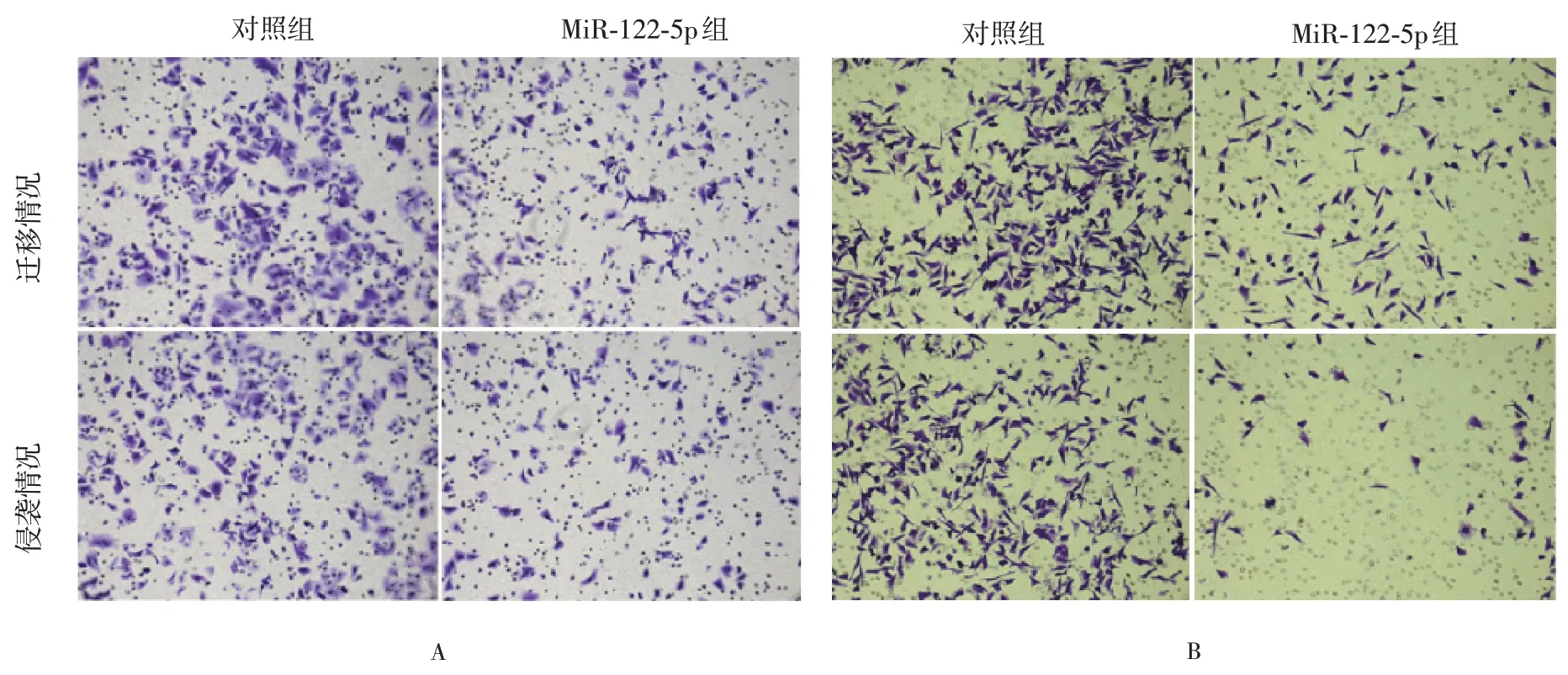
图6 卵巢癌细胞转染miR-122-5p 后侵袭及迁移能力的改变
2.4 ADAM10 是miR-122-5p 的直接靶基因
上述已阐明了miR-122-5p 能抑制卵巢癌细胞增殖和侵袭转移,仍需进一步寻找其作用靶点。该研究通过TargetScan 工具寻找到ADAM10 的3'UTR 可能是miR-122-5p 的作用位点。同时设计出该结合位点的突变体结构,见图7,后文中分别以野生型ADAM10 和突变型ADAM10 来区分。试验采用SKOV3 卵巢癌细胞,分为转染miR-122-5p组和转染空白载体的对照组,此外每组细胞亦转染野生型ADAM10 或突变型ADAM10 基因,应用荧光素酶检测方法判定miR-122-5p 对ADAM10 基因表达的调控作用。结果表明,在转染野生型ADAM10 基因的SKOV3 卵巢癌细胞中,共转染miR-122-5p 的细胞相比于对照组具有明显降低的荧光素酶活性(P<0.01);另一方面,在转染突变型ADAM10 基因的SKOV3 卵巢癌细胞中,共转染miR-122-5p 的细胞与对照组相比,荧光素酶活性无明显差异,见图8。

图7 miR-122-5p 的靶基因预测
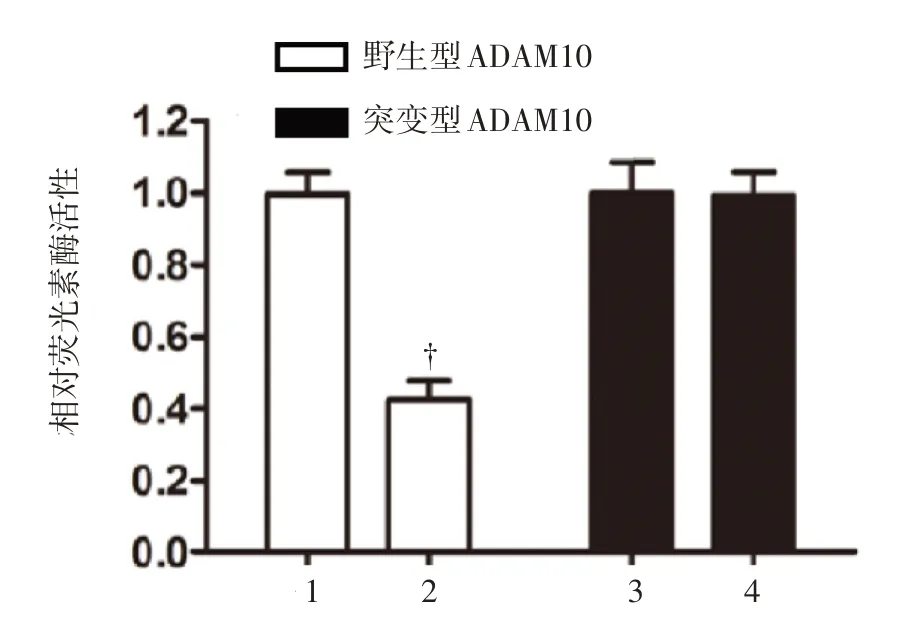
图8 共转染miR-122-5p 及野生型或突变型ADAM10基因后卵巢癌细胞的荧光素酶活性比较
进一步测定ADAM10 基因在转染miR-122-5p后的表达情况的变化。同样以转染空白载体作为对照组,两种细胞系SKOV3 和A2780 在转染miR-122-5p 后,较对照组细胞ADAM10 mRNA 水平均明显下降(二者均P<0.01),见图9,翻译的蛋白量亦明显下降(二者均P<0.01),见图10。上述结果表明miR-122-5p 直接作用于ADAM10 基因并抑制其表达。
2.5 miR-122-5p 调节卵巢细胞于体外对顺铂的敏感性
接下来评估卵巢癌细胞miR-122-5p 表达水平与其化疗敏感性的关系。试验采用顺铂耐药卵巢癌细胞株A2780/DDP,对照组为普通的顺铂敏感的A2780 细胞株。结果表明,相比于对照组,A2780/DDP 细胞的miR-122-5p 表达水平明显下降(P<0.01),见图11。进一步将耐药株A2780/DDP转染miR-122-5p,并以转染空白载体为对照组,通过qRT-PCR 验证顺铂耐药株A2780/DDP 卵巢癌细胞转染miR-122-5p 成功(P<0.01),见图12A。此后发现,耐药株A2780/DDP 转染miR-122-5p后,相比与对照组,其顺铂的半数抑制浓度(inhibitory concentration 50,IC50)明显下降(P<0.01),见图12B。最后,试验表明了A2780/DDP 转染miR-122-5p 后,比对照组细胞的凋亡率明显上升(P<0.01),见图12C。综合起来,这些结果阐明了增加miR-122-5p 的表达会提高卵巢癌细胞对顺铂的敏感性。

图9 卵巢癌细胞转染miR-122-5p 后ADAM10 mRNA含量的变化
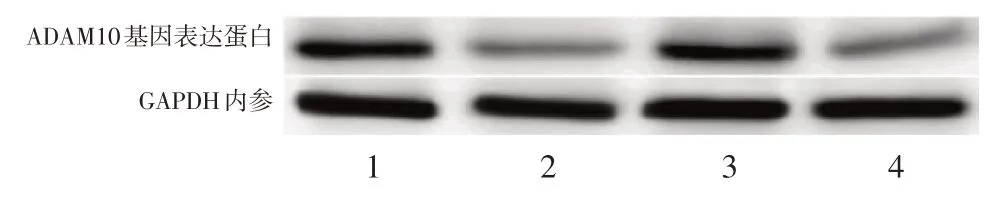
图10 卵巢癌细胞转染miR-122-5p 后ADAM10 基因表达蛋白含量下降

图11 普通细胞株A2780 和耐药株A2780/DDP 卵巢癌细胞所含miR-122-5p 表达量区别

图12 卵巢癌细胞转染miR-122-5p 后对顺铂的敏感性
3 讨论
miR-122-5p 作用广泛,目前已证明其在急性心肌损伤[8]、肝损伤[9]及鼠骨间充质干细胞分化中起到重要作用[10]。它还与脂肪肝和脂蛋白代谢有关[11],白介素22 介导miR-122-5p 促进角蛋白形成细胞的增殖[12]。同样地,很多研究表明miR-122-5p 与恶性肿瘤相关,如胃癌[4-5]、乳腺癌[6]等。故该研究旨在发现miR-122-5p 对卵巢癌的作用及机制。
该研究证明了miR-122-5p 通过负向调节ADAM10 基因的表达,能抑制卵巢癌细胞增殖、侵袭和转移。这与其他研究中miR-122-5p 与ADAM10基因对肿瘤细胞起到的作用相一致。比如上述提到的,胃癌中过表达miR-122-5p 与更小的肿瘤体积和更早的肿瘤分期是正相关的[4]。又如有研究发现沉默ADAM10 基因对胰腺癌细胞的活性无明显影响,但明显降低了癌细胞侵袭和转移的能力[13]。
顺铂耐药是临床进展期卵巢癌化疗面临的首要困难之一,诸多试验从各种方向尝试解决化疗耐药问题,可惜的是目前仍无较好的办法[14-15]。该研究尝试从miRNA 角度探讨其与化疗耐药的关联。幸运的是研究证明了顺铂耐药细胞株A2780/DDP 有较低的miR-122-5p 表达水平,过表达miR-122-5p 可以增加耐药株A2780/DDP 的凋亡率,并降低顺铂的半数抑制量(IC50)。为进一步研究卵巢癌化疗耐药机制及解决办法提供一些思路。
然而该试验仍有可以继续完善之处。首先,该研究仅仅停留在分子生物学和细胞学试验层面,动物学试验有待进一步开展。动物学试验的结果,是指导该研究成果转化为临床应用手段的不可或缺的基础。这一点对于miR-122-5p 能否帮助解决临床上卵巢癌铂类耐药的问题尤为重要。而且在体内试验中印证miR-122-5p 有效性的同时,也有机会观察其安全性。因为miRNA 在体内作用广泛,并非仅针对肿瘤细胞,故在明确miR-122-5p 对肿瘤作用的同时,也需要重视过表达miR-122-5p 是否会对机体产生明显的副作用。这可以在动物实验中进行初步观察和判断。比如荷瘤动物在引入过表达miR-122-5p后,是否出现体重下降更快或生存时间更短的现象。
此外,miR-122-5p 在卵巢癌流行病学中的作用需要进一步阐明。若能充分结合临床数据,阐述miR-122-5p 与患者癌症分期、预后、化疗敏感性以及肿瘤复发等方面的相关性,将能在后续试验中更加有方向性的深入研究miR-122-5p 对卵巢癌的作用及相关机制。
综上所述,本研究阐述了miR-122-5p 作为肿瘤抑制因子起作用,可以抑制卵巢癌细胞的增殖、侵袭和转移,并能降低其对顺铂的耐药性。这可能成为未来治疗卵巢癌的靶点。后续试验仍有待进一步开展。

