水提醇沉法提取蛹虫草多糖的工艺优化及体外抗氧化效果研究
师景双,袁 超,程月红,厉玉婷,李 静,任雪梅*
(1.山东省食品药品检验研究院,山东 济南 250101;2.山东省药学科学院 山东省生物药物重点实验室,山东济南 250101)
蛹虫草(Cordyceps militaris),又名北蛹虫草、北虫草[1]。蛹虫草含虫草多糖、虫草酸、虫草素、黄酮及甾醇等多种活性成分[2-3]。蛹虫草多糖具有抗氧化、免疫调节和抑制肿瘤细胞生长等诸多生理功能[4-6]。本文对蛹虫草多糖提取工艺进行优化,并对其体外抗氧化活性进行了研究,以期为蛹虫草多糖的开发研究提供参考和依据。
1 仪器与材料
1.1 仪器
MS204TS分析天平(梅特勒-托利多);SHA-B水浴恒温振荡器(金坛医疗仪器厂);TG16-WS离心机(万丰仪器制造公司);UV-2700紫外可见分光光度计(日本岛津);R-300旋转蒸发仪(瑞士步琦公司)。
1.2 材料与试剂
人工蛹虫草(市售);KH2PO4,FeSO4,FeCl3,铁氰化钾,水杨酸,双氧水,抗坏血酸,三氯乙酸,95 %乙醇,无水乙醇,葡萄糖,硫酸,蒽酮(分析纯,国药集团);1, 1-二苯基-2-三硝基苯肼(DPPH,上海阿拉丁);蒽酮试剂:精密称取蒽酮0.1 g,加80 %浓硫酸100 ml溶解,摇匀,当日配制使用。
2 方法
2.1 葡萄糖对照品溶液配制
将无水葡萄糖置于烘箱中,105 ℃干燥恒重。准确称取100 mg,用蒸馏水定容至100 ml,得对照品母液。取10 ml母液定容至100 ml,得0.1 mg/ml葡萄糖对照品溶液。
2.2 提取工艺
将蛹虫草粉碎过筛,取筛下物,加热水提取,提取完毕后收集滤液,残渣再次提取30 min,合并滤液,真空浓缩至固形物含量25 %~30 %后,加入3倍体积95 %乙醇沉淀多糖,4 ℃静置24 h,5000 r/min离心15 min,无水乙醇洗脱,冷冻干燥,得蛹虫草多糖。
2.3 虫草多糖的测定
分别吸取0.1 mg/ml葡萄糖对照品溶液0,0.2,0.4,0.6,0.8,1.0,1.2 ml,置于10 ml具塞比色管中,补充水至2.0 ml,加入蒽酮硫酸溶液6.0 ml,混匀,置沸水浴中加热15 min,取出,立即置于冰浴中冷却15 min,取出,空白管调零,625 nm测定吸光度[7],绘制标准曲线。
将粗多糖用蒸馏水溶解,定容于100 ml 量瓶,摇匀,得待测母液。将待测母液进行适宜倍数稀释,取稀释液1 ml,置于10 ml具塞比色管中,采用与标准曲线相同的操作步骤测定,按标准曲线计算多糖含量,按下式计算多糖提取率。
多糖提取率(%)=测得的多糖含量×稀释倍数/蛹虫草菌粉质量×100
2.4 单因素实验
选取菌粉粒度、料液比、提取温度、提取时间、提取次数5因素进行单因素实验,初步选定菌粉粒度80目、料液比1:15、提取温度70 ℃、提取时间2 h及提取次数1次为基本条件,改变其中一个条件,固定其他条件来考察各因素对蛹虫草多糖提取率的影响,以确定较优条件。其中菌粉粒度分别设为40,60,80,100目,料液比分别设为1:10,1:15,1:20,1:25,提取温度分别设为50,60,70,80 ℃,提取次数分别设为1,2,3,4次。
2.5 正交试验
根据单因素实验结果,对料液比、提取温度、提取时间、提取次数这4个因素进行4因素3水平的正交实验,进一步优化提取条件,并根据正交试验得出的优化条件进行验证实验。
2.6 体外抗氧化效果测定
2.6.1 蛹虫草多糖清除DPPH 自由基效果检测DPPH乙醇溶液本身为紫色,且在517 nm波长处有强烈吸收,加入抗氧化剂后其颜色变浅,以在517 nm波长处吸光度的下降值表示抗氧化剂对DPPH自由基的清除能力[8-9]。参考李志平等[10]的方法,略作改动,于具塞试管中加入 DPPH乙醇溶液(0.2 mmol/l)1 ml,分别加入不同浓度的样品溶液1 ml,混匀,室温下避光静置30 min,517 nm处测定吸光度值,同时选取抗坏血酸为作为阳性对照,DPPH自由基的清除率按以下公式计算。
式中,A0为空白样品吸光度值,A1为加样后的吸光度值,A2为以蒸馏水代替DPPH的吸光度值。
2.6.2 蛹虫草多糖清除羟自由基效果测定 羟自由基是机体代谢产物,是机体内起主要作用的自由基之一。参考邵双双等[11]的方法,向2 ml不同浓度的样品溶液中加入6mmol/L FeSO4溶液2 ml,混匀后加入6 mmol/L H2O2溶液2 ml,摇匀,静置10 min,加入6 mmol/L水杨酸2 ml,混匀后再次静置10 min,于510 nm 处测定吸光度值。同时选取抗坏血酸为作为阳性对照,按下式计算羟自由基的清除率。
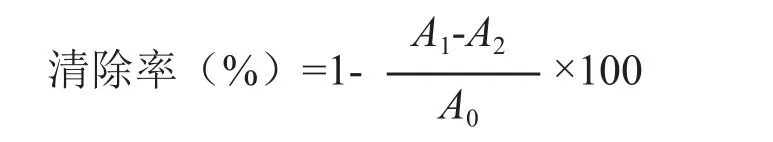
式中,A0为空白样品吸光度值,A1为加样后吸光度值,A2为以蒸馏水代替H2O2溶液的吸光度值。
3 结果与分析
3.1 标准曲线绘制
以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线。计算得回归方程为A=0.0044C+0.0127,相关系数R2=0.9998。
3.2 单因素实验
3.2.1 菌粉粒度对蛹虫草多糖提取率的影响 结果见图1。原料粒度的大小决定原料的表面积,进而影响与溶剂的接触和传质过程,原料直径愈小,溶剂与原料接触愈充分,提取速度也就愈快。由图1可见,菌粉粒度从40目到80目变化过程中,蛹虫草多糖的提取率呈明显上升趋势,从80目到100目多糖提取率开始呈现缓慢下降趋势,分析原因为:80目筛下物已完全达到蛹虫草多糖提取所需的破碎程度,随着破碎程度的增大,100目筛下物提取完毕后过滤阻力明显增大,蛹虫草粉压实引起小部分多糖损失故多糖提取率开始呈下降趋势,因此80目为蛹虫草多糖提取的较优菌粉粒度。
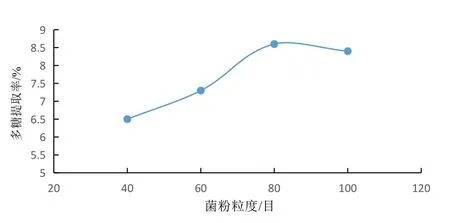
图1 菌粉粒度对提取率的影响
3.2.2 料液比对蛹虫草多糖提取率的影响 结果见图2。料液比增大,可降低菌粉颗粒周围多糖的浓度,增大细胞内、外的渗透压差,有利于蛹虫草多糖的进一步溶出。因此,实际生产中通常可考虑加大提取溶液的用量来获得较高的提取率。由图2可见,料液比从1:10提高至1:20的过程中,蛹虫草多糖提取率的增大趋势显著,继续提高料液比,提取率增大趋势不再明显。且过高的料液比会对后期的浓缩工序造成压力,综合考虑生产周期及经济成本等因素,一味通过提高料液比来增大提取率是不可取的,因此1:20为蛹虫草多糖提取的较优料液比。
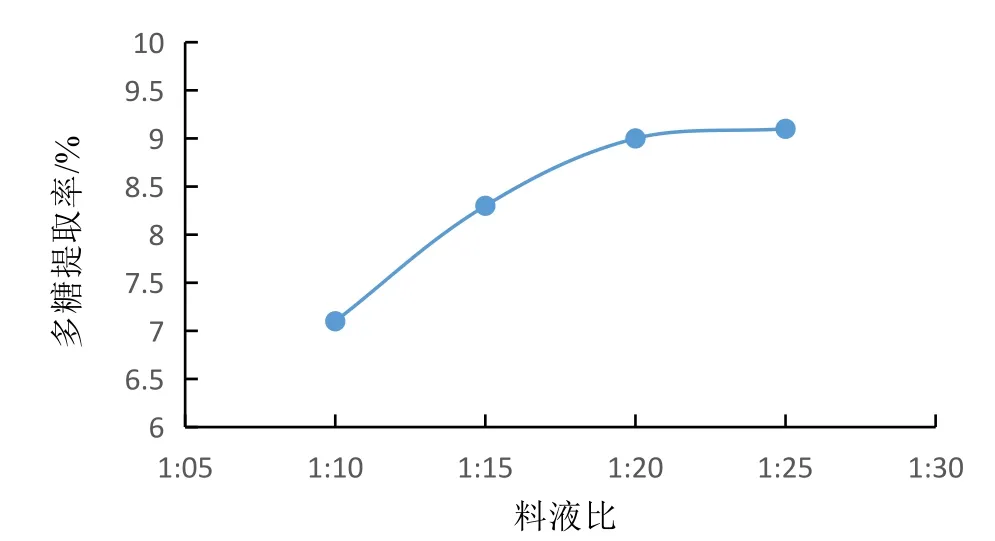
图2 料液比例对提取率的影响
3.2.3 提取温度对蛹虫草多糖提取率的影响 结果见图3。随着水浴温度的升高,分子热运动加快,细胞内容物的穿透力增强,蛹虫草多糖得率亦随之增加。由图3可见,温度从50 ℃上升至70 ℃过程中,多糖提取率呈直线上升趋势,70 ℃后增加趋势开始较缓慢,这是由于蛹虫草多糖是活性物质,温度过高易造成其结构破坏,进而影响其生物活性。因此综合考虑70 ℃为蛹虫草多糖的较优提取温度。
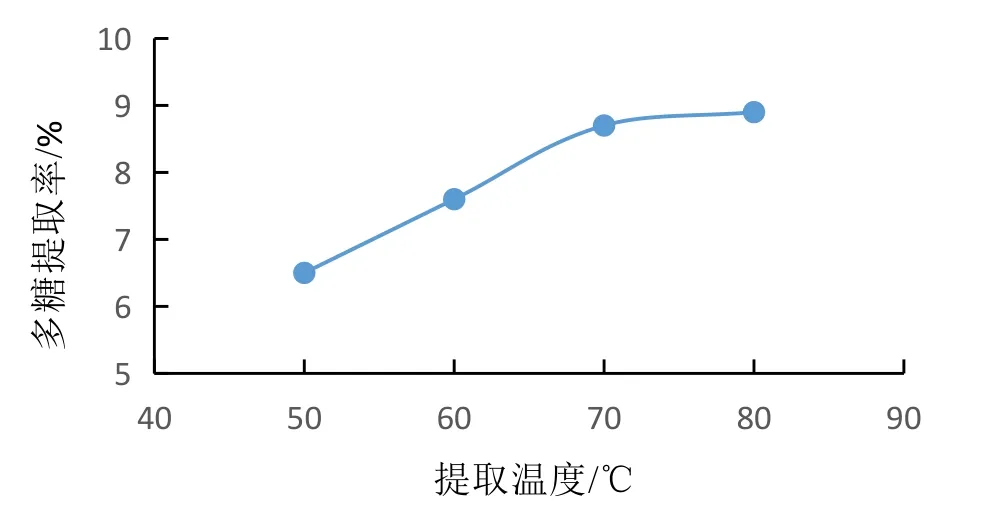
图3 提取温度对提取率的影响
3.2.4 提取时间对蛹虫草多糖提取率的影响 结果见图4。提取时间可直接影响蛹虫草多糖的溶出,理论上讲,时间越长,越有利于蛹虫草多糖的溶出,但随着提取时间的延长,细胞内、外渗透压逐渐趋于平衡,多糖进入水溶液中的推动力也在逐渐下降,长时间的热提取也会造成一部分蛹虫草多糖的降解。由图4可见,当提取时间达到2 h时,多糖的提取率达峰值,2 h后多糖的提取率开始呈下降趋势,综合考虑能源损耗和节成本,2 h为蛹虫草多糖的较优提取时间。

图4 提取时间对提取率的影响
3.2.5 提取次数对蛹虫草多糖提取率的影响 结果见图5。长时间的单次提取,不仅会造成多糖溶出效率降低,且提取出来的多糖还会发生部分降解。所以实验设计多次提取方案,一次提取之后,将残渣加入5倍菌粉的蒸馏水,分别进行2次、3次、4次提取。由图5可见,3次提取后多糖的提取率基本不再发生变化,说明多糖已提取完全。故3次提取为蛹虫草多糖的较优提取次数。

图5 提取次数对提取率的影响
3.3 正交试验
在单因素实验基础上,采用L9(34)正交试验对料液比例、提取温度、提取时间、提取次数这4个因素条件进行优化,因素水平表的设置见表1。

表1 正交试验因素水平表
根据表1的设计进行正交实验,结果见表2。
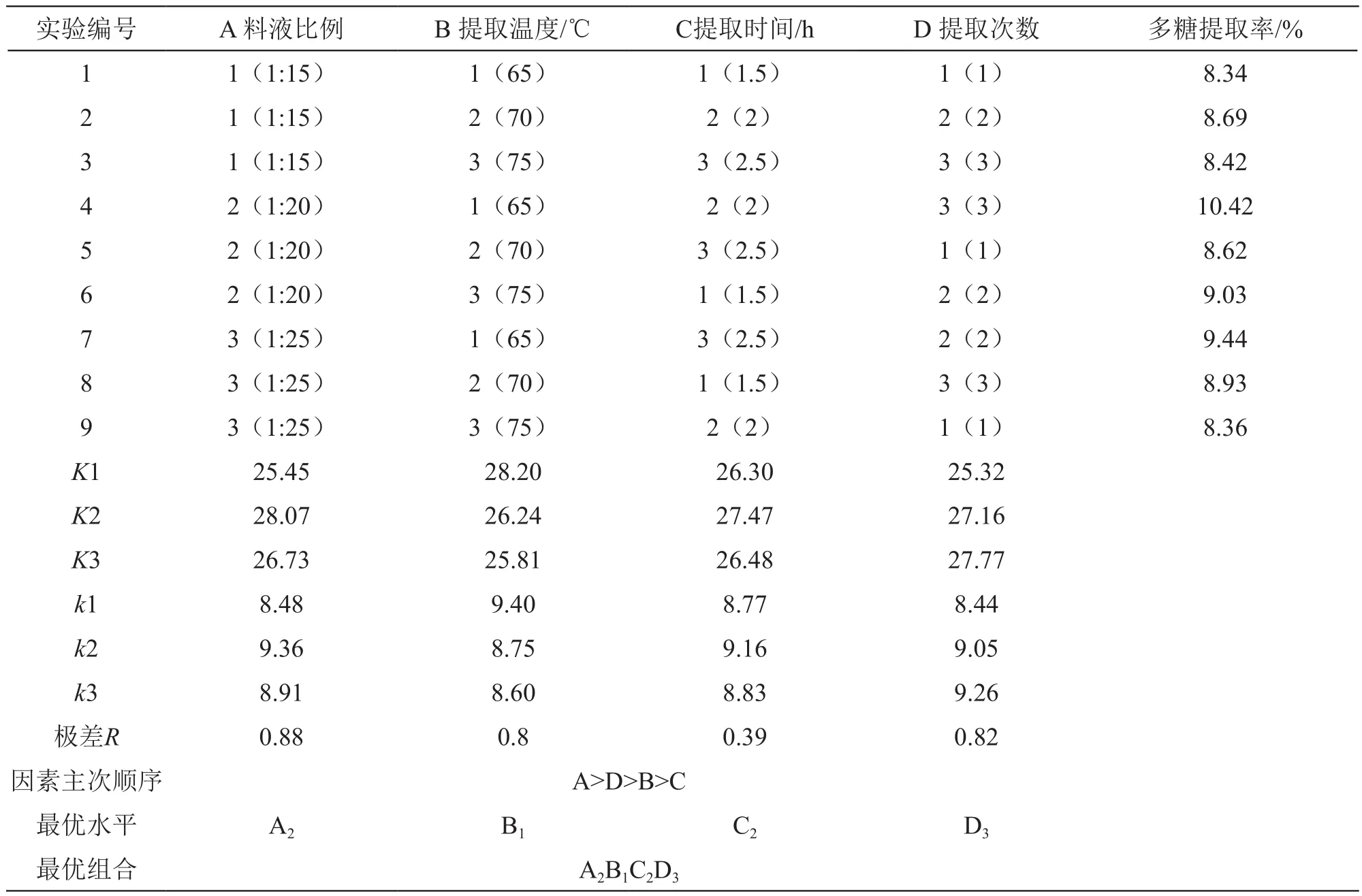
表2 正交试验结果
由正交试验结果可知,各因素对多糖提取率影响的主次顺序为A>D>B>C,即料液比>提取次数>提取温度>提取时间;最佳提取条件为A2B1C2D3,即料液比1:20、提取温度65 ℃、提取时间2 h、提取次数3次。在此条件下多糖提取率为10.42 %,与正交实验最优组(第4组)相符。
3.4 体外抗氧化活性测定
3.4.1 DPPH自由基清除能力测定 结果见图6。由图6可见,随着多糖和抗坏血酸浓度的增加,DPPH自由基的清除率呈上升趋势,同浓度下抗坏血酸清除DPPH 自由基的能力更强;随着浓度的增加,二者清除DPPH自由基能力的差距逐渐减小,当浓度为1.2 mg/ml时,多糖对DPPH自由基的清除率为50.28 %,为同浓度下抗坏血酸的54.29 %。
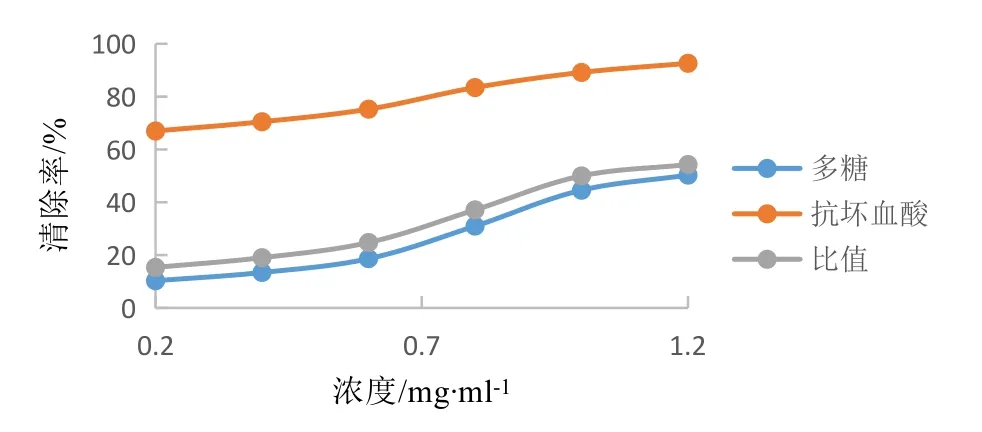
图6 多糖与抗坏血酸清除DPPH自由基效果
3.4.2 羟自由基清除能力 结果见图7。由图7可见,随着多糖和抗坏血酸浓度的增加,羟自由基的清除率呈上升趋势,当多糖浓度在0.2~1.0 mg/ml范围内时,清除率增速明显,同浓度下抗坏血酸清除羟自由基的能力更强;随着浓度的增加,二者清除羟自由基能力的差距在逐渐减小,当浓度为1.2 mg/ml时,多糖对羟自由基的清除率为60.29 %,为同浓度下抗坏血酸的65.69 %。
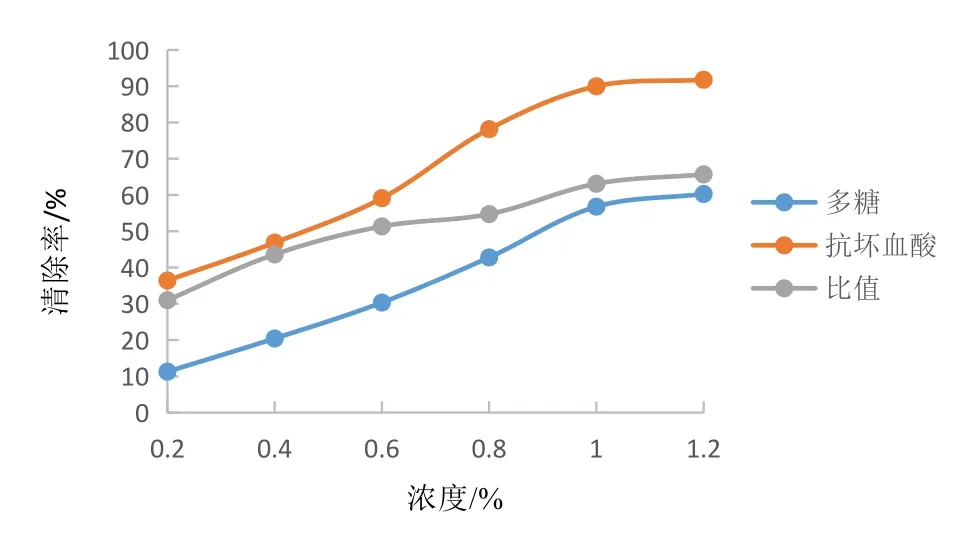
图7 多糖与抗坏血酸清除羟自由基效果
4 结论
采用水提醇沉法提取蛹虫草多糖,通过单因素实验、正交试验优化提取工艺,得出最佳提取条件为菌粉粒度80目、料液比1:20、提取温度65 ℃、提取时间2 h、提取次数3次,在此条件下,提取率达10.42 %。DPPH自由基和羟自由基清除能力反应了多糖的抗氧化活性,在一定浓度范围内,随着浓度的增加,DPPH自由基和羟自由基的清除率呈上升趋势,即多糖的抗氧化活性随浓度的增大不断增强。虽然同浓度下抗坏血酸的清除能力比多糖强,但是随着浓度的增加二者的差距在不断减小,当浓度为1.2 mg/ml时,多糖对DPPH自由基、羟自由基的清除率分别为50.28 %,60.29 %,为同浓度下抗坏血酸的54.29 %,65.69 %。
陈安徽等[12]的研究表明,采用80 ℃一次提取,蛹虫草多糖的提取率为9.31 %,对提取的多糖进行清除DPPH自由基清除能力检测,结果显示当多糖浓度为1.2 mg/ml时,清除率为29.45 %。本研究采用较低的水解温度,进行分次提取,不仅提高了多糖的提取率,且更好地保留了其抗氧化活性,为蛹虫草多糖的开发利用奠定了一定的基础。

