乳酸菌制剂对环磷酰胺致大鼠免疫抑制的调节作用
张振忠 ,岳寿松,陈 靓,滕素玲,孙培录,王 燕,李 军 *
(1.济南大学 山东省医学科学院 医学与生命科学学院,山东 济南 250200;2.山东第一医科大学 山东省医学科学院 药物研究所,山东 济南 250062;3.山东省农业科学院 生物技术研究中心,山东 济南 250100;4.国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062)
环磷酰胺(cyclophosphamide,CTX)是最常用的烷化剂类抗肿瘤药物之一[1],同多种化疗药物一样在杀伤肿瘤细胞的同时还对患者产生毒副作用尤其是对免疫系统产生抑制,这是困扰其在肿瘤化疗中应用的难题[2]。探寻改善化疗药物的毒副作用、提高机体免疫措施一直是人们关注的重点。乳酸菌作为公认的益生菌,已在食品及医药行业中广泛应用,已有研究显示其可调节机体免疫系统,进一步提高机体抗肿瘤能力[3]。因此深入研究乳酸菌对免疫活性的影响具有重要临床意义。本研究选用3种乳酸菌菌株配比形成的复合制剂,研究其对环磷酰胺所致免疫低下大鼠模型的免疫调节作用,以期为肿瘤化疗探寻新的辅助干预措施。
1 仪器与材料
1.1 仪器
YP3001N型电子天平(上海精密科学仪器有限公司);SL3001N型电子天平(上海民桥精密科学仪器有限公司);LDZ5-2低速自动平衡离心机(北京京立离心机有限公司);J-25型高速冷冻离心机(美国Beckman公司);XT-2000iv自动血球分析仪(日本希森美康东亚株式会社);Infinite M200 PRO全波长酶标仪(法国TECAN公司);BD FACSCalibur流式细胞仪(美国BD公司);CFX96 Touch荧光定量PCR仪(美国伯乐公司)。
1.2 试剂
乳酸菌制剂由山东省农业科学院生物技术研究中心微生物研究室制备。将嗜酸乳杆菌(Lactobacillus acidophilus)SD65、干酪乳杆菌(Lactobacillus casei)SD07和植物乳杆菌(Lactobacillus plantarum)SD02分别活化、液体培养,收集菌体,生理盐水悬浮菌体成109CFU/ml,等比例混合制得;注射用环磷酰胺(CTX,江苏盛迪医药有限公司,规格:0.2 g/支);血液学质控品(Sysmex Corporation);血液学检测试剂盒[Sysmex Corporation及希森美康生物科技(无锡)有限公司];流式细胞检测CD4、CD8抗体(Ebioscience公司生产);SYBR GreenqPCR Master mix(日本TOYOBO公司);TRIzol®试剂(Thermo Fisher Scientific);cDNA反转录试剂盒(Thermo Fisher Scientific)。
1.3 实验动物
Sprague-Dawley(SD)大鼠,SPF级,雄性,体重260~316 g,购自济南朋悦实验动物繁育有限公司,实验动物生产许可证号:SCXK(鲁)2014 0007。动物饲养于山东省医学科学院药物研究所普通动物房。实验动物使用许可证号:SYXK(鲁)2017 0003。试验方案通过山东省医学科学院药物研究所实验动物伦理委员会同意。
2 方法
2.1 实验动物的分组与给药
雄性SD大鼠50只,随机分为正常对照组、模型组、乳酸菌制剂1.25,2.5,5 ml/kg 3个剂量组,每组10只。除正常对照组外,各组动物于第1,5,8,15,22天腹腔注射10 mg/ml的CTX,给药体积4 ml/kg;正常对照组注射等体积生理盐水。同时从第1天开始,乳酸菌制剂组灌胃给予乳酸菌制剂原液1.25,2.5,5.0 ml/kg,模型组和正常对照组给予等容积的动物饮用水,灌胃前分别以动物饮用水补足5.0 ml/kg。
2.2 指标检测
2.2.1 动物体重测量 分别于动物开始给药后每隔1周左右称量体重。试验结束剖检称量动物脏器重、计算脏器系数。
2.2.2 血常规指标检测 动物禁食不禁水12~15 h,采抗凝血,测定白细胞计数、中性粒细胞比率和淋巴细胞比率。
2.2.3 淋巴细胞亚群检测 取抗凝全血100 μl,流式细胞仪检测淋巴细胞亚群。
2.2.4 血清白介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平检测 取血清,酶联免疫法检测IL-6和TNF-α水平。
2.2.5 脾脏IL-2、IL-6及TNF-α基因表达水平检测摘取脾脏液氮冻存,采用TRIzol®试剂提取总RNA,采用逆转录实时定量PCR检测脾脏IL-2、IL-6以及TNF-α基因表达水平,实验所需各基因的引物序列见表1。
2.3 统计学分析
采用SPSS 22.0对实验结果进行单因素方差分析,数据均以平均值±标差(±s)表示。
3 结果与分析
3.1 乳酸菌制剂对大鼠生长的影响
CTX模型组大鼠在灌胃给药的第7天~药后27天,动物体重增重缓慢,体重显著低于正常对照组(P<0.01或P<0.05)。乳酸菌制剂干预后第7天~药后27天动物体重高于CTX模型组(P<0.01或P<0.05),且作用呈剂量相关性。结果见表2。

表1 实时定量PCR检测基因的引物序列
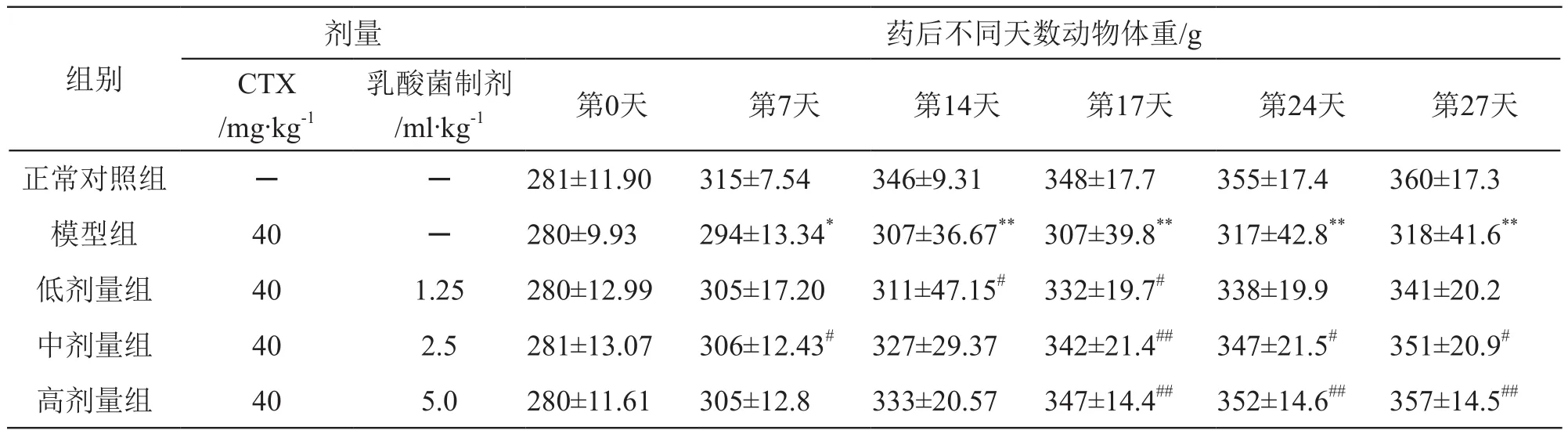
表2 乳酸菌制剂对大鼠体重增长的影响(n=10)
3.2 乳酸菌制剂对大鼠胸腺和脾脏系数的影响
结果见表3。由表3可见,CTX模型组大鼠的胸腺指数显著低于正常对照组,差异有统计学意义(P<0.01),表明CTX有较强的免疫抑制毒性。乳酸菌制剂5 ml/kg组大鼠胸腺指数高于模型组,差异有统计学意义(P<0.05)。乳酸菌制剂2.5,5 ml/kg组大鼠脾脏指数高于模型对照组,差异有高度统计学意义(P<0.01)。

表3 乳酸菌制剂对胸腺和脾脏指数的影响(n=10)
3.3 乳酸菌制剂对大鼠部分免疫细胞的影响
结果见表4。由表4可见,CTX模型组大鼠的白细胞数目、淋巴细胞数目均低于正常对照组,差异有高度统计学意义(P<0.01)。乳酸菌制剂高剂量组白细胞数目高于模型组,差异有统计学意义(P<0.05);乳酸菌制剂低、中、高剂量组CD4/CD8均高于模型组,差异有统计学意义(P<0.05或P<0.01)。
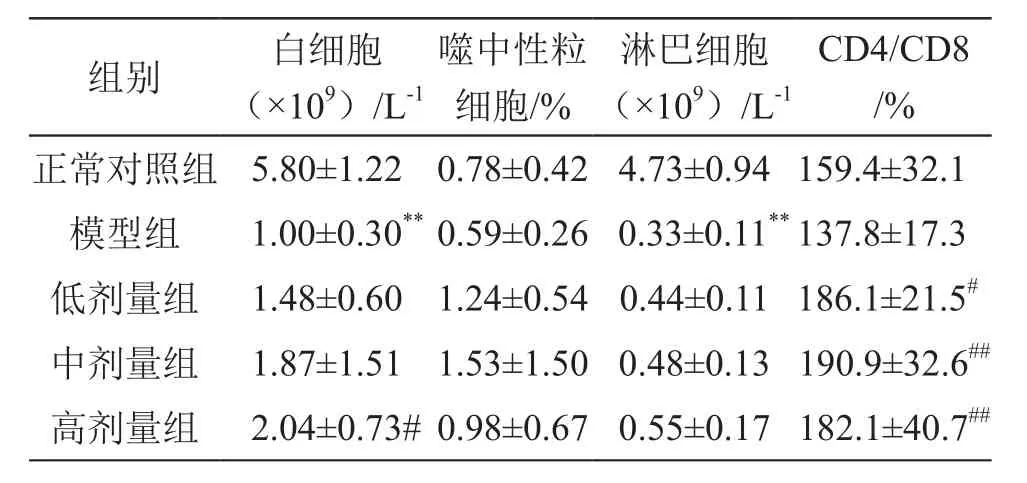
表4 乳酸菌制剂对大鼠部分固有免疫细胞及CD4/CD8的影响(n=10)
3.4 乳酸菌制剂对大鼠血清IL-6、TNF-α含量的影响
结果见表5。由表5可见,模型组大鼠血清IL-6含量低于正常对照组(P<0.05),TNF-α含量高于正常对照组(P<0.05或P<0.01)。乳酸菌制剂2.5,5.0 ml/kg剂量组血清IL-6含量显著高于模型组(P<0.05);乳酸菌制剂1.25,2.5,5.0 ml/kg剂量组血清TNF-α含量显著低于模型组(P<0.05或P<0.01)。

表5 乳酸菌制剂对大鼠血清IL-6、TNF-α含量(n=10)
3.5 乳酸菌制剂对大鼠IL-2、IL-6以及TNF-α基因表达的影响
实时定量PCR检测大鼠脾脏相关基因的表达结果见图1。模型组大鼠的IL-2和IL-6的表达水平显著低于正常对照组(P<0.05),模型组的TNF-α表达水平显著高于正常对照组(P<0.01)。乳酸菌制剂2.5,5.0 ml/kg干预组IL-2基因表达水平高于模型组(P<0.05),2.5 ml/kg干预组IL-6基因表达水平高于模型组(P<0.05),作用呈剂量依赖性。乳酸菌制剂高剂量组的TNF-α基因表达水平显著低于模型组,差异有统计学意义(P<0.05)。
4 讨论
CTX作为抗肿瘤药物,主要用于恶性淋巴瘤、多发性骨髓瘤、白血病、乳腺癌等的治疗[1,4-5]。它代谢生成的丙烯醛可产生膀胱炎、血尿等一系列尿毒性症状[6]。CTX还能杀伤免疫细胞,进而影响免疫的各阶段,严重干扰人的正常免疫功能。本实验参考文献[2]方法并略作改进,大鼠腹腔注射40 mg/kg CTX 5次后,大鼠的体重增长显著滞后于正常对照组、免疫器官萎缩变小,免疫细胞数量减少,刺激免疫应答的IL-2、IL-6含量降低,损伤相关因子TNF-α的含量显著增加。由此可见应用CTX腹腔注射大鼠可对动物产生较全面的毒性作用,特别是造成大鼠免疫功能低下的状态。此模型可用于观察不同剂量的乳酸菌制剂对大鼠损伤及免疫功能的影响。
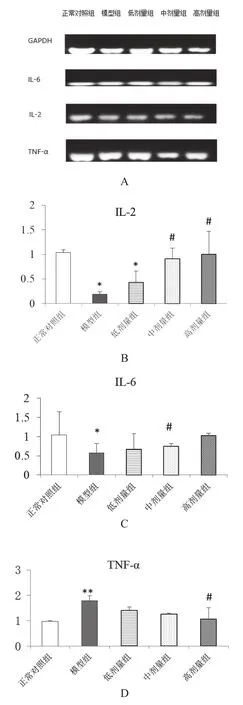
图1 乳酸菌制剂对大鼠IL-2、IL-6及TNF-α基因表达的影响
免疫系统由免疫器官、免疫细胞和免疫活性物质组成,机体免疫应答可分为固有性免疫(先天性免疫或非特异性免疫)和适应性免疫(获得性免疫或特异性免疫)两大类,执行机体免疫监视、防御、调控等功能。机体紊乱或者环境、药物、治疗等引起的免疫系统任一方面异常都可能引起免疫功能的障碍[7]。肿瘤发生过程的初期免疫机能失衡,同时又由于化疗过程中化疗药物对免疫系统的损伤,进一步影响机体的免疫机能,降低了机体对肿瘤的自我抵抗能力。已有研究显示乳酸菌可调节机体免疫系统,提高机体抗肿瘤能力[3]。筛选化疗损伤状态下提高人休免疫活性的乳酸菌菌株,研究乳酸菌对CTX等化疗药物损伤免疫应答不同时期干预作用的效果及机制有重要的临床意义。
本研究以3种乳酸菌制得的口服制剂为研究对象,研究其对机体的免疫调节作用。研究结果表明乳酸菌复合制剂可明显提高CTX所致免疫低下大鼠的免疫功能,有望在临床上应用于化疗免疫低下病人的辅助治疗。

