莫达非尼片在健康人体的药代动力学研究
黄 露,苏 琼,郭源源
(华中科技大学同济医学院附属梨园医院,湖北 武汉 430077)
莫达非尼(Modafinil)是一种觉醒促进剂,用于治疗发作性嗜睡病、阻塞性睡眠呼吸暂停相关的白天过度嗜睡等紊乱症。莫达非尼也在适应症外被广泛使用为认知增强剂。国内外在健康志愿者中进行的莫达非尼药动学研究表明,口服莫达非尼后吸收迅速,血药浓度约2~4 h达峰值,在人体内分布非常广泛,表观分布容积达0.9 L/Kg;莫达非尼主要在肝脏中水解灭活,代谢产物经肾脏排出体外,平均总血浆清除率约为0.6 ml/(min·kg)-1,多次给药的血浆平均有效半衰期约为15 h[1-4]。本文研究莫达非尼片在中国健康男性体内单次给药和多次给药的药动学行为[5],为国内外临床应用莫达非尼片提供药动学依据。
1 仪器与材料
1.1 仪器
高效液相色谱仪(包括LC-20AT泵,SPDM20A型紫外检测器,SIL-20A自动进样器,日本岛津);数据采集:LCsolution工作站;AUW220D分析天平(日本岛津);H-101涡旋振荡器(上海康禾);BP16型高速冷冻离心机(北京白洋医用离心机公司)。
1.2 药品与试剂
莫达非尼片(规格:100 mg/片,批号:20181101,北京双鹭药业股份有限公司);莫达非尼对照品(纯度:>99 %,批号:100156-199801,中国食品药品检定研究院);卡马西平对照品(纯度:>99 %,批号:100142-199503,中国食品药品检定研究院);乙腈,甲醇(色谱纯,天津科密欧公司);双蒸水(自制);磷酸(分析纯,中国医药集团上海化学试剂公司);盐酸(分析纯,上海山浦化工)。
2 方法与结果
2.1 试验方案
因拟将莫达非尼片开发成为治疗男性少精和弱精症药物,本试验选取30名健康男性志愿者作为受试对象,并随机分为3组,分别为低、中、高剂量组。试验前经全面体检证明心、肺、肝、肾功能正常。无烟酒等不良嗜好。试验前2周至试验期间不用任何其他药物。3组受试者年龄分别为(22±1.75),(23±1.58),(22±1.91)岁,身高分别为(1.74±0.07),(1.67±0.06),(1.70±0.06)m,体质量分别为(66.81±8.62),(58.86±7.45),(59.75±8.23)kg。试验方案经医学院伦理委员会审批同意。受试者均在试验前由本人签署知情同意书。
受试者服药前禁食过夜至少10 h,于次日早晨空腹给药,200 ml温水送服。给药2 h后方可饮水,4 h后统一进食低脂清淡饮食。
单次口服给药:低、中、高剂量分别为100,200,400 mg,给药1次,并于给药前0 h及给药后0.25,0.5,1,1.5,2,2.5,3,3.5,4,6,8,12,24,36,48,60 h 于肘静脉采血3 ml。
多次口服给药:单次口服给药中剂量组在单次给药结束后即入组多次给药试验。多次给药组每天给药1次,每次200 mg,每天早晨同一时间点给药,连续给药7 d。于给药后的第3,4,5,6天早晨服药前采血,第7天服药前及服药后0.25,0.5,1,1.5,2,2.5,3,3.5,4,6,8,12,24,36,48,60 h于肘静脉采血3 ml。血标本在30 min内离心(3000 r/min) 10 min,收集血浆,保存于-70 ℃冰箱待测[6-7]。
试验期间受试者均在监护室内,避免剧烈运动,禁服茶、咖啡类和醇类饮料,由研究人员及临床医师实施医疗监护。观察试验期间可能出现的不良事件,并做出详细记录和及时处理。试验结束后进行全面检查,对比试验前实验室检查结果,并作出异常判断。
2.2 HPLC测定血药浓度
2.2.1 色谱条件 固定相为Thermo ODS-2色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈:水(磷酸调pH 3.0)=30:70,流速为1.0 ml/min,柱温为25℃,检测波长为220 nm。
2.2.2 标准溶液配制 以甲醇为溶剂,配制莫达非尼标准溶液,浓度分别为0.8,2,10,25,50,100,120,150 µg/ml。另用甲醇配置浓度为12 µg/ml的卡马西平标准液(内标液)。标准溶液均于室温密封保存备用。
2.2.3 样品处理 精密吸取血浆样本200 µl,加入20µl内标溶液(12 µg/ml),加入10 mol/L的盐酸溶液20 µl,涡旋混匀后加入甲醇0.4 ml,涡旋混匀5 min,14 000 r/min离心10 min,取上清20 µl进样,按2.2.1项色谱条件进样分析。
2.2.4 专属性试验 按2.2.3项血浆处理方法和2.2.1项色谱条件分析,所得色谱图见图1。莫达非尼和内标卡马西平的保留时间分别为8.3,13.0 min,血浆中杂质不干扰测定,峰形良好。
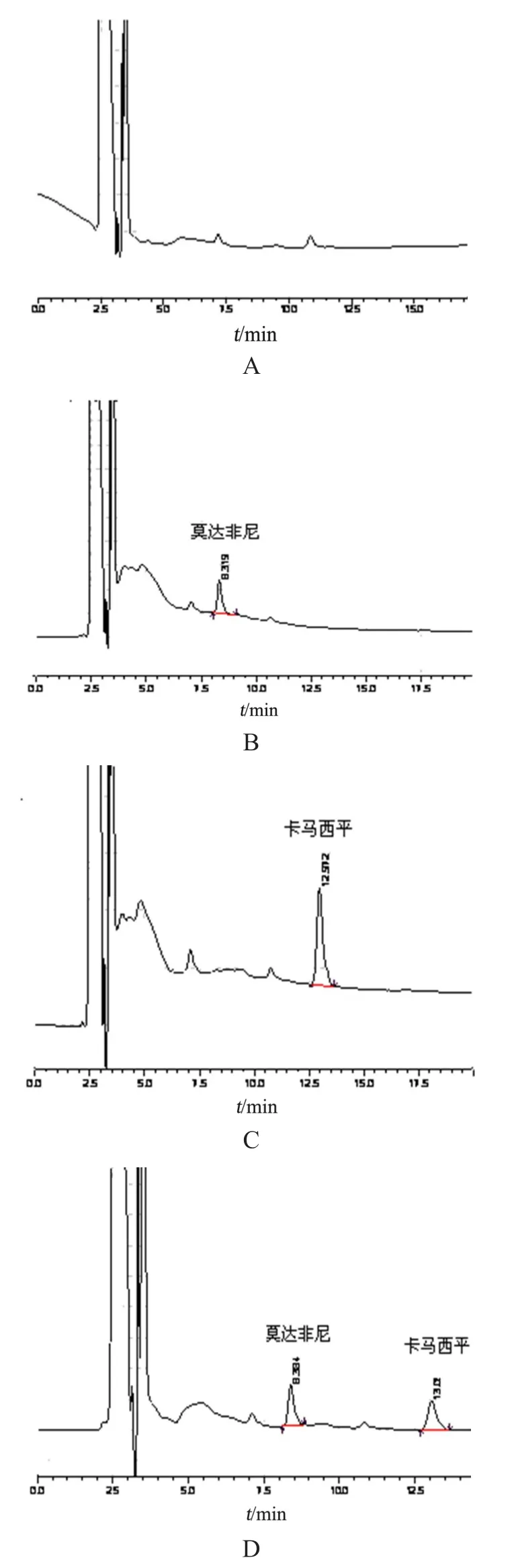
图1 莫达非尼专属性色谱图
2.2.5 标准曲线和定量限 吸取空白血浆180 µl,加入莫达非尼系列标准溶液20 µl,配制成相当于莫达非尼血药浓度为0.08,0.2,1.0,2.5,5.0,10.0,12.0,15.0 µg/ml的血浆样本,按2.2.3项方法操作,以莫达非尼与内标的峰面积比值(Y)对莫达非尼浓度(C)进行回归运算(权重为1/C2),所得标准曲线方程为Y=0.381C-0.011(r=0.9994),线性范围为0.08~15.0 µg/ml。
2.2.6 方法精密度和相对回收率 吸取空白血浆180µl,加入莫达非尼标准溶液20 µl,配制成相当于莫达非尼血药浓度为0.2,2.5,12.0 µg/ml的低、中、高浓度血浆样本,按2.2.3项方法操作,每个浓度平行处理5份,连续测定3 d,计算相对回收率及日内、日间精密度,结果见表1。相对回收率为将药物与内标峰面积比代入回归方程计算所得的莫达非尼浓度与理论浓度的比值。由表1可见,日内、日间精密度均小于9.00 %,相对回收率RSD均小于5.0 %,符合试验要求。
2.2.7 绝对回收率 吸取双蒸水180 µl,加入莫达非尼低、中、高浓度的标准溶液20 µl,配制成终浓度为0.2,2.5,12 µg/ml的标样各5份,按2.2.3项方法自“加入20 µl内标溶液”起操作,记录峰面积;分别测定低、中、高浓度(0.2,2.5,12 µg/ml)血浆样本,每个浓度配制5份,记录峰面积。绝对回收率为低、中、高浓度血浆样本峰面积与相应浓度标样峰面积均值的比值,见表1。由表1可见,绝对回收率RSD均小于6.0 %,符合试验要求。
2.2.8 稳定性考察 配制莫达非尼血药浓度为0.2,2.5,12.0 µg/ml的低、中、高浓度血浆样本,分别对血浆样本室温放置稳定性(室温放置6 h)、冻融稳定性(反复冻融3次)、长期冷冻稳定性(-70℃冰箱保存4周)及血浆样本处理后稳定性(室温放置12 h)进行考察。各浓度稳定性考察的RSD均小于7.0 %,表明血浆样本在上述条件下放置稳定。
2.3 质控样本制备和质量控制
按2.2.6项方法配制莫达非尼血药浓度分别为0.2,2.5,12.0 µg/ml的血浆样本,在受试者血样分析过程中均匀分配,进行分析质量控制。结果表明所有质控样本偏差均小于15.0 %,表明该分析方法稳定。
2.4 数据分析
采用非房室模型参数估算方法,应用药理学计算软件DAS2.0计算药动学参数,应用SPSS15.0软件包进行参数方差分析(ANOVA),差异有统计学意义的标准为P<0.05。单次口服给药低、中、高3个剂量组及中剂量单次和多次口服给药两个剂量组间药动学参数的比较:AUC0-t、AUC0-∞、Cmax经剂量校正后采用方差分析;Tmax、Vz/F、CLz/F、t1/2z直接采用方差分析[8-9]。结果见表2、图2~4。
单因素方差分析结果表明,单次口服莫达非尼片100,200,400 mg后,3个剂量组主要药动学参数剂量校正后血药浓度-时间(0-t)曲线下面积(AUC0-t/D)、剂量校正后血药浓度-时间(0-t∞)曲线下面积(AUC0-∞/D)、剂量校正后达峰浓度(Cmax/D)、t1/2z、CLz/F和Vz/F组间差异均无统计学意义(P>0.05),说明单次口服莫达非尼片在男性健康受试者体内代谢规律符合线性药动学特征。
中剂量组多次给药达稳态时的AUC0-t、AUC0-∞比单次给药时升高,单次和多次给药组间AUC0-t、AUC0-∞、Cmax、t1/2z、CLz/F和Vz/F差异有统计学意义(P<0.05);AUCss与单次给药时AUC0-t相近;AUC和Cmax的蓄积因子RAUC和RCmax分别为(1.43±0.16)和(1.28±0.29),与文献报道相近[1-2],结果见表3。
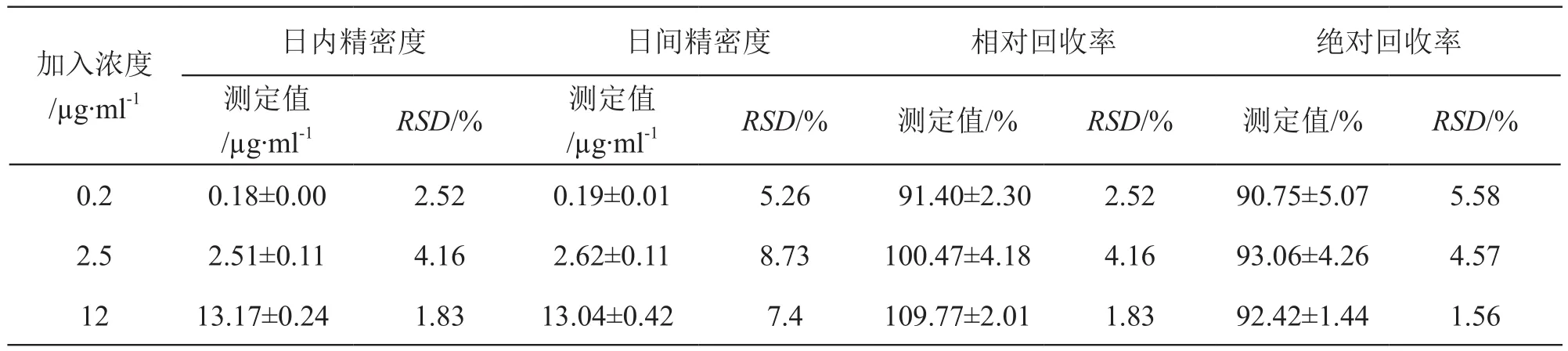
表1 莫达非尼精密度及回收率考察(n=5)
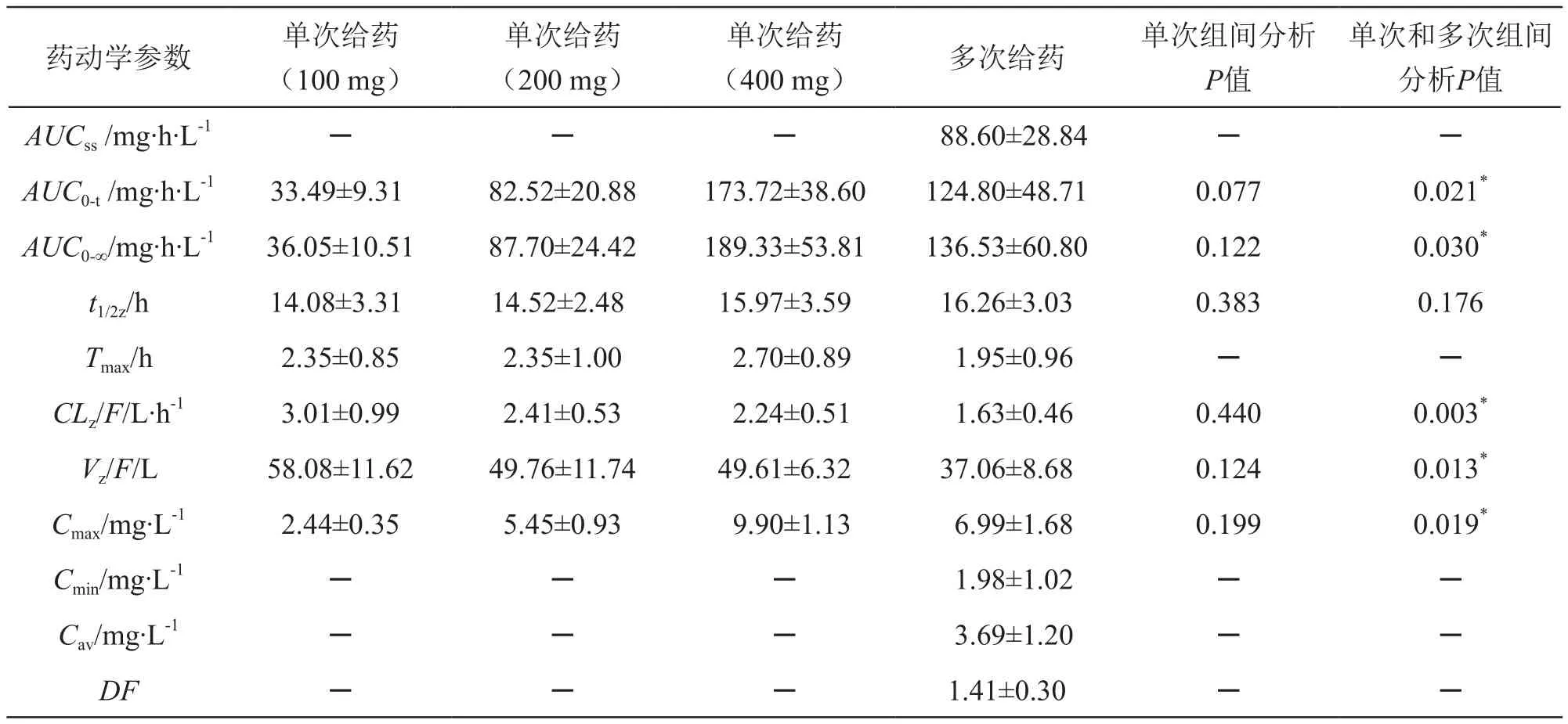
表2 单次和多次口服莫达非尼片后的药动学参数和统计分析结果(n=10)
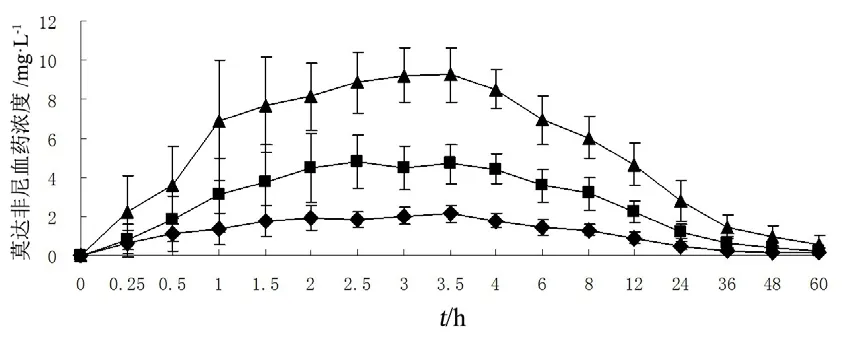
图2 单次口服莫达非尼片血药浓度-时间曲线
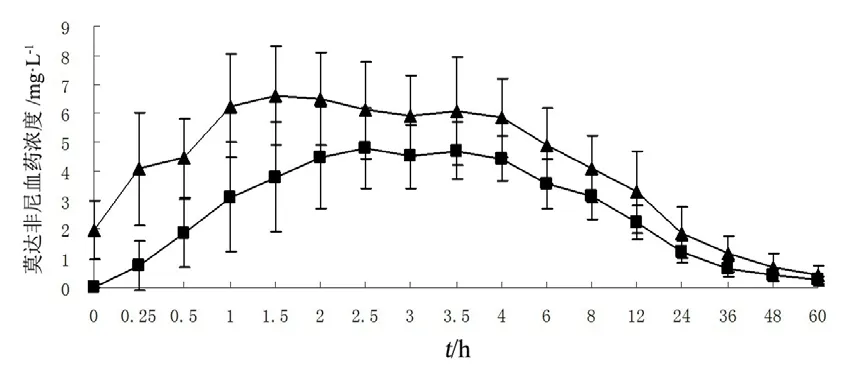
图3 单次和多次组第7天口服莫达非尼片血药浓度-时间曲线
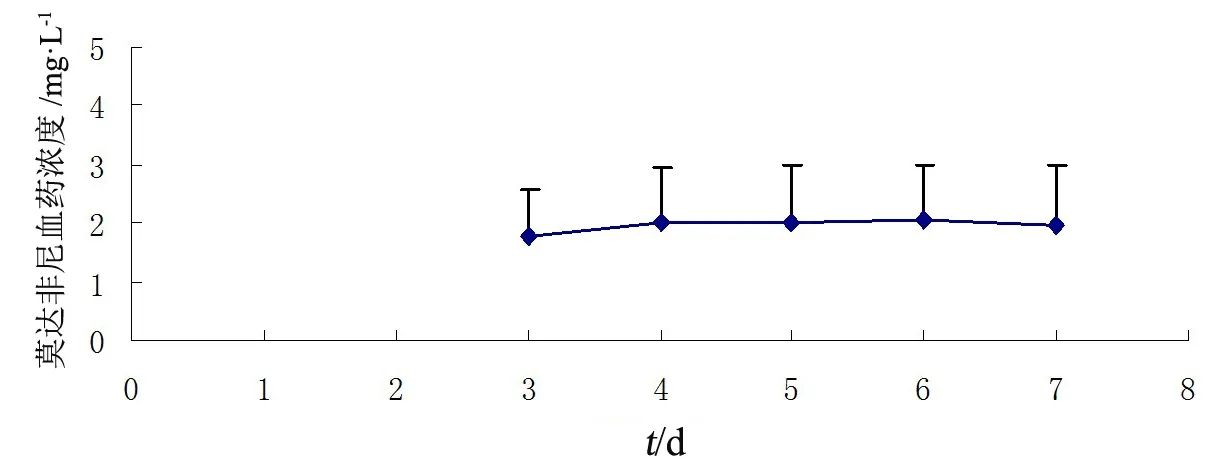
图4 多次口服莫达非尼片稳态血药浓度-时间曲线
2.5 临床观察
受试者在试验进行过程中,由研究人员及临床医师实施医疗监护,观察试验期间可能出现的不良事件,并做出详细记录和采取有效措施及时处理。本次试验中30名受试者发生不良反应少且轻微(4/30),单次给药受试者中有两例轻微红疹发生,持续时间未超过8 h;多剂量组出现轻微胃部不适和轻微胸闷各一例,持续时间均未超过2 h。发生不良反应受试者均未用药自行好转。试验过程中监测受试者生命体征平稳,试验结束后入组受试者进行全面体检,结果表明各项生化指标无异常,表明莫达非尼具有良好的耐受性和安全性[10-11]。
3 结论
莫达非尼片在中国健康男性体内呈线性药动学特征,其血浆有效半衰期较长;采用多次给药方案,可尽快获得稳态血药浓度。在100~400 mg剂量范围内,口服莫达非尼片的不良反应较少且轻微,表明莫达非尼在中国健康人体中耐受性良好。
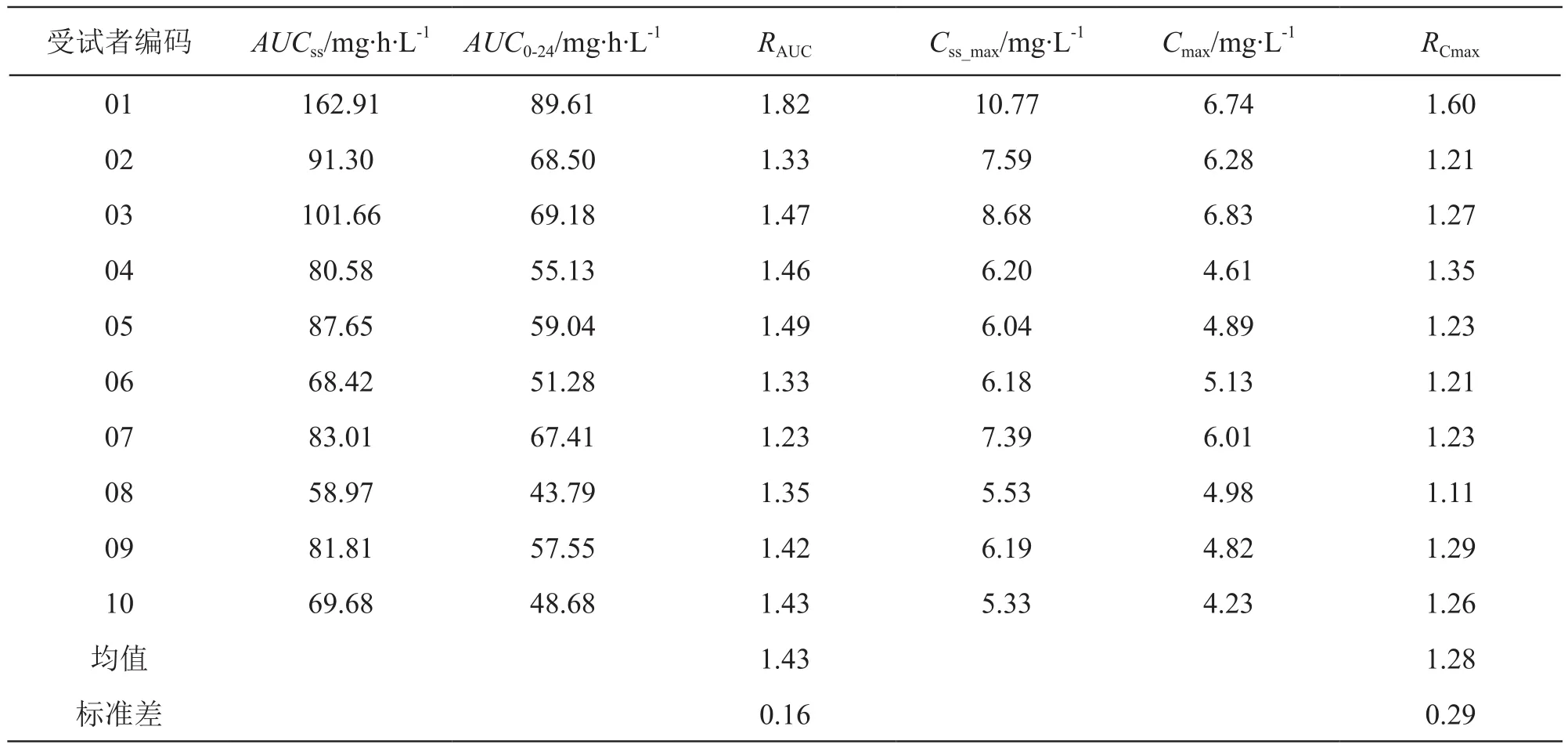
表3 单次和多次口服莫达非尼片后蓄积因子(R)比较

