原发性肝癌射频消融术后复发预测模型的建立及评价
陈智炜 吴飞翔 陈洁 王小波 唐置鸿 孟维达 韦猛 张连达 麦荣云 韦滔 苏衡蜂 黎乐群 白涛
作者单位:530021南宁 广西医科大学附属肿瘤医院肝胆外科;广西肝癌诊疗工程术研究中心;区域性高发肿瘤早期防治研究教育部重点实验室
早期原发性肝癌(primary liver cancer,PLC)患者可通过手术、射频消融(radiofrequency ablation,RFA)、肝移植等获得根治,其中肝癌根治性术被认为是最有效的治疗方式[1-2]。但手术切除术后并发症风险较大,而经皮射频消融可局部灭活肿瘤,尤其适合小肝癌或肝功能受损的患者,且具有微创、简易、术后并发症少等优势[3]。然而目前研究发现不管何种治疗方式,肝癌治疗后的5年复发率高达68%~96%[4]。列线图是一种可用于预测发病、复发及预后的实用工具,已广泛应用于多种疾病的临床应用中,具有简便、直观等优势[5]。本研究收集射频消融术前患者的影像学检查及实验室检查资料,分析射频消融术复发的相关因素,并基于复发因素构建预测PLC患者射频消融术后无瘤生存率的列线图模型,以帮助临床医师更好地作出决策,改善患者的预后。
1 资料与方法
1.1 一般资料
回顾性分析2009年6月至2017年5月于广西医科大学附属肿瘤医院接受射频消融治疗的213例PLC患者的资料,并随机将62%的患者纳入训练组(133例),32%的患者纳入验证组(80例)。纳入标准:⑴根据原发性肝癌诊疗规范(2017版)诊断为PLC[1];⑵单发肿瘤,直径≤5 cm;多发肿瘤数目≤3个,且直径≤3 cm[6];⑶无肝外转移;⑷肝功能Child-Pugh评分A~B级[1];⑸术前未接受任何针对肝癌的治疗;⑹无脏器功能不全、无感染等。排除标准:⑴患血友病、白血病、紫癜性疾病等严重的血液系统疾病[7];⑵哺乳期或妊娠期妇女。本研究通过广西医科大学附属肿瘤医院伦理委员会批准,符合医学伦理学规定。
1.2 治疗方法
术前完善相关检查:血常规、肝肾功能、凝血功能、乙型肝炎病毒DNA、感染性综合疾病指标、肿瘤标志物、心电图、CT或MRI、B超。行超声定位(日立二郎神彩超HI VISION Avius),明确肿瘤大小、数目、位置,并预估穿刺点。采用局部麻醉或静脉复合麻醉,经皮超声引导下穿刺,RFA采用美国Valleylab公司生产的冷循环(Cool-tip)公司冷循环(Cool-tip System)系统,单束ACT2020、ACT2030射频针。输出功率为60~200 W,消融范围为2~5 cm,每次消融时间12 min[7]。针对不同大小肿瘤可实施多次重叠消融。治疗结束后,采用B超造影,保证消融范围覆盖整个肿瘤,并且消融范围距肿瘤边缘为0.5~1.0 cm。退针时行针道消融,降低种植转移风险。
1.3 资料收集及随访
以完成射频消融治疗为随访起点,通过电话、门诊随访。所有患者术后1个月复查血常规、肝功能、肾功能、凝血功能、肿瘤标志物,并行超声造影、增强CT或MRI检查,然后每隔2~3个月复查1次,检测患者术后甲胎蛋白(alphafeto protein,AFP)水平、消融区域变化及复发、进展、并发症发生情况。随访截至2019年5月31日。以患者复发为终点(124例),截尾包括失访、死亡或未复发(89例)。完全消融:肿瘤消融区域无活性,且消融边缘充分超出肿瘤边缘0.5~1.0 cm,且术后AFP为阴性;部分消融:肿瘤消融区域周围仍存有活性肿瘤。局部进展:原完全消融区域在之后任何一次影像学随访中出现活性肿瘤。新发肿瘤:术后任何一次影像学随访提示原消融区以外的肝内出现活性肿瘤[6]。无瘤生存期(disease-free survival,DFS)定义为PLC患者经射频治疗后定期复查直至出现肿瘤复发或转移的时间。
1.4 统计学方法
采用SPSS 21.0软件进行数据分析。分类变量组间比较采用χ2检验;连续变量组间比较采用独立样本t检验;Kaplan-Meier法计算生存率,组间比较采用Log-rank检验;采用单因素及多因素Cox回归模型分析射频消融术后复发的影响因素,多因素变量筛选方法采用Forward:LR法。根据多因素分析结果,采用R 3.6.1(http://www.r-project.org)软件中的rms、survival、survcomp程序包建立预测无瘤生存率的列线图模型。采用C-index评价列线图模型的准确度;校准曲线评价预测符合度;使用列线图将患者分为高风险组和低风险组,Kaplan-Meier法绘制两组生存曲线,并采用Log-rank检验比较差异,用于评估模型的实用性[8]。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
共213例患者符合标准纳入研究,其中训练组133例,验证组80例,两组患者术前实验室检查资料及影像学检查资料差异均无统计学意义(P>0.05)。见表1。
表1 训练组与验证组中患者的临床基线资料[±s/n(%)]Tab.1 Clinical baseline information of patients in the training group and the validation group[±s/n(%)]
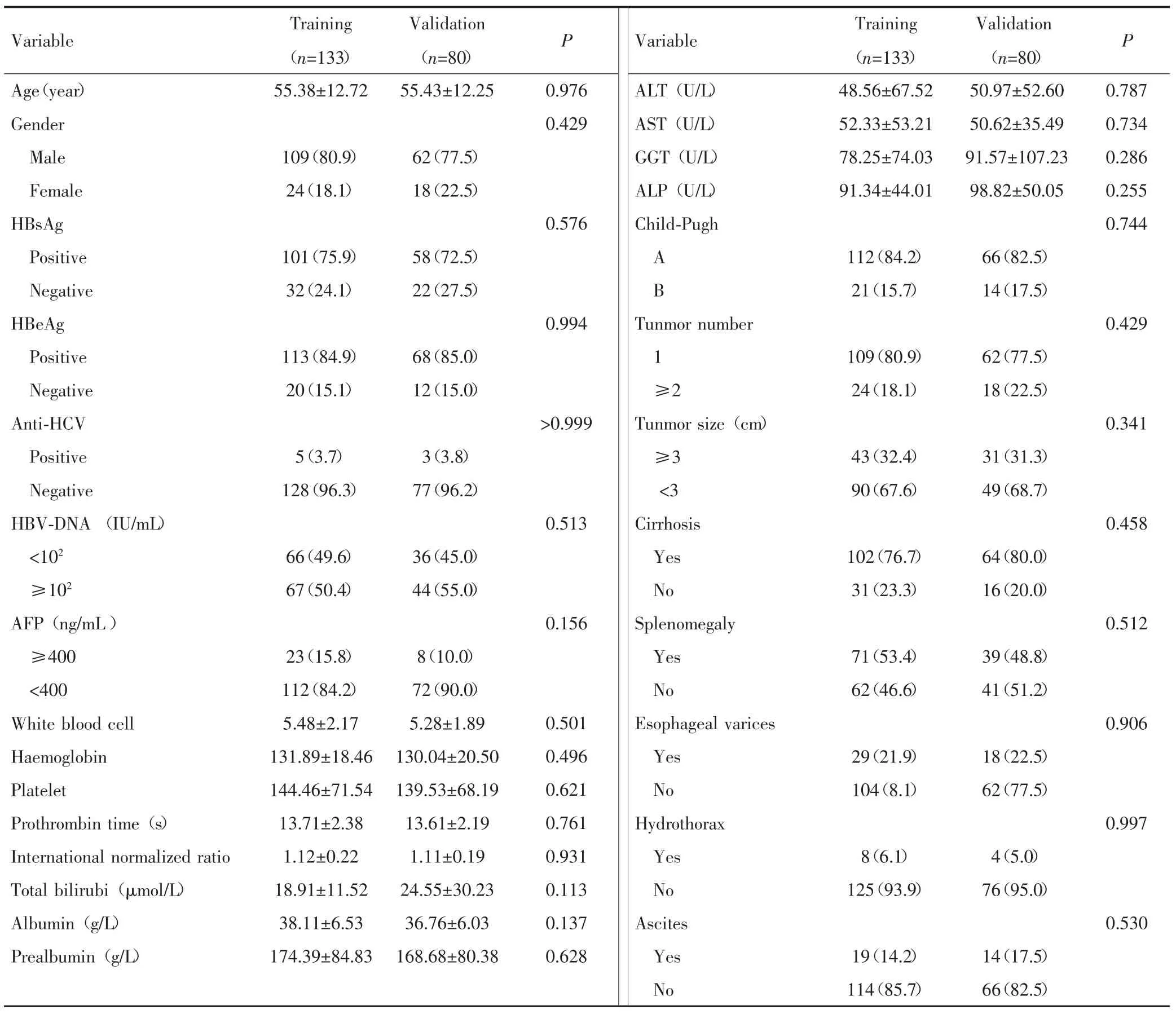
表1 训练组与验证组中患者的临床基线资料[±s/n(%)]Tab.1 Clinical baseline information of patients in the training group and the validation group[±s/n(%)]
HBV:Hepatitis B virus;HCV:Hepatitis C virus;ALT:Alanine aminotransferase;AST:Aspartate aminotransferase;GGT:γ-Glutamyl transpeptidase;ALP:Alkaline phosphatase
Variable Training(n=133)Validation(n=80)P Training(n=133)Validation(n=80) P Age(year) 55.38±12.72 55.43±12.25 48.56±67.52 50.97±52.60 0.787 Gender 52.33±53.21 50.62±35.49 0.734 Male 109(80.9) 62(77.5) 78.25±74.03 91.57±107.23 0.286 Female 24(18.1) 18(22.5) 91.34±44.01 98.82±50.05 0.255 HBsAg 0.744 Positive 101(75.9) 58(72.5) 112(84.2) 66(82.5)Negative 32(24.1) 22(27.5) 21(15.7) 14(17.5)HBeAg 0.429 Positive 113(84.9) 68(85.0) 109(80.9) 62(77.5)Negative 20(15.1) 12(15.0) 24(18.1) 18(22.5)Anti-HCV 0.341 Positive 5(3.7) 3(3.8) 43(32.4) 31(31.3)Negative 128(96.3) 77(96.2) 90(67.6) 49(68.7)HBV-DNA(IU/mL) 0.458<102 66(49.6) 36(45.0) 102(76.7) 64(80.0)≥102 67(50.4) 44(55.0) 31(23.3) 16(20.0)AFP(ng/mL) 0.512≥400 23(15.8) 8(10.0) 71(53.4) 39(48.8)<400 112(84.2) 72(90.0) 62(46.6) 41(51.2)White blood cell 5.48±2.17 5.28±1.89 0.906 Haemoglobin 131.89±18.46 130.04±20.50 29(21.9) 18(22.5)Platelet 144.46±71.54 139.53±68.19 104(8.1) 62(77.5)Prothrombin time(s) 13.71±2.38 13.61±2.19 0.997 International normalized ratio 1.12±0.22 1.11±0.19 8(6.1) 4(5.0)Total bilirubi(μmol/L) 18.91±11.52 24.55±30.23 125(93.9) 76(95.0)Albumin(g/L) 38.11±6.53 36.76±6.03 0.530 Prealbumin(g/L) 174.39±84.83 168.68±80.38 19(14.2) 14(17.5)114(85.7) 66(82.5)0.976 0.429 0.576 Variable ALT(U/L)AST(U/L)GGT(U/L)ALP(U/L)Child-Pugh A B 0.994>0.999 0.513 0.156 0.501 0.496 0.621 0.761 0.931 0.113 0.137 0.628 Tunmor number 1≥2 Tunmor size(cm)≥3<3 Cirrhosis Yes No Splenomegaly Yes No Esophageal varices Yes No Hydrothorax Yes No Ascites Yes No
2.2 训练组和验证组患者的无瘤生存情况
训练组1年、3年、5年无瘤生存率分别为65.25%、40.91%、26.99%,验证组1年、3年、5年无瘤生存率分别为66.29%、48.10%、24.59%,两组生存曲线差异无统计学意义(P=0.785),见图1。
2.3 训练组患者射频消融术后复发的独立相关因素分析
单因素Cox回归模型结果显示,肿瘤数目、丙肝抗体阳性、HBV-DNA、血红蛋白、白蛋白、前白蛋白等与射频消融术后复发相关。多因素Cox回归模型显示,肿瘤数目(HR=1.921,95%CI:1.136~3.251)、丙肝抗体阳性(HR=4.545,95%CI:1.700~12.149)、HBVDNA≥102IU/mL(HR=1.993,95%CI:1.209~3.284)和前白蛋白(HR=0.996,95%CI:0.993~0.999)为影响复发的因素。见表2。
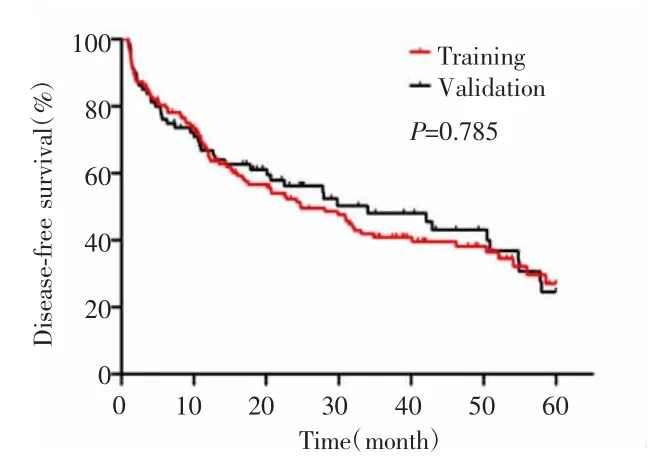
图1 验证组与训练组的Kaplan-Meier生存曲线Fig.1 Kaplan-Meier survival curves of the validation group and the training group
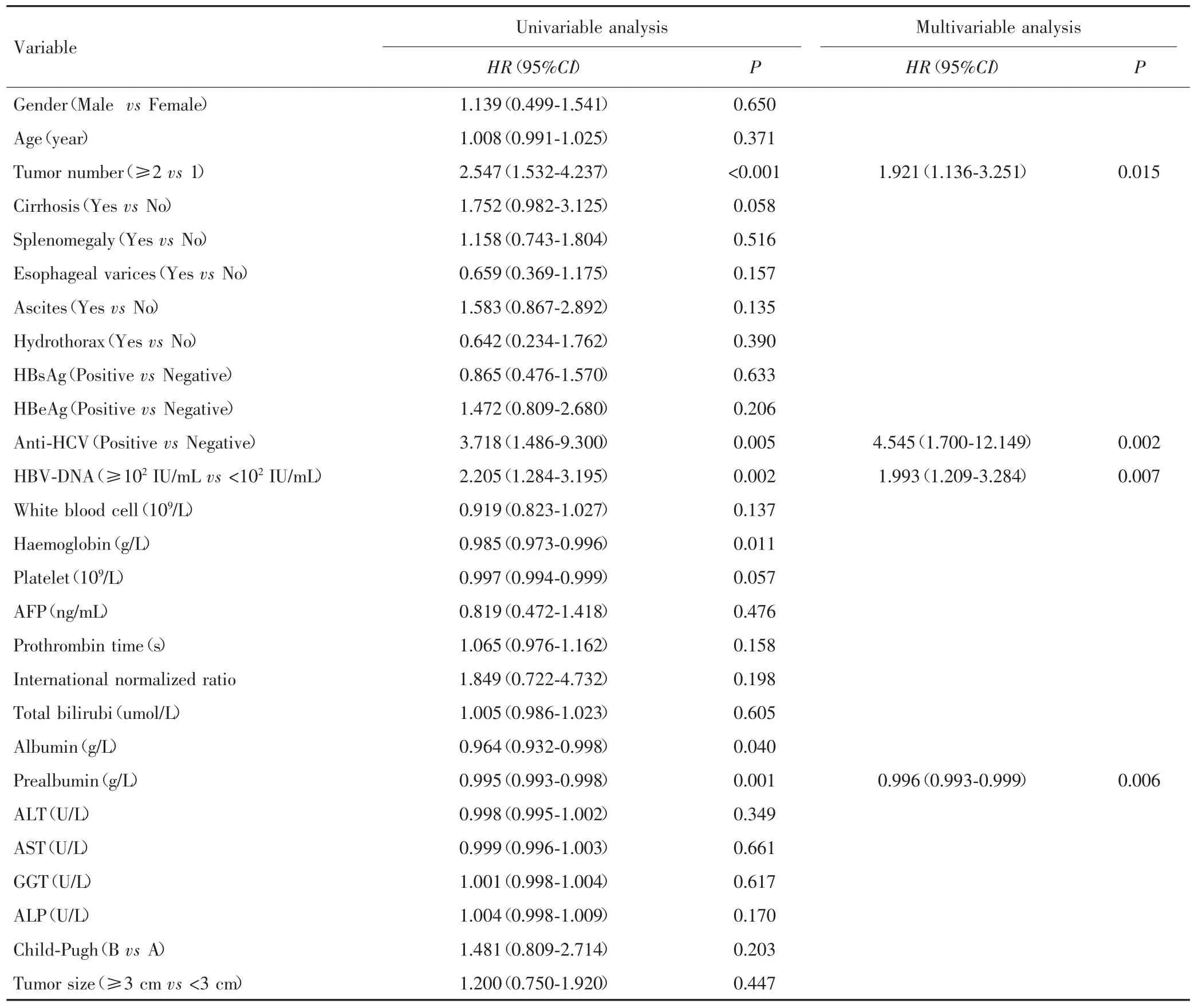
表2 单因素和多因素分析训练组患者射频消融术后复发的影响因素Tab.2 Univariable and multivariable analysis on influence factors of patient recurrence after RFA in the training group
2.4 列线图模型的构建与评价
采用肿瘤数目、HBV-DNA和血清前白蛋白等构建列线图模型(图2),因纳入的丙肝患者例数较少,因此未将该因素纳入列线图建模中。每个指标的数值对应相应得分,各个指标获得的总得分可对应得到1年、3年、5年的无瘤生存率,从而获得对应患者的复发风险。训练组与验证组1年、3年、5年DFS的列线图模型校准曲线均与参考曲线贴近,表示建立的列线图模型具有良好的一致性(图3)。在训练组C-index为0.649(95%CI:0.588~0.710),验证组为0.641(95%CI:0.556~0.724)。根据列线图模型评分将患者分为高风险组(>83分)和低风险组(≤83分),在所有患者及训练组中高风险组的无瘤生存率明显低于低风险组(P<0.001),但在验证组高风险组和低风险组患者瘤生存率差异无统计学意义(P=0.077)。见图4。
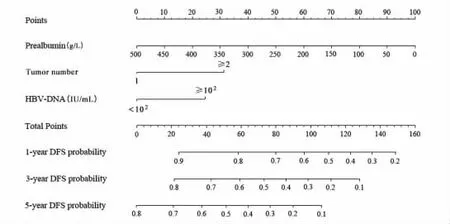
图2 基于训练组构建的预测射频消融术后患者无瘤生存率的列线图模型Fig.2 Nomogram model for predicting DFS of patients after RFA based on the training group
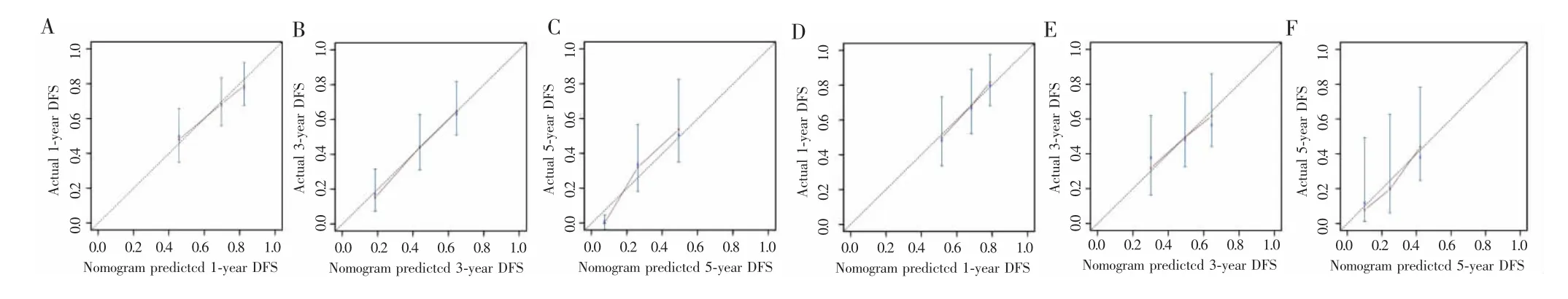
图3 列线图在训练组和验证组中的校准曲线Fig.3 Calibration plots of the nomogram for patients in the training group and the validation group
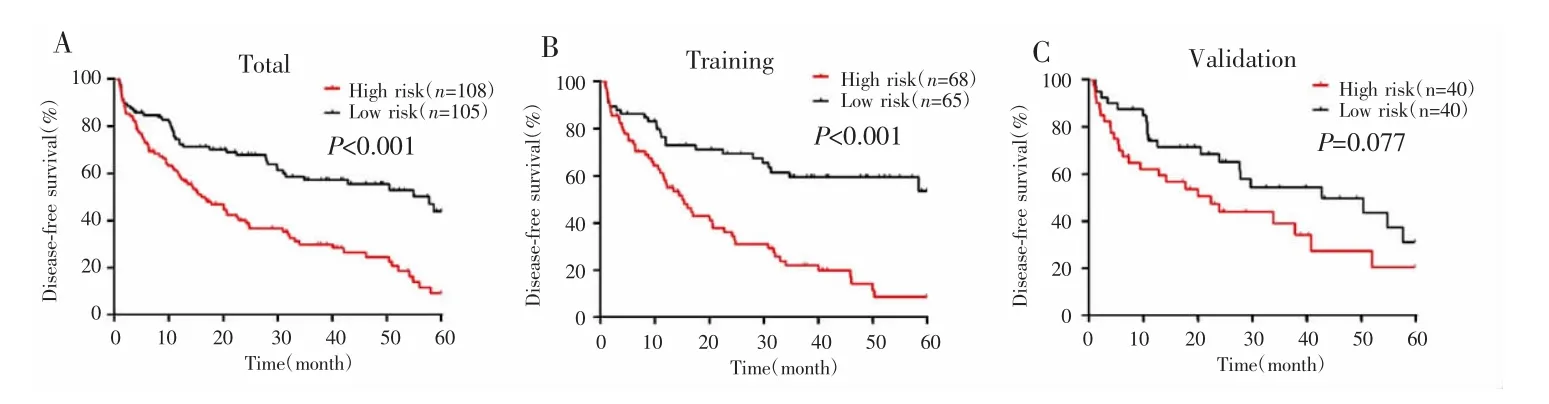
图4 高风险组与低风险组的Kaplan-Meier生存曲线Fig.4 Kaplan-Meier survival curves for the high-risk group and the low-risk group
3 讨论
RFA是肝癌的主要治疗手段之一,具有创伤小、并发症少以及疗效确切等特点。研究显示,我国每年因肝癌死亡的人数占全世界肝癌死亡的45.0%,且肝癌恶性程度高,手术、RFA术后的高复发率成为患者死亡的主要原因[9-10]。IZZO等[11]报道,肿瘤直径≤3 cm肝癌患者RFA术后5年复发率为62%。因此,早期预测RFA术后复发风险,具有重要的意义。
LEE等[12]研究发现肝癌肿瘤数目、白蛋白、凝血功能等与RFA术后患者复发相关。且多项研究表明肝癌复发与患者肿瘤数目、术前营养状态相关。肿瘤数目增多,患者免疫力往往更差,肿瘤细胞侵袭能力更强,机体抑制其生长速度更加困难,导致患者复发风险曾加[13]。既往研究表明患者营养状态与术后并发症密切相关,也是影响术后肿瘤复发的重要因素。血清前白蛋白是完全由肝细胞产生的载体蛋白,当肝细胞受损,其具有极强的特异性和敏感性,可早期反映肝癌患者肝脏合成功能及储备功能。ESPER等[14]报道术前血清前白蛋白含量低是肝癌患者术后总生存期和肿瘤复发的独立危险因素。本研究发现射频消融术前肿瘤数目≥2个及术前血清前白蛋白水平是患者RFA术后复发的独立因素,与既往研究结果相符,说明血清前白蛋白可作为预测患者术后复发的潜在指标。
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)是目前公认的导致PLC发生的主要病因之一[15]。研究证实HBV、HCV等感染易导致肝细胞持续性破坏,进而形成肝硬化,最终导致肝细胞性肝癌发生。BAO等[16]研究发现肝癌切除术后复发、转移与HBV-DNA定量水平密切相关,可能是由于HBV感染导致肝细胞损伤、增殖,在增殖过程中易发生基因突变,且HBVDNA通过复制整合至人肝细胞DNA中,可进一步加重突变及抑癌基因失活,从而导致肝癌患者术后易复发。本研究中亦发现丙肝抗体阳性或HBV-DNA≥102IU/mL患者RFA术后更易复发,多因素分析亦提示HBVDNA≥102IU/mL为影响复发的独立因素,可作为预测RFA术后复发的指标。
列线图可通过临床上常用的指标准确预测某事件发生的概率,可较好地帮助临床医师判断事件的发生。本研究成功建立了射频消融术后复发的临床预测模型,所纳入的独立无瘤复发率的相关因素包括肿瘤数目、HBV-DNA以及血清前白蛋白水平,所纳入的预测因素均可通过临床常规检查获得。所构建列线图的训练组和验证组C-index分别为0.649(95%CI:0.588~0.710)、0.641(95%CI:0.556~0.724),表明具有一定的准确度;校准图形中标准曲线与预测校准曲线贴合良好,表明模型具有较高的符合度。利用建立的列线图对射频消融术后的患者进行评分,发现当评分>83分时,患者复发率增高,该评分可将高/低风险复发患者进行区分,有助于更好地指导患者辅助治疗,具有一定临床实用性。
本研究基于肿瘤数目、HBV-DNA以及血清前白蛋白水平等因素成功建立了可预测PLC患者射频消融术后复发概率的列线图模型,可帮助临床医师对患者进行区分,对指导患者辅助治疗具有一定价值。本研究仍存在以下局限性:⑴本研究为单中心回顾性研究,且样本量较少,可能存在选择偏倚。⑵未分析抗病毒治疗史与复发的关系。⑶该预测模型准确度稍低,验证组高风险及低风险组的生存曲线提示无统计学差异,但跟总体及训练组生存趋势相当,这一差异可能是由验证组样本量少造成。因此,有待开展前瞻性、多中心、大样本研究验证本研究结论。

