MKP-1增强组蛋白去乙酰化酶抑制剂对脑胶质瘤干细胞敏感性及其作用机制
孟亮罗才奎戴小琴陶亮刘山王跃飞
作者单位:430071武汉 武汉市第三医院/武汉大学附属同仁医院1神经外科,2120救治中心,3胸外科
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,3年生存率仅为5%[1]。脑胶质瘤干细胞(glioma stem cells,GSC)具有自我更新能力,是导致肿瘤复发、耐药及治疗失败的关键因素[2-3]。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)是在细胞增殖、分化、凋亡和应激反应中参与细胞内信号传导的蛋白激酶。MAPK激活可介导GSC自我更新、肿瘤启动和放射抗性形成,是脑胶质瘤进展和治疗抗性形成的重要步骤[4]。丝裂原活化蛋白激酶磷酸酶(mitogen-activated protein kinase phosphatase,MAP)受MAPK磷酸酶(MAPK phosphatases,MKPs)家族调控,能使保守基序中的苏氨酸和酪氨酸残基去磷酸化,从而抑制其活性。MKP-1是MKPs家族中功效最高,研究最深入的MAPKs磷酸酶。研究发现MKP-1在卵巢癌、肺癌及乳腺癌等发生发展和化疗耐药中起重要作用[5-6]。然而,MKP-1在肿瘤干细胞及脑胶质瘤中的作用未知。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors,HDACi)是一类新的抗肿瘤药物,能促进未分化的癌细胞分化成熟。HDACi在GSC和肿瘤组织中均可发挥抗肿瘤作用,但HDACi的抗肿瘤机制尚未明了,且在不同肿瘤细胞中的抗癌机制不完全相同[7-8]。本研究探讨MKP-1对HDACi杀伤脑胶质瘤干细胞的影响及可能的作用机制。
1 材料与方法
1.1 研究对象
收集武汉市第三医院神经外科2016年1月至2018年12月收治的53例脑胶质瘤患者的恶性胶质瘤组织及相应健康脑组织。纳入标准:⑴经组织学或细胞学检查确诊为世界卫生组织定义的Ⅳ期胶质瘤患者;⑵未接受放疗、化疗。排除合并精神性疾病,合并心、肺等其他主要脏器功能障碍,自身免疫疾病,以及严重营养不良患者。其中男性35例,女性18例,年龄41~69岁,平均年龄(57.3±11.3)岁。本研究经本院伦理委员会批准,患者及其家属知情同意。
1.2 主要试剂和仪器
DMEMF12培养基、胎牛血清、青霉素/链霉素购自美国Hyclone公司,人重组表皮生长因子、人重组碱性成纤维细胞生长因子、人白血病抑制因子购自美国Chemicon公司;B27购自美国Life Technologies公司;TRIzol试剂、RT-PCR试剂盒和逆转录试剂购自日本Takara公司;MKP-1及内参GAPDH引物设计和合成均由上海吉玛科技生物有限公司完成;MTT、CCK-8、BCA试剂盒均购自日本Takara公司,CD133/2-PE购自美国Miltenyi Biotech公司;抗Sry相关HMG-box基因家族B亚型(Sry-related HMG box2,SOX2)、抗-SOX9、p38、JNK、ERK1/2抗体及内参GAPDH购自美国Santa公司;酶标仪、分光光度计和PCR仪购自美国Bio-Rad公司。
1.3 脑胶质瘤干细胞的分离和培养
根据参考文献[9]对脑胶质瘤组织进行机械破碎,获得恶性胶质瘤细胞,以2%的胎牛血清在培养基中预培养1周,然后在含10%胎牛血清和抗生素的正常培养基中培养。通过形态学观察和抗-GFAP单克隆抗体染色确定其胶质源性。将恶性胶质瘤细胞分散成单个并用含0.5%牛血清白蛋白和2 mmol/L乙二胺四乙酸的磷酸盐缓冲溶液重悬,以微磁珠进行磁性标记,然后以磁细胞分离柱分离阳性磁细胞,CD133/2-PE染色后进行流式分析确认。筛选出的CD133+细胞即为GSC,以含有浓度均为20μg/L的人重组表皮生长因子、人重组碱性成纤维细胞生长因子、人白血病抑制因子和2% B27的DMEMF12培养基培养,维持原发性肿瘤分子特征。
1.4 构建MKP-1过表达脑胶质瘤干细胞模型
转染前1 d,将胶质瘤干细胞用不含抗生素的培养基以1.0×105/孔的密度铺板。细胞用含浓度均为20μg/L的人重组表皮生长因子、人重组碱性成纤维细胞生长因子、人白血病抑制因子和2% B27的DMEMF12培养基培养,当细胞汇合度达70%~90%时,按Lipofectamine 2000转染试剂盒说明书进行转染,实验分为3组:MKP-1组转染MKP-1过表达质粒,对照组转染空载质粒,空白组仅加入等体积的含转染试剂的培养液。各组转染6 h后更换正常培养基,继续培养24 h后验证转染效率,转染后48 h进行RT-PCR检测,转染后72 h进行Western blot实验。
1.5 MTT实验检测HDACi MS-275半数抑制浓度
取对数生长期的MKP-1组、对照组、空白组脑胶质瘤干细胞,以5 000/孔的密度接种于96孔板,每组6个复孔,同时设无细胞的空白对照组,以梯度浓度的HDACi MS-275处理,药物终浓度依次为1.0 nmol/mL、2.0 nmol/mL、5.0 nmol/mL、10.0 nmol/mL、20.0 nmol/mL、40.0 nmol/mL、80.0 nmol/mL、160.0 nmol/mL。48 h后,每孔加入5μg/mL MTT溶液20μL,孵育4 h后弃上清液,加入DMSO 200μL/孔,振荡10 min,酶标仪读取吸光度A490值,计算HDACi MS-275的IC50值。实验重复3次。
1.6 CCK-8实验检测细胞增殖能力
取对数生长期的MKP-1组、对照组、空白组脑胶质瘤干细胞,制成细胞悬液并计数,以4 000/孔的密度接种于96孔板。将培养板置于37℃、5% CO2培养箱培养24 h。24 h后每孔加入CCK-8溶液10μL,继续孵育1~4 h。采用酶标仪检测各孔450 nm波长处的吸光度(A)值。根据吸光度值计算3组细胞增殖能力,实验重复3次。在检测HDACi对细胞增殖影响的实验中分为HDACi组和对照组,HDACi组中各孔加入含1/2 IC50HDACi MS-275培养液100μL,对照组加入等体积培养液,其余步骤同上。
1.7 RT-PCR检测MKP-1、SOX2及SOX9 mRNA的表达情况
用Trizol法提取待测细胞总RNA后逆转录为cDNA,进行RT-PCR。PCR体系(20μL):待测cDNA 2μL,上游引物、下游引物各0.8μL,ROX 0.4μL,TB Green Premix Ex TaqⅡ10μL,ddH2O 6μL;反应条件:95℃30 s,95℃5 s、60℃34 s 40个循环。以ABI 7500实时定量PCR系统进行实验,引物序列见表1。收集荧光信号,并建立PCR产物的熔解曲线,以2-△△Ct法分析,进行半定量比较。以GAPDH为内参。实验重复3次。
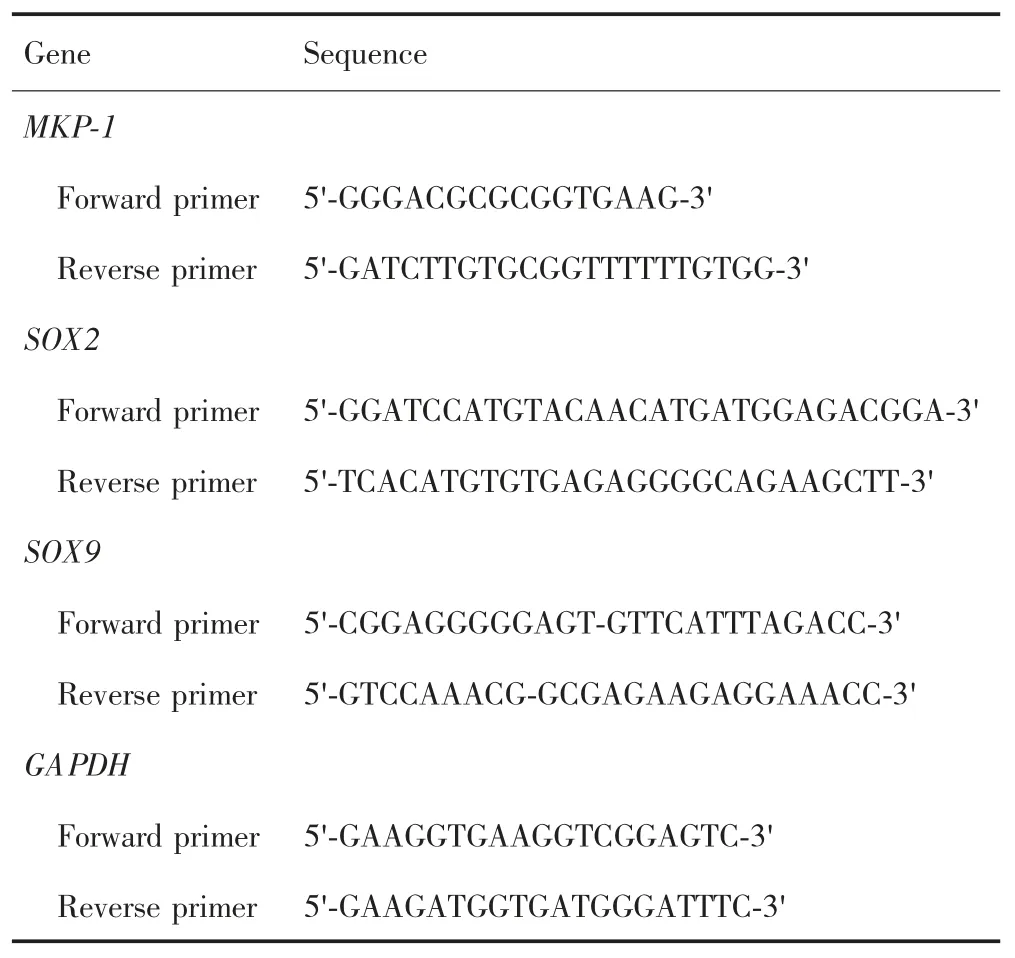
表1 PCR引物序列Tab.1 PCR primer sequence
1.8 Western blot实验检测SOX2、SOX9、p38、JNK及ERK1/2蛋白表达情况
提取各组细胞总蛋白,以BCA试剂盒测定蛋白浓度。将各组蛋白与Loading buffer充分混合后于100℃煮沸5 min变性,每孔50μL并加入SDS-PAGE凝胶上样孔进行电泳和转膜,5%脱脂奶粉封闭。加入按使用说明稀释后的待测一抗(目的蛋白SOX2、SOX9、p38、JNK,稀释比例均为1∶1 000,ERK1/2稀释比例为1∶2 000),4℃孵育过夜。TBST清洗后加入辣根过氧化物酶标记的羊抗鼠IgG(稀释比例1∶5 000)。37℃孵育1 h,TBST清洗后以ECL发光液显影,采用自动凝胶成像系统采集图像,以GAPDH为内参,分析各蛋白表达水平。
1.9 统计学方法
采用SPSS 20.0统计软件分析数据。计量资料用均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,若组间差异有统计学意义,进一步的两两比较采用Bonferroni检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 MKP-1在脑胶质瘤组织和健康脑组织中的表达
RT-PCR实验显示,脑胶质瘤组织中MKP-1的表达水平较对照健康脑组织明显降低,差异有统计学意义(0.31±0.06 vs 1.00±0.10,P<0.001),见图1。
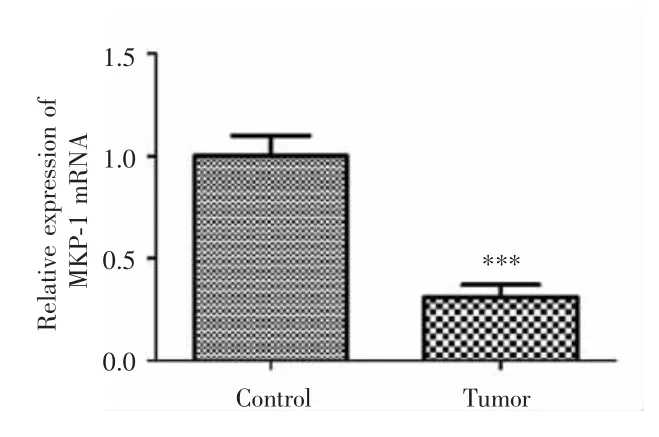
图1 MKP-1在脑胶质瘤组织及健康脑组织中的表达Fig.1 Expression of MKP-1 in glioma tissues and healthy brain tissues
2.2 过表达MKP-1脑胶质瘤干细胞构建及对细胞增殖能力的影响
以MKP-1过表达质粒转染脑胶质瘤干细胞后,RT-PCR实验结果显示,MKP-1组中MKP-1表达较对照组和空白组明显升高(2.46±0.43 vs 0.99±0.10 &1.01±0.10,P<0.001),对照组和空白组MKP-1表达量差异无统计学意义(0.99±0.10 vs 1.01±0.10,P=0.990),见图2A。CCK-8实验结果显示,MKP-1组胶质瘤干细胞增殖能力较对照组和空白组明显降低,差异有统计学意义(0.64±0.06 vs 1.01±0.10 & 0.99±0.11,P<0.001),见图2B。

图2 转染后脑胶质瘤干细胞中MKP-1的表达及细胞增殖能力Fig.2 Expression of MKP-1 in GSC and cell proliferation ability after transfection
2.3 MKP-1对HDACi作用脑胶质瘤干细胞的影响
MTT实验结果显示,HDACi MS-275处理脑胶质瘤干细胞的IC50为(55.12±7.31)nmol/mL。HDACi处理后,CCK-8实验显示,HDACi组脑胶质瘤干细胞的增殖能力较对照组明显降低(0.63±0.05 vs 1.01±0.10,P<0.001),见图3A。RT-PCR结果显示,HDACi组MKP-1表达较对照组明显增加(2.01±0.23 vs 0.99±0.08,P<0.001),见图3B。HDACi MS-275处理过表达MKP-1胶质瘤干细胞的IC50明显较空白组和对照组降低[(33.12±6.12)nmol/mL vs 53.13±5.36)nmol/mL &(55.12±7.31)nmol/mL,P<0.001],见图3C。
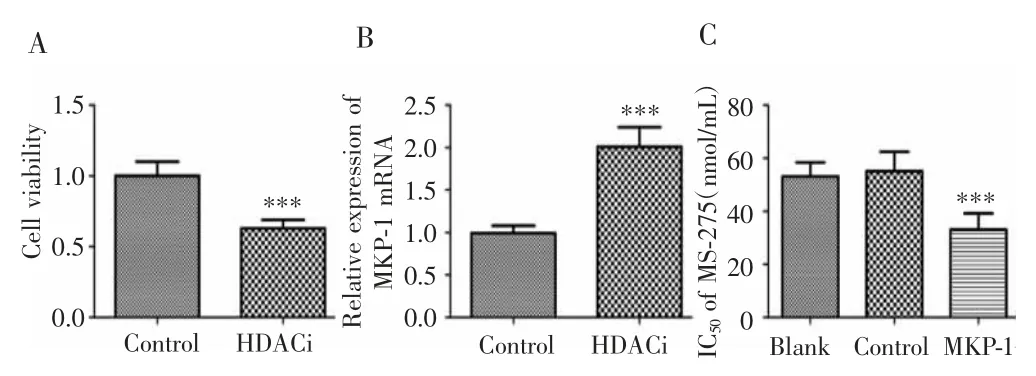
图3 MKP-1对HDACi作用脑胶质瘤干细胞的影响Fig.3 Effect of MKP-1 on glioma stem cells treated by HDACi
2.4 MKP-1过表达对SOX2和SOX9表达的影响
RT-PCR及Western blot实验结果显示,MKP-1组脑胶质瘤干细胞中干细胞相关因子SOX2、SOX9 mRNA和蛋白表达较对照组和空白组明显降低(0.61±0.05 vs 1.01±0.11 & 0.99±0.09,P<0.05;0.53±0.09 vs 0.98±0.09 &1.01±0.11,P<0.005),见图4。
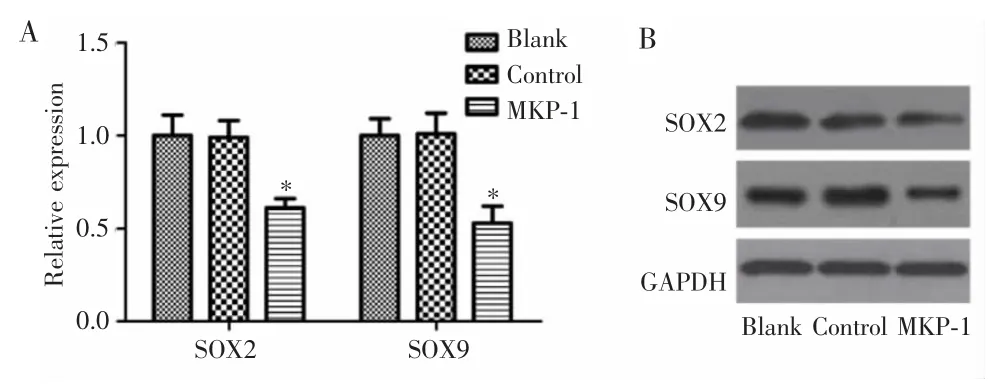
图4 MKP-1过表达对脑胶质瘤干细胞中SOX2和SOX9表达的影响Fig.4 Effect of MKP-1 overexpression on SOX2 and SOX9 in glioma stem cells
2.5 MKP-1过表达对p38、JNK和ERK1/2表达的影响
Western blot实验结果显示,MKP-1组脑胶质瘤干细胞中JNK和p38的表达较对照组和空白组明显降低(P<0.001),而ERK1/2在3组中的表达差异无统计学意义(P>0.05),见图5。
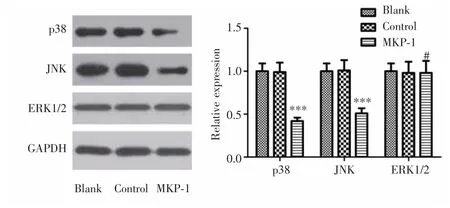
图5 MKP-1过表达对脑胶质瘤干细胞中p38、JNK和ERK1/2表达的影响Fig.5 Effect of MKP-1 overexpression on p38,JNK and ERK1/2 in glioma stem cells
3 讨论
MKP-1在各种肿瘤细胞中普遍表达,其转录随着生长因子、氧化应激、细胞因子、缺氧以及DNA损伤而迅速增加[10]。目前研究认为MKP-1与肿瘤发生有关,但在各类肿瘤中的作用不一。有研究报道MKP-1过表达可促进前列腺癌、胰腺癌、结肠癌、膀胱癌、胃癌、乳腺癌和肺癌发生[11-14]。MKP-1通过诱导上皮间充质转换和蛋白酶C途径可促进乳腺癌进展,还可调控ERK活性而影响肝细胞癌进展[15]。其中在肝细胞癌和头颈部肿瘤的发生中MKP-1主要发挥抑制作用[16]。本研究亦发现脑胶质瘤组织中MKP-1表达明显较健康脑组织降低,说明MKP-1与胶质瘤发生有关。
HDACi是一组表观遗传分子,其中Bellinostat已获FDA批准用于治疗皮肤T细胞淋巴瘤。HDACi在胶质瘤,特别是胶质母细胞瘤的临床前和临床试验中展现出良好的应用前景[17-18]。本研究采用HDACi MS-275作用胶质瘤干细胞后其增殖能力明显降低,且MKP-1表达明显上调,在构建的MKP-1过表达胶质瘤干细胞中发现HDACi的杀伤效果在MKP-1过表达的胶质瘤干细胞中更明显。GIL-ARAUJO等[15]采用HDACi SAHA处理脑胶质瘤细胞时,亦发现MKP-1表达升高2~15倍。提示MKP-1有望成为监测脑胶质瘤对HDACi敏感性的生物标志物。
MKP-1具有核定位,其主要底物是氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38和细胞外信号调节激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2),但对这些底物的偏好取决于组织或特定细胞类型[5-6]。MKP-1可使p38和JNK通路激酶去磷酸化而失活。本研究发现MKP-1在GSC中过表达可降低其增殖能力,抑制肿瘤干细胞相关因子SOX2、SOX9的表达,从而导致GSC的自我更新能力降低,这可能是MKP-1过表达抑制胶质瘤发生和发展的机制之一。MKP-1的活性与GSC维持呈负相关,MKP-1可能调节GSC增殖、自我更新和分化之间的相互作用,除SOX因子外,这些活动极可能由JNK激酶介导。本研究进一步检测过表达MKP-1 GSC中p38和JNK的表达情况,发现高水平的MKP-1可下调p38和JNK表达。JNK活性增加是GSC诱导肿瘤启动的动力,同样JNK途径的激活可使GSC维持在未成熟阶段并促进放射治疗抗性[19-21]。因此HDACi的杀伤效果在MKP-1过表达的GSC中更明显可能通过下调p38和JNK表达实现。
本研究发现,HDACi MS-275对GSC细胞亚群具有确切的杀伤效果,MKP-1过表达时HDACi杀伤作用更明显,这可能通过降低干细胞标志物SOX2、SOX9表达,减少GSC的自我更新实现。此外,MKP-1还可降低GSC中p38和JNK的活化,这可能是其抑制GSC维持和诱导肿瘤启动能力的机制之一。后续将进一步通过动物实验分析HDACi及MKP-1表达对GSC成瘤能力的影响,探索HDACi杀伤脑胶质瘤干细胞的分子机制及MKP-1在其中的作用。

