胃癌肺转移治疗的研究进展
欧海玲吴留成覃海泉黄名威覃宇周
作者单位:530023南宁 1广西中医药大学第一附属医院病理科;530021南宁 2广西医科大学附属肿瘤医院胃肠外科
胃癌在我国的发病率和死亡率分别位于恶性肿瘤第4位和第2位[1]。手术是胃癌的主要治疗手段,但术后2年内易复发及远处转移。其中肺是胃癌根治术后远处转移的高发靶器官,胃癌肺转移发生率为2.27%~3.84%,尤其肿瘤位于上1/3的患者更易发生肺转移[2],且肺转移患者中80.9%为高分化癌[3-5]。胃癌肺转移诊断时通常表现为癌性淋巴管炎或多发肺转移[6-7],但是孤立性肺转移少见,单发肺转移发生率仅为0.3%~6.0%[6]。因胃癌肺转移早期很少侵犯支气管黏膜,临床表现不明显,与原发性肺癌亦不同,咯血或痰中带血的发生率较低,痰液癌细胞检查常表现为阴性,因此不易早期诊断。胃癌肺转移大多为随访期间通过CT、PET-CT等影像学检查发现,但是有时亦难以诊断,需术中冰冻切片甚至术后常规病理检查才得以确诊[8]。研究认为胃癌术后的肺孤立性病灶,若可耐受均应考虑手术切除以明确诊断[9]。胃癌肺转移目前尚缺乏成熟的治疗规范,随着诊治病例的增多,以及化疗、手术、靶向治疗、免疫治疗、消融治疗、放疗等相关治疗手段的提高及多学科合作的深入开展,对胃癌肺转移的认识不断加深,临床研究亦取得较大进展。本文将围绕胃癌肺转移治疗的研究进展作一综述。
1 化疗
化疗是目前胃癌肺转移的标准治疗手段[8],但尚未有标准的化疗方案。以ECF方案(表柔比星+顺铂+5-氟尿嘧啶)及其改良方案、SP方案(替吉奥联合顺铂)、XP(卡培他滨联合顺铂)、FLOT(多西他赛+奥沙利铂+亚叶酸钙+氟尿嘧啶)作为转移性胃癌的一线化疗方案已被广泛接受。EOF方案(表柔比星+奥沙利铂+氟尿嘧啶)主要应用于包括肝、肺、腹膜等部位转移的胃癌患者,疾病进展期(TTP)和总生存期(OS)分别为6.0个月和12.6个月,但肺转移患者有效率仅为23.1%[10]。一项以紫杉醇、5-氟尿嘧啶、顺铂为方案治疗Ⅳ期胃癌的研究显示,良好反应率为64.4%,完全切除率为56.4%,无手术相关死亡,中位生存为26个月[11]。那么化疗+手术是否获益?一项包括胃癌肺转移、肝转移、腹膜转移患者行转移瘤切除或细胞减灭术+化疗对比单纯化疗的研究表明,前者可带来生存获益[12]。来自韩国的回顾性研究亦证实,胃癌肺转移瘤切除+化疗的OS为18个月,明显优于单纯化疗者[13]。目前胃癌肺转移化疗有效率较低,是否可通过筛选化疗可能的获益人群而提高疗效?FLOT4-AIO研究发现,原发灶lauren分型为肠型的患者对FLOT方案更敏感[14]。高频微卫星不稳定(high-frequency microsatellite instability,MSI-H)患者单纯手术预后优于术前化疗者,因此微卫星不稳定性(microsatellite instability,MSI)检测有可能作为术前化疗的筛选指标[15]。当然,今后仍需开发更多敏感、高效的指标,以实现精准治疗,让患者受益。
2 靶向药物治疗
目前用于胃癌研究的靶向药物主要以HER2、VEGF、EGFR、c-MET、PI3K、AKT/mTOR通路为靶点,但针对EGFR、c-MET、PI3K、AKT/mTOR通路的靶向药物如西妥昔单抗、Rilotumumab、依维莫司、Panitumumab等在进展期胃癌治疗中生存获益不大,仅针对HER2和VEGF的靶向药物可使患者获益。
在HER2的靶向药物研究中,里程碑式的ToGA研究显示曲妥珠单抗联合化疗治疗进展期胃癌(约97%为转移性胃癌,包括肺转移患者)的反应率、中位无进展生存期(PFS)和OS均优于单纯化疗[11]。进一步研究证明不管一线联合mFOLFOX6、FOLFIRI还是二线联合含紫杉醇的方案均可以带来生存获益[12-13,16]。然而,同样是靶向HER2的帕妥珠单抗在JACOB研究中并未带来生存优势。因此,对于HER2阳性转移性胃癌患者,应进一步识别和分类,以筛选出能从抗HER2靶向治疗中获益的患者[17]。
目前针对VEGF及其受体的药物相关研究较多,其中贝伐珠单抗、恩度、瑞戈非尼能延长PFS,但OS无显著差异[18-20];阿帕替尼可提高中位OS和中位无疾病生存期(DFS)[21],雷莫芦单抗可提高中位OS[22-23],其中雷莫芦单抗及阿帕替尼已入选NCCN治疗指南。VEGF靶向治疗进展期胃癌的主要临床研究汇总见表1。
在以HER2和VEGF为共同靶点的药物研究中,TYAN研究评估了作用于HER2、VEGF的酪氨酸激酶抑制剂——拉帕替尼联合紫杉醇对比紫杉醇单药治疗亚洲国家HER2(+)晚期胃癌患者的治疗效果,结果显示,拉帕替尼联合紫杉醇组有效率为42%,中位OS、PFS分别为9.7个月和7.2个月,均高于紫杉醇组的8%、7.6个月和4.7个月,拉帕替尼在晚期或转移性胃癌患者单药治疗中显示出良好疗效,且耐受性良好[24]。
3 免疫治疗
目前针对转移性胃癌免疫检查点药物的两项研究结果不一致。ATTRACTION-2试验中,纳武单抗组的中位OS为5.26个月,12个月生存率为26.2%,与安慰剂组比较差异有统计学意义,显示其在转移性胃癌治疗中的生存优势[25]。而在KEYNOTE-061研究中,派姆单抗用于PD-L1阳性(联合阳性评分≥1)既往治疗后复发的局部晚期或转移性胃癌或胃食管结合部腺癌患者的三线治疗,与紫杉醇二线治疗比较未显示出生存优势,但具有较好的安全性[26]。由此认为,免疫治疗在转移性胃癌的治疗作用尚有待进一步验证。
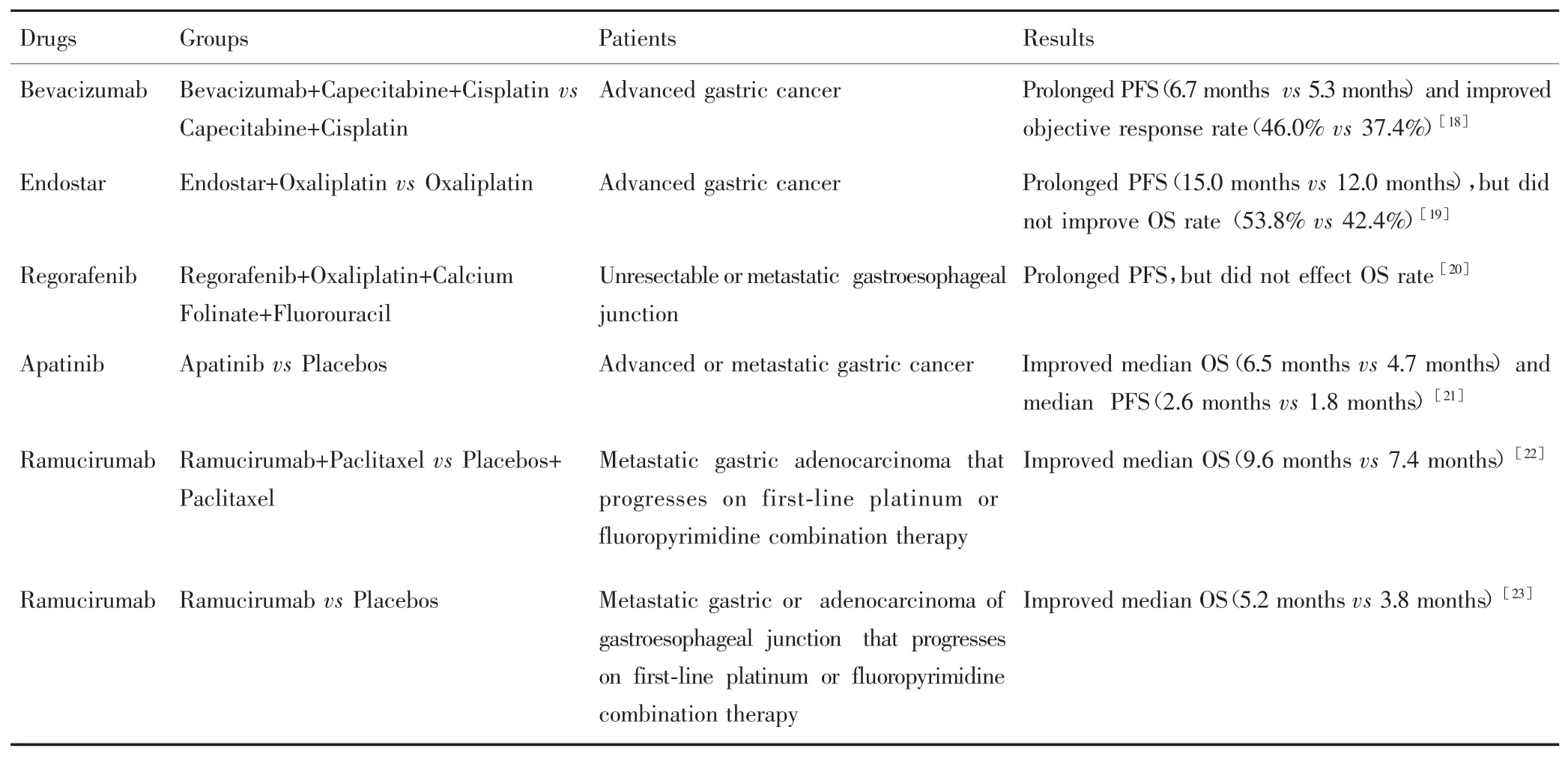
表1 VEGF靶向治疗进展期胃癌的主要临床试验汇总Tab.1 Major clinical trials of VEGF targeted therapy for advanced gastric cancer
4 手术
根据尸解报告,胃癌肺转移发生率为19.4%~52.4%,但肺转移瘤切除术仅占胃癌手术的0.26%[7],手术相关死亡率为0.6%~2.0%,与原发性肺癌相当[27]。与非手术治疗相比,胃癌肺转移手术治疗可提高1年、3年、5年生存率,OS为18~45个月,5年生存率为33.0%~38.1%[28-29]。目前学者提出了肺转移手术切除指征:⑴原发灶可控;⑵无其他肺外转移或肺外转移灶可控;⑶肺转移灶可切除且可保留足够的肺功能,尤其是孤立的小结节以及肺转移间隔时间长的患者[6,9];⑷无并发症发生率更低的替代方法[30]。但也有研究表明胃癌肺转移切除术未带来生存获益[31]。一项系统性分析报道胃癌肺转移切除术后的OS为45个月,5年生存率为38.1%,但进一步分析发现胃癌肺转移切除术并不是独立的预后因素,可能原因是既往报道病例中绝大多数是孤立性肺结节[6],而孤立性肺转移胃癌行手术切除可带来生存获益[32]。在手术时机方面,肺转移切除术应于明确诊断时进行还是延迟手术?有回顾性研究表明,延迟手术并未带来生存获益,主张手术时机的选择应主要根据患者身体状况、多学科协同治疗、原发病灶控制情况以及肿瘤类型等综合考虑。
在手术方式方面,目前肺转移瘤开胸切除术是外科医师常用的手术方法,优点是通过触诊可能切除更多转移灶。电视胸腔镜手术(video-assisted thoracic surgery,VATS)具有微创、术后疼痛少、对免疫功能及全身状况影响小、恢复快等特点[33],且即使同时行双侧肺转移瘤切除术亦安全[34]。尤其对于特别小的结节,围手术期或术中B超有助于肿瘤定位和切除[35-36]。研究发现肺转移瘤开胸切除术与VATS比较DFS、OS无明显差异[37-38],在日本超过70%的肺转移瘤切除术采用VATS[39],因此认为对于可切除的肺转移患者,VATS是合适的选择。此外,值得关注的是,肺转移瘤切除术后复发率高达53%[27]。多次手术切除能否获益?MINEO等[40]回顾性分析了113例行多次肺转移瘤切除术患者的生存获益情况,结果发现5年生存率为65%,与单次手术的5年生存率42%相比差异显著。可见对于肺转移瘤切除术后复发的患者早期值得再次手术,而VATS同样是可行的方法。激光肺转移瘤切除也是常用的治疗手段[41]。与手术切除或热灼疗法相比,其3年、5年生存率差异无统计学意义[42],并具有微创、出血少[43],可切除深在病灶,对相邻肺组织损伤微小,即使病变位于主要支气管或血管附近亦不易损伤等优点[44]。激光肺转移瘤切除通常经开胸进行,经胸腔镜激光切除同样安全、有效[45]。
区域淋巴结转移被认为是肺转移瘤切除术预后的影响因素之一[46],目前研究报道胃癌肺转移患者超过一半有淋巴血管侵犯[6],但肺转移瘤切除术中是否行淋巴结清扫目前尚存争议。有学者认为,胸内淋巴结转移与肺转移瘤切除术患者的DFS相关,因为切除纵隔淋巴结且最终证实存在转移可能导致系统性化疗增加从而带来生存获益[47]。但是否行纵隔淋巴结清扫应在肺转移瘤切除术中根据具体情况决定[48],至少纵隔淋巴结转移与否不是肺转移瘤切除术的绝对禁忌证[49]。但也有学者认为,术前CT、PET/CT检查评估纵隔或胸内淋巴结转移的阳性率不高[50];此外切除转移灶即可获得较长的DFS,没必要追求转移瘤及区域淋巴结一并切除[51]。最新研究亦表明,纵隔淋巴结切除并未提高5年OS或降低5年累积复发率[47]。因此,对于胃癌肺转移瘤切除术中是否行淋巴结清扫,未来仍需开展随机对照试验进一步阐明。
5 消融术
射频消融使用400~500 kHz的交流电通过探针传送到目标组织,在60℃以上的温度下,可导致凝固性坏死,治疗时间为12~15 min。探针通常在CT引导下放置;对于多个病变,则通过全麻下小切口开胸术放置[52]。射频消融通常用于心肺功能差、病灶较多患者[53]。研究表明,肺转移瘤(包括胃癌肺转移患者)射频消融治疗后2年、3年和5年的生存率分别为57%、56%和51%[54]。一项来自澳大利亚的前瞻性、开放性研究表明,结直肠癌肺转移行射频消融后,中位OS为51个月,5年生存率为45%[55],这一结果令人鼓舞。
微波消融与射频消融一样均是利用热损伤原理,但前者使用较高频率,一般为915 MHz~2.45 GHz,作用时间亦较短(2~5 min)。微波消融同样安全有效,肺转移瘤(包括胃癌肺转移)患者微波消融后1年、2年生存率分别为91.3%、75.0%[54]。一项前瞻性、多中心、单臂研究表明,肺转移(包括胃癌肺转移)患者冷冻消融治疗6个月、12个月的肿瘤控制率分别为96.6%、94.2%,1年生存率为97.5%,气胸发生率为18.8%,且未发生4~5级并发症[56]。综上认为,消融术治疗肺转移(包括胃癌肺转移)安全、有效,具有微创、操作相对简单等特点。
6 放射治疗
立体定向放射治疗(stereotactic body radiation therapy,SBRT)是一种有效、无创、可保留肺组织的治疗方法,通常用于治疗无法手术的孤立性或寡转移瘤[57]。NYUTTENS等报告30例(包括胃癌肺转移患者)共57个肺转移瘤行SBRT治疗的情况,其中外周大肿瘤照射剂量60 Gy(3野),周围小肿瘤照射剂量30 Gy(1野),中央肿瘤照射剂量60 Gy(5野),平均随访36个月,4年生存率为38%[58]。另一研究报告了76例患者(包括胃癌肺转移患者)共118个肺部病变,中心肿瘤与周边肿瘤剂量处方不同,大肿瘤与小肿瘤剂量处方也不同,尽管80%的患者表现为1级肺毒性(其中以放射性纤维化为主,占肺部的25%),但无2级或更高级的肺毒性发生,3年生存率为73%[59]。可见,目前SBRT在不同类型肿瘤所致的肺转移包括胃癌肺转移治疗中显示了较好疗效,2年的病灶控制率为70%~90%,与肺转移瘤切除术的疗效相当。因此,未来值得深入开展随机对照试验证实SBRT在胃癌肺转移治疗中的确切疗效。
7 小结
至今为止,有关胃癌肺转移的研究大多为回顾性研究或荟萃分析,证据级别不高。胃癌肺转移很多相关问题均需开展前瞻性、多中心随机对照试验解决。此外,胃癌肺转移是Ⅳ期胃癌的一种表现形式,患者疾病情况复杂,临床表现包括单发、多发或寡转移、单肺或双肺转移、表现为癌结节或癌性淋巴管炎、是否合并纵隔淋巴结转移等,需要组织多学科协作,充分结合患者病情,如原发灶是否控制、有无肺外病灶、全身状况和治疗耐受性,以及手术、化疗、靶向治疗、消融治疗、放疗等治疗手段的可能作用与风险,同时亦要充分考虑患者的期望值,综合考虑下实施个体化治疗,才能真正为患者带来生存获益。

