不同肝体积评估指标预测肝癌术后肝功能衰竭的效能分析
陆战龚文锋钟鉴宏马良张志明向邦德黎乐群
作者单位:南宁530021 1广西医科大学附属肿瘤医院肝胆胰脾外科;2广西肝癌诊疗工程技术研究中心;3广西国际壮医医院肝胆外科
肝切除术是肝细胞癌(hepatocellular carcinoma,HCC)患者首选且有效的治疗方法,随着肝脏外科技术的进步以及围手术期管理水平的提高,更多的患者可耐受更大范围的肝切除术[1-2]。然而,不断扩大的肝切除术适应证增加了术后肝功能衰竭(post-hepatectomy liver failure,PHLF)发生风险。研究报道PHLF发生率为1.2%~32.0%,死亡率为1.6%~2.8%[3-4]。评估术前残肝体积(remnant liver volume,RLV)是应用最广泛且有效的预测术后PHLF的方法之一。根据CT、MR模拟测量已可获得较准确的RLV,但是目前评估RLV安全临界值的方法较多,主要有残肝分数(remnant liver volume to total liver volume,%RLV)、残肝体积/体重比率(remnant liver volume to body weight ratio,RLV/BW)、标准残肝体积(standard remnant liver volume,SRLV)及残肝体积/标准肝体积(remnant liver volume to standard liver volume,RLV/SLV)[5-7]等。此外,PHLF诊断标准较多,其中应用广泛的诊断标准为BALZAN等[8]提出的“50-50”标准。可见,不同地区、不同研究采用的PHLF诊断标准以及判断残肝体积安全临界值及其方法未统一。本研究采用“50-50”标准,评估以上4种肝体积测定指标预测HCC患者肝切除术后PHLF发生的效能,以期更好地预测PHLF,降低术后PHLF发生率。
1 资料与方法
1.1 临床资料
选取2013年9月至2016年8月于广西医科大学附属肿瘤医院行肝切除术的1 446例乙型肝炎病毒相关性HCC患者。纳入标准:⑴术后病理检查确诊为HCC;⑵行半肝切除术;⑶HbsAg(+);⑷肝功能Child-Pugh分级A级;⑸临床资料完整。排除标准:⑴术前合并胆道梗阻或肝门部胆管癌;⑵术前行化疗、放疗或肝动脉化疗栓塞术治疗;⑶复发再手术患者;⑷合并糖尿病、HIV、酒精性肝硬化或其他肝炎病毒感染者;⑸同期患其他恶性肿瘤者。
1.2 方法
术前常规行血常规、肝功能、肾功能、凝血功能、乙肝五项、甲胎蛋白(α-fetoprotein,AFP)、HBV-DNA实验室辅助检查及肝脏CT增强扫描,由2名医师采用Myrian-Liver手术规划系统行模拟切除,测定肝脏总体积(total liver volume,TLV)、肿瘤体积(tumor volume,TV)、预切除的正常肝体积及残肝体积,取平均值,差异较大时由第3名医师测算后商议决定。分别采用%RLV、RLV/SLV、RLV/BW、SRLV评估残肝体积,计算公式见表1。

表1 %RLV、RLV/BW、RLV/SLV、SRLV的计算公式Tab.1 Formula of %RLV,RLV/BW,RLV/SLV and SRLV
所有患者均行肝切除术(鞘外结扎离断切除侧Glisson蒂或者鞘内解剖分别结扎离断切除侧的门静脉、肝动脉及胆管,切肝全程显露肝中静脉),术中必要时给予pringle法阻断第一肝门,每次阻断15 min,间歇5 min。采用排水法测定离体标本体积(精确1 mL)。记录出血量、手术时间等,检测术后1 d、3 d、5 d、7 d血常规、肝功能、肾功能、凝血功能等,并记录术后并发症及90 d内的PHLF相关死亡例数。术后并发症分级评估按Clavien-Dindo评分系统标准[9]分为Ⅰ~Ⅴ级,其中Ⅰ~Ⅱ级并发症视为轻度,Ⅲ~Ⅳ级并发症视为重度。按照术后是否出现PHLF分为PHLF组和无PHLF组,PHLF诊断按“50-50”诊断标准[8]:肝切除术后第5天凝血酶原时间百分活动度(prothrombin time activity percentage,PT%)<50%(等同于INR>1.7)及总胆红素(total bilirubin,TBIL)>50μmol/L。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析,服从正态分布或近似正态分布变量资料以均数±标准差(±s)表示,计量资料比较采用独立样本t检验,计数资料比较采用χ2检验或Fisher确切概率法;相关性分析采用Pearson检验。采用MedCalc 9.2统计软件进行ROC曲线分析及比较。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较
共181例患者符合标准纳入研究,其中无PHLF组159例,PHLF组22例。两组性别、年龄、AFP、HBV-DNA、手术方式、手术时间、肿瘤大小、是否肝门阻断、术中出血量等方面比较,差异均无统计学意义(P>0.05),见表2。
2.2 RLV/SLV、%RLV、SRLV、RLV/BW比较
术前手术规划模拟切除的肝体积与排水法测量切除标本体积分别为(941.74±582.71)mL、(890.43±42.41)mL,两者比较差异无统计学意义(t=-0.845,P=0.40),且二者呈正相关(r=0.99,P<0.001)。无PHLF组和PHLF组患者RLV/SLV、%RLV、SRLV、RLV/BW比较,差异有统计学意义(P<0.001)。见表3。
2.3 ROC曲线分析结果
ROC曲线分析结果显示,%RLV、RLV/SLV、RLV/BW、SRLV分别以61%、48%、0.94%和340 mL/m2为临界值,AUC依次为0.77、0.91、0.84、0.91。其中RLV/SLV分别与%RLV和RLV/BW比较,差异均有统计学意义(P<0.01),但RLV/SLV与SRLV比较差异无统计学意义(P=1.00);SRLV分别与%RLV和RLV/BW比较差异亦有统计学意义(P<0.01)。见图1、表4和表5。
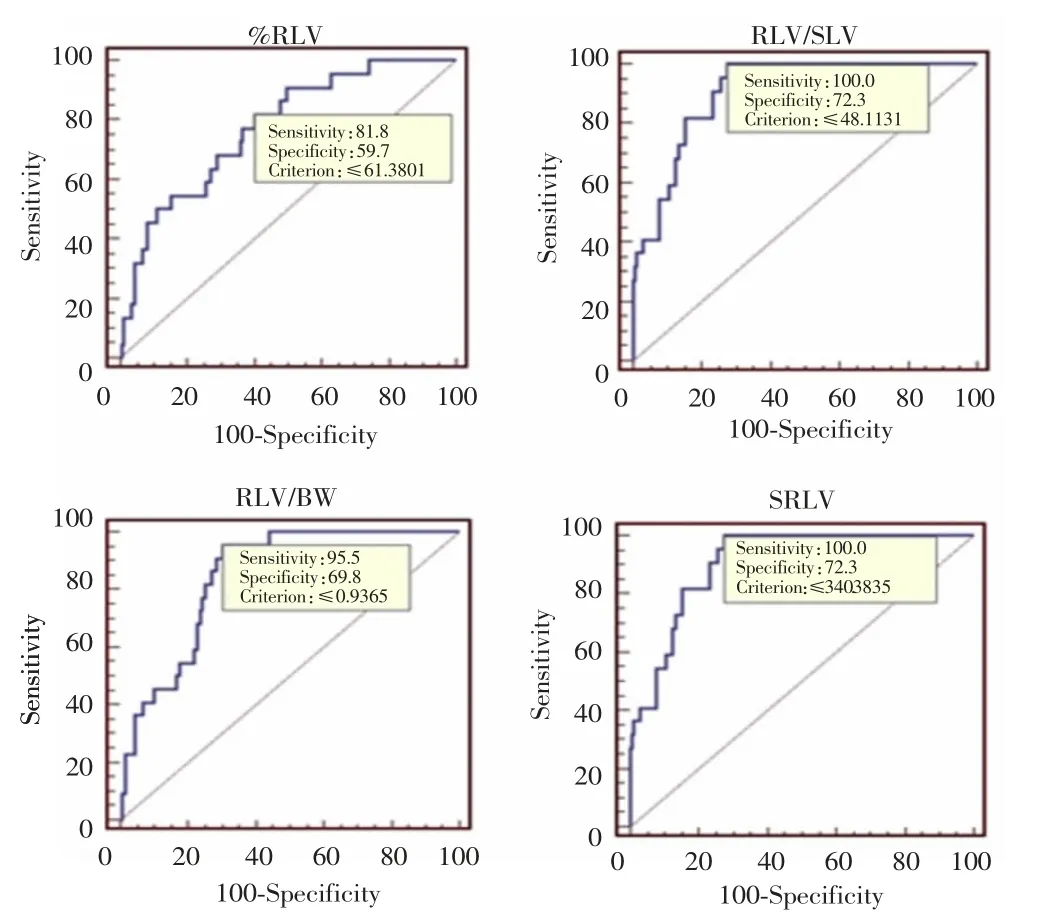
图1 %RLV、RLV/SLV、RLV/BW和SRLV的ROC曲线Fig.1 ROC curves of %RLV,RLV/SLV,RLV/BW and SRLV
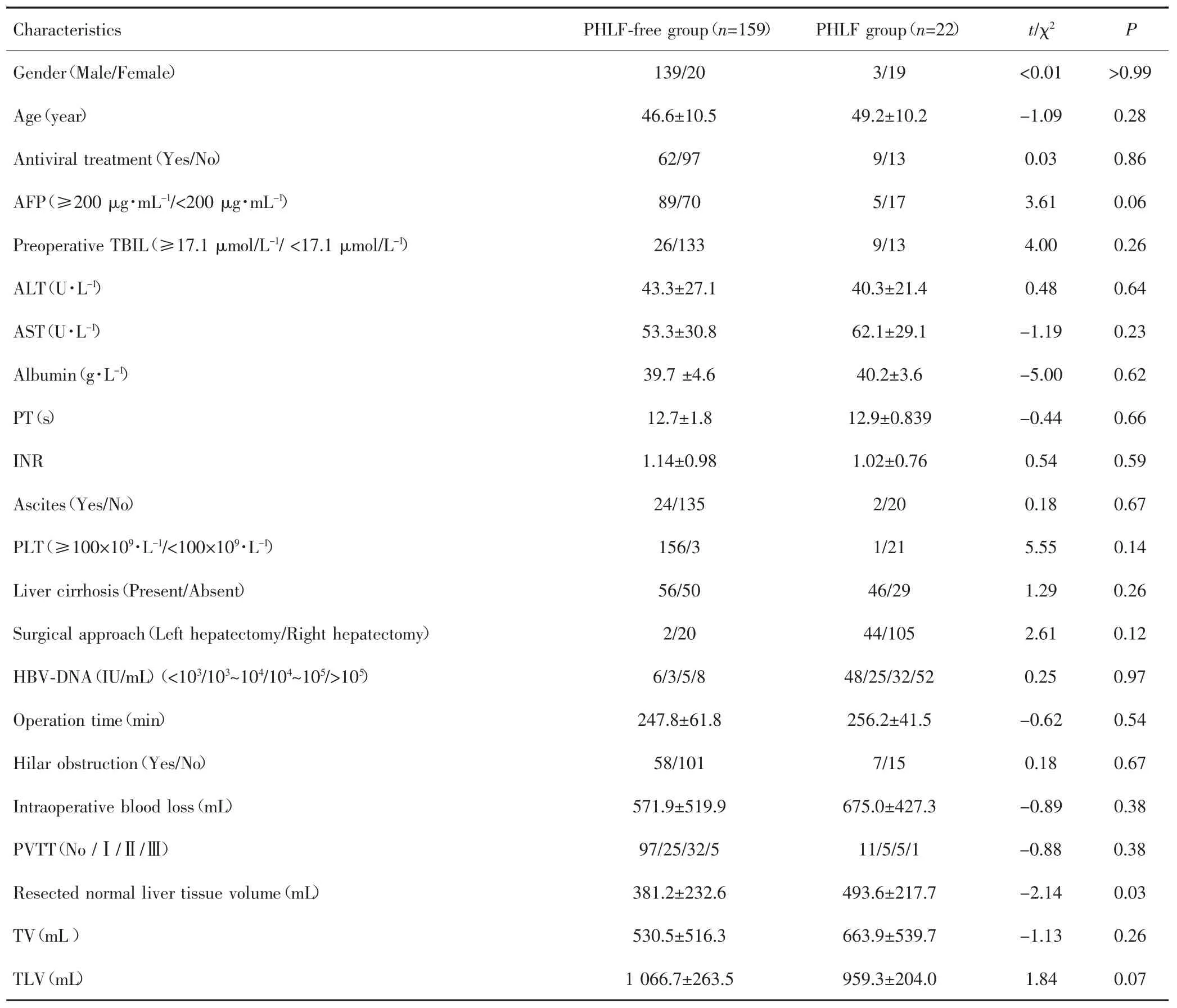
表2 PHLF组和无PHLF组患者基线资料比较Tab.2 Comparison of baseline data between patients in the PHLF group and the PHLF-free group
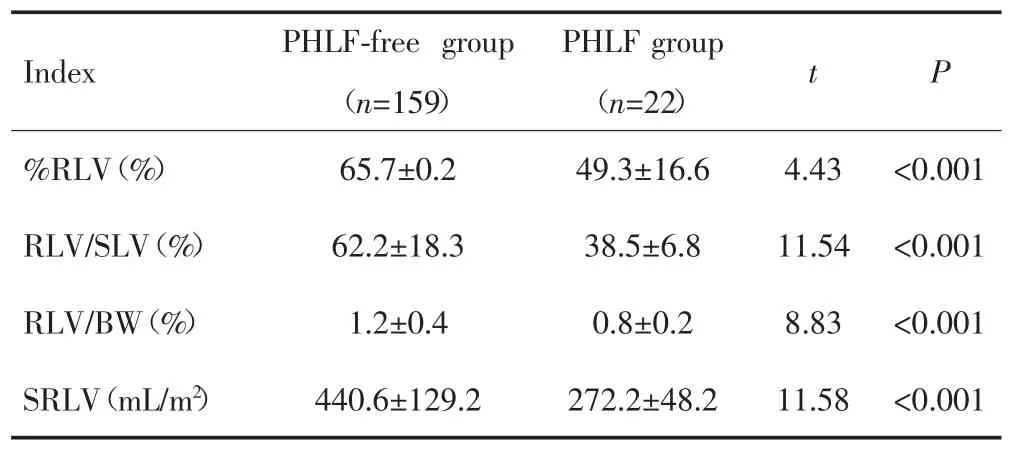
表3 PHLF组和无PHLF组患者%RLV、RLV/BW、RLV/SLV和SRLV的比较Tab.3 Comparison of %RLV,RLV/BW,RLV/SLV and SRLV between patients in the PHLF group and the PHLF-free group
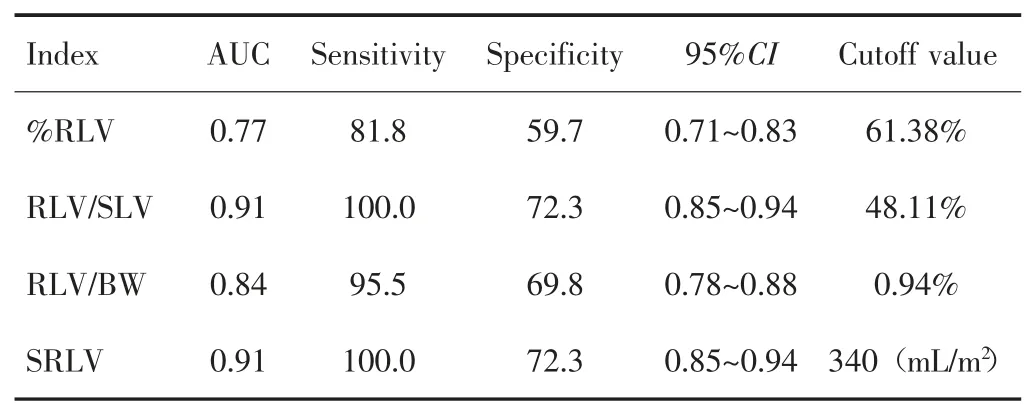
表4 %RLV、RLV/BW、RLV/SLV、SRLV的ROC曲线分析结果Tab.4 ROC curve analysis results of %RLV,RLV/BW,RLV/SLV,and SRLV
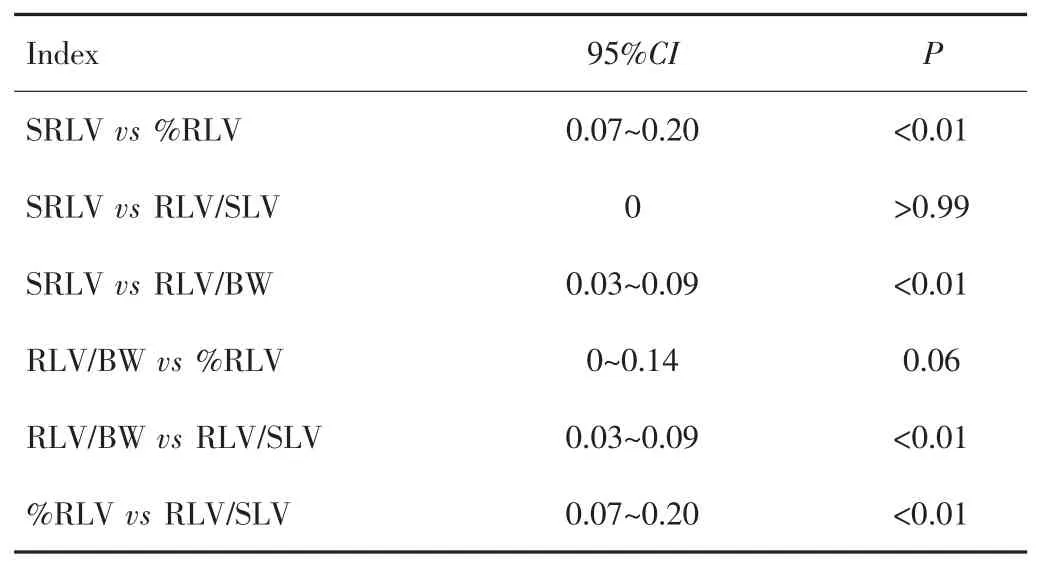
表5 %RLV、RLV/BW、RLV/SLV、SRLV ROC曲线比较Tab.5 Comparison of ROC curves of %RLV,RLV/BW,RLV/SLV,and SRLV
2.4 死亡率与并发症发生率
以SRLV的临界值340 mL/m2将患者分为SRLV>340 mL/m2组(n=116)和SRLV≤340 mL/m2组(n=65)。SRLV>340 mL/m2组发生轻度并发症65例,重度并发症13例,无死亡病例;SRLV≤340 mL/m2组轻度并发症40例,重度并发症23例,因PHLF死亡1例;SRLV≤340 mL/m2组重度并发症发生率显著率高于SRLV>340 mL/m2组,差异有统计学意义(χ2=-5.68,P<0.01)。
3 讨论
PHLF是肝切除术后严重的并发症之一,术前肝体积测定可较好地预测术后PHLF的发生风险[10]。%RLV是评估残肝体积指标之一,2016年NCCN指南推荐无肝硬化患者%RLV>25%术后可避免PHLF发生。研究发现肝移植患者根据体重计算的RLV/BW可有效评估残肝体积安全界限值,且较%RLV评估肝切除术后是否发生PHLF的敏感度及特异度更高,可用于简单计算残肝体积大小[11]。而标准化肝脏体积是通过尸体解剖分析肝脏体积与BSA的关系计算,RLV/SLV预测PHLF的敏感度及特异度较%RLV更高,与RLV/BW相当[12-13]。然而人的能量合成、代谢等功能评估均与BSA有关,而肝脏是这些生理活动的中心,考虑BSA差异可能带来的影响,目前学者认为采用SRLV预测残肝体积更合理[7,14]。目前认为,与国际肝脏外科研究小组(International Study Group of Liver Surgery,ISGLS)提出的ISGLS肝功能衰竭标准[15]比较,“50-50”标准定义PHLF更为严格,更符合临床实际。本研究采用“50-50”标准定义PHLF,评价以上4种肝体积评估指标预测术后PHLF的效能。术前模拟切除肝脏体积,发现与排水法测定的标本体积比较,前者较后者大51.3 mL,但差异无统计学意义,与HIROSHIGE等[15]研究结果相似,说明Myrian-Liver软件测定肝体积结果准确,4种肝体积评估指标测定结果准确、可信。体积差异考虑可能有以下几个原因:⑴模拟切除线与实际切除线存在一定偏离;⑵切除过程中血液流失导致标本体积较实际偏小;⑶模拟切除测定体积包含了手术过程中的实际切面体积,该切面实际已在术中被吸走。
目前已有研究比较各肝体积评估指标的诊断效能,但样本量均偏小,且仅评估其中两者的效能,重点关注截点值研究,而4种评估指标诊断效能的比较尚未见报道。CHUN等[13]通过比较68例行大部分肝切除的肝癌患者发现RLV/BW≤0.4及RLV/TLV≤20%对预测术后PHLF具有较好的效能。KIM等[16]回顾分析74例肝切除术后患者发现RLV/SLV较%RLV具有更高的敏感度及特异度。本研究发现无肝功能衰竭组患者的RLV/SLV、%RLV、SRLV、RLV/BW与肝功能衰竭组患者差异明显,ROC曲线分析显示4项指标均可有效预测PHLF,AUC均>0.7;进一步对比分析发现SRLV的诊断效能明显优于%RLV、RLV/BW,而与RLV/SLV相当,说明采用标准化的残肝体积预测术后PHLF更有优势,本研究结果与国内外大部分临床中心[17-18]行肝移植时所选择的主要指标包括SRLV及RLV/SLV基本吻合,进一步证实其可靠性。
基于本研究中SRLV及RLV/SLV预测术后PHLF的敏感度及特异度较高,而考虑SRLV相对RLV/SLV计算更加方便、简单,更易于临床应用。因此,以SRLV临界值分为SRLV>340 mL/m2和SRLV≤340 mL/m2组,进一步观察两组患者术后并发症及PHLF相关死亡情况,发现SRLV≤340 mL/m2患者的重度并发症发生率较高,且1例因PHLF死亡,与前期研究结果一致[19]。SHIRABE等[14]纳入80例无硬化HCC患者,结果发现SRLV<250 mL/m2的患者术后PHLF发生率为38%,而SRLV>250 mL/m2患者无PHLF发生,术后并发症发生率亦显著高于SRLV<250 mL/m2组,与本研究结果相似。陈熙等[7]亦报道SRLV≤416 mL/m2组患者发生术后肝功能代偿不全的风险明显增高。但该研究SRLV值明显大于本研究的340 mL/m2,可能是该研究纳入患者中合并肝硬化的患者比例高达78%,明显高于本研究,而肝硬化越严重,肝脏功能越差,为保证安全性,需保留体积越大。此外,两项研究采用的肝功能失代偿及肝功能衰竭的评估标准不同,亦可能是导致SRLV值差异明显的原因。
本研究发现,SRLV和RLV/SLV预测HCC患者半肝切除术后是否发生肝功能衰竭的效能优于%RLV和RLV/BW,尤其SRLV≤340 mL/m2的患者术后PHLF发生风险及重度并发症的发生率增加。但因本研究尚未排除不同肝脏背景下肝细胞再生能力差异对围手术期肝功能恢复的影响,且术后肝硬化的诊断只代表切除区域的肝硬化程度,剩余肝脏肝硬化程度与实际切除者的差异亦可能影响研究结果,因此有关结论尚需进一步研究。

