CD47在脑胶质瘤的表达水平及对侵袭力的影响
(1山东省立第三医院,山东 济南 250031;2临沂市第三人民医院,山东 临沂 276023)
脑胶质瘤是最常见的颅内肿瘤,近年来其发生率呈逐年递增趋势。有研究表明,胶质瘤因其自身较强的侵袭能力,具有较高的复发率和死亡率[1],预后较差。CD47为细胞膜蛋白,表达于多种正常细胞的表面,在大部分人肿瘤细胞中也高表达,可以作为肿瘤诊断及判断预后的一个分子标志物[2]。而有关脑胶质瘤中CD47的表达水平研究很少。为此,本文对CD47在脑胶质瘤中的表达及其对侵袭力的影响进行了探讨。
1 材料与方法
1.1材料 (1)标本:选取本院接受手术切除并经病理证实的脑胶质瘤患者30例,获得胶质瘤组织,同时获取10个正常脑组织。患者在手术前没有进行放疗、化疗及辅助治疗。根据WHO分类确定胶质瘤的组织学分型,并经2位具有副主任医师及以上职称的病理科医师确定每个样本的病理诊断。样本离体0~4 h内存放在-80℃下冷藏。(2)试剂及耗材:细胞培养瓶、细胞培养板及Transwell(膜孔径 8μm);电泳仪EPS300,PCR扩增仪2700;胶质瘤细胞U251,T98G和U87以及正常胶质细胞HEB(中国科学院生物物理研究所提供);DMEM培养基和胎牛血清(Gibco公司);添加FBS(10%)以及链霉素和青霉素(100 U/mL);渥曼青霉素,抗 PI3K和磷酸化PI3K(P-PI3K)、抗AKT和磷酸化AKT(P-AKT)抗体购自Abcam公司(美国)。
1.2方法
1.2.1CD47过表达及低表达载体构建及转染 以pOTB-CD47质粒为模板,PCR扩增CD47片段,用XhoI和HindIll分别将PCR产物CD47及目的载体pcDNA3.1-3xFlag进行双酶切。将酶切回收后的CD47基因片段和pcDNA3.1-3xFlag载体片段进行连接。将过夜连接的混合液直接转化DH5a感受态细胞,进行重组质粒的扩增与提取。将CD47过表达的质粒cDNA3.1-3xFlag-CD47和空载Vector转染至细胞密度为60%~70%的脑胶质瘤细胞中,利用转染试剂,按照说明书进行转染,在转染前使用磷酸盐缓冲盐水洗涤细胞,72 h后提蛋白验证转染效率并进行后续实验。
1.2.2实时荧光定量PCR 采用TRIzol试剂提取总核糖核酸。为了量化CD47转录,借助转基因生物技术进行gDNA去除和cDNA超螺旋合成。应用于GAPDH以及CD47的寡核苷酸引物如下:GAPDH,5'-GCACCGTCAAGGCTGAGAAC-3'(有义)和5'-TGGTGAAGACGCCAGTGGA-3'(反义);CD47,5'-AGATCCGGTGGTATGGATGAGA-3'(有义)和5'-GTCACAATTAAACCAAGGCCAGTAG-3'(反义)。每个程序一式3份进行。通过2%琼脂糖凝胶电泳及熔解曲线鉴定qRT-PCR产物,并用△Ct进行定量分析,ΔCt=目的基因Ct-内参基因Ct;关于CD47cDNA循环阈值Ct根据△△Ct方法对GAPDH进行分析。
1.2.3Western Blott分析 将六孔板应用于细胞培养,直至在100U/ml双抗(青霉素/链霉素)的DMEM培养基中汇合达到80%。取出培养基,用PBS洗涤细胞2次。加入细胞,随后从平板上刮下细胞,并在4℃下以14 kg离心10 min。经过裂解和加热的等量蛋白质(30 μg/孔)在聚丙烯酰胺凝胶的帮助下进行电泳。将分离的蛋白质移至PVDF膜,然后置室温环境下在脱脂乳的帮助下封闭1 h。在4℃的情况下,在第一抗体的帮助下,膜进行过夜孵育。按照指示进行浓度的测定。然后用辣根过氧化物酶结合的膜孵育第二抗体在室温下持续1 h,最后使用增强的化学发光试剂盒检测蛋白质。
1.2.4细胞侵袭实验 在转染后24 h,细胞用丝裂霉素C(10μg/ml)处理2 h。将细胞进行胰蛋白酶处理,并在不含血清的培养基中以每室1×105个细胞的密度种植到上面的室中。下面的室里装满含有FBS(15%)的DMEM-F12培养基,可作为化学诱导剂。孵化持续48 h,随后位于室上部表面的细胞温和地消除。位于下室的入侵细胞用甲醇和结晶紫染色并进行固定。应用光学显微镜评估5个随机视野中的细胞数量。
2 结果
2.1CD47的表达水平 CD47在脑胶质瘤组织中高表达(P<0.05),见图1A;CD47在U87中高表达,在T98G中低表达(P<0.05),见图1B、C。
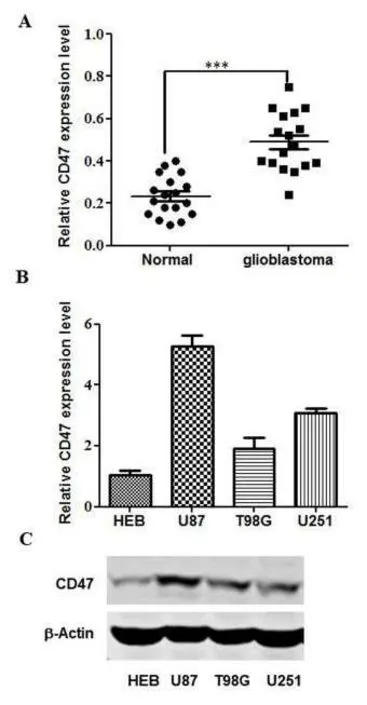
图1 CD47在脑胶质瘤中的表达
2.2CD47的表达对脑胶质瘤侵袭性的影响 与对照组的侵袭相比,CD47低表达抑制U87的侵袭(P<0.05),见图2C、D;CD47过表达促进T98G细胞的侵袭性(P<0.05),见图3C、D。
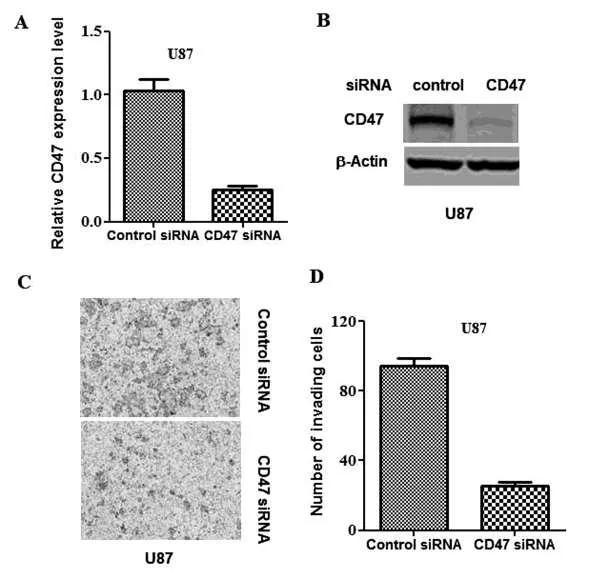
图2 CD47低表达对脑胶质瘤侵袭的影响 A、B:在转染后24h应用RT-PCR及Western Blott阻止CD47的转录与翻译,敲除U87细胞的CD47;C、D:在体外采用侵袭实验测定低表达CD47对胶质瘤侵袭性的影响

图3 CD47过表达对脑胶质瘤侵袭性的影响 A、B:在转染后24h应用RT-PCR及Western Blott干扰CD47的转录与翻译,使T98G细胞中CD47过量表达;C、D:在体外采用侵袭实验测定过表达CD47对脑胶质瘤侵袭性的影响
3 讨论
有研究发现,CD47的表达促进多种肿瘤的侵袭性,如胃癌、宫颈癌和黑色素瘤等[3-5],其受体刺激PI3K/Akt通路。表明CD47可以作为治疗多种癌症的靶点和创新预测因子。阻断CD47-SIRPa信号通路显著抑制黑素瘤的生长以及肺转移[6]。在乳腺癌、卵巢癌、膀胱癌、肝癌等多种肿瘤的体外实验研究中,CD47单抗均可显著抑制肿瘤的生长和转移,并且延长生存期[6-9]。但有关CD47在脑胶质瘤中表达的研究很少,为此本研究对CD47在脑胶质瘤中的表达及其对侵袭力的影响进行了探讨,结果表明:与正常脑标本比较,CD47在高级别的脑胶质瘤细胞中高表达,在U87中的表达最明显;CD47低表达显著抑制U87的侵袭,过表达显著促进T98G细胞的侵袭性。
综上所述,CD47在脑胶质瘤中高表达,在U87中的表达最明显;其过表达显著促进了脑胶质瘤的侵袭能力。CD47可作为脑胶质瘤的重要预测指标和治疗靶点。
——一道江苏高考题的奥秘解读和拓展

