归纳法在高中化学教学中的有效运用初探
李建忠
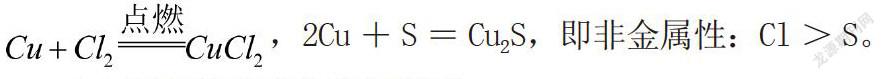

摘 要:有效的教学方式是指教师遵循教学规律,用少量时间和精力投入教学中,获取更多的教学成绩。本文结合高中化学学科特征,结合教师教学经验来探究、分析如何在高中化学教学中运用归纳法的方式进行化学教学,帮助学生提升对高中化学学习的成效,减轻学生学习化学的困难,激发学生对化学学习的兴趣和爱好。
关键词:归纳法;高中化学教学;有效运用
1.概述归纳法
所谓归纳法,具体来说就是将其中的某个论点或某个事件的论证,将这些论点或论证之间存在的共同之处总结出来,然后将这些共同之处进行规范化。
2.归纳法在高中化学教学的一些应用
2.1归纳化学中的一些特殊性质
例如化学中常见的有色物质,可以进行归纳总结,必要时还要对这些物质进行适当的分类,有颜色的物质有哪些、有色离子有哪些等。否则因需要记住的物质比较零散而记忆不牢固。比如水溶液中的有色离子:Fe2+为浅绿色;Cu2+为蓝色;Fe3`为深黄色`;MnO4_为紫色;Cr2O7-为橙红色。
2.2归纳化学中的重要性质
例如:在总结金属性和非金属性的递变规律这一部分内容时,由于这部分内容的知识点比较多,规律复杂,可以引导学生对本部分的总结如下:
一方面,根据元素周期表的知识进行归纳判断
①同一周期中,从左到右,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。
②同一主族中,从上到下,随着原子序数的递增,元素的金属性逐渐增强,非金属性逐渐减弱。
显然,元素周期表左边为活泼的金属元素,右边为活泼的非金属元素;
最活泼的金属在左下方即Fr,天然存在的最活泼的金属是Cs;最活泼的非金属元素在右上方即F(稀有气体元素除外)。
另一方面.根据元素的单质及其化合物的性质进行归纳判断。
(1)金属性强弱判断
①根据元素的单质与水或酸反应置换出氢的难易或反应的强烈程度进行判断:一般地,越容易置换出氢,金属性越强。
②根据元素的单质的还原性(或离子的氧化性)进行判断。一般情况下,金属单质的还原性越强,对应的金属阳离子的氧化性越弱,金属性越强。
③根据元素的最高价氧化物对应水化物的碱性强弱进行判断:碱性越强,则金属性越强;碱性越弱,则金属性越弱。
④根据置换反应进行判断:一般是金属性“强”置换金属性“弱”。
⑤根据原电池正负极进行判断:一般地,负极金属性比正极强。但是某些特殊情况,比如镁与铝连接后插入到NaOH溶液中,金属性弱的铝做负极。
(2)非金属性强弱判断
①根据与H2反应生成气态氢化物的难易或反应的剧烈程度或生成的气态氢化物的稳定性强弱进行判断:元素气态氢化物的稳定性越强,元素的非金属性越强;元素气态氢化物的稳定性越弱,元素的非金属性越弱。
②元素最高价氧化物对应水化物的酸性强弱判断:酸性越强,则非金属性越强;酸性越弱,则非金属性越弱。
③单质的氧化性(或离子的还原性)强弱判断:一般情况下,非金属单质的氧化性越强,对应的阴离子的还原性越弱,非金属性越强。
④根據置换反应进行判断:一般是非金属性“强”置换非金属性“弱”。
⑤根据与同一种金属反应,生成化合物中金属元素的化合价的高低进行判断。化合价越高,对应的非金属性越强。例如:,2Cu+S=Cu2S,即非金属性:Cl>S。
2.3归纳化学中的重要规律
例如高中化学中微粒半径的大小比较该如何判定。首先,探究决定微粒半径大小的因素,一方面是核外电子层数,另一方面是核外电子数。其中核外电子层数是主要因素,一般来说,核外电子层数越多时,微粒半径也就越大;比如r(Na)>r(O).其次,当电子层数相同的情况下,核电荷数越多,相应的微粒半径就会越小。比如,同一周期原子半径从左到右会依次减小。比如r(Na)>r(Mg)>r(Al).第三,相同元素的离子和原子进行比较,一般是阳离子半径比原子要小,而阴离子半径要比原子大。比如r(O2-)>r(O),r(Na)>r(Na+).第四,电子数相同的简单离子半径大小比较,一般是原子序数较大的离子半径反而更小。这就是常说的“序大径小”规律,比如r(O2-)>r(Na+)。
2.4归纳化学中常用的解题方法及技巧
例如:差量法是高考化学计算中的常见方法之一,掌握了这种方法,对某些题而言,往往会取得事半功倍的效果。
差量法是依据化学反应前后的某些“差量”(质量差、物质的量之差、气体体积差等)与反应或生成物的变化量成正比而建立的一种解题方法。此法将“差量”看作化学方程式右端的一项,将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,然后求解。
【例】 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,充分反应后,其固体质量变为w2g,则该样品的纯度(质量分数)是( )
总结:综上所述,在进行化学知识的学习时,如果对化学中的重要性质、特殊性质、重要规律以及常用的解题方法和技巧等进行归纳,将有效提升学生对化学知识的掌握,切实提升学生对化学问题的解决成效。

