液相色谱-串联质谱法测定蜂王浆中双甲脒及其代谢物的残留量
侯建波,谢 文,曾淦宁,张文华,史颖珠,钱 艳,周启令
(1.浙江省检验检疫科学技术研究院,浙江 杭州 310016;2.浙江出入境检验检疫局检验检疫技术中心,浙江 杭州 310016;3.浙江工业大学海洋学院,浙江 杭州 310014;4.浙江立德产品技术有限公司,浙江 杭州 310016)
蜂王浆可辅助控制血管扩张,具有降血糖、降血脂、降血压、保护肝脏、抗菌消炎以及提高免疫力、抗衰老等功效[1]。我国是蜂王浆的主要生产国,产品主要出口日本、欧盟和美国等发达国家和经济体[2]。随着蜂王浆营养价值认可度的不断提高,人们对其消费需求不断增长,对其质量要求也越来越高,药物残留成为衡量蜂王浆产品质量的重要指标。
双甲脒(amitraz),又称为N,N-双(2,4-二甲苯亚氨基甲基)甲胺,是一种常见的有机氮杀虫、杀螨剂,广泛用于果树、蔬菜、茶叶、棉花等作物的害虫防治[3]。由于双甲脒可以有效防治狄瓦氏螨引起的蜂病,且对蜜蜂低毒,因此广泛用于蜂巢除螨[4-5]。双甲脒易发生代谢或降解,生成单甲脒(DMPF)、2,4-二甲基苯基甲酰胺(DMF)和2,4-二甲基苯胺(DMA),其代谢途径示于图1。其中,DMA在化工合成中常作为单甲脒和双甲脒的合成原料,具有毒副作用和致突变性,对肝脏的损伤较大[6]。因此,各国纷纷制订双甲脒在农产品及蜂产品中的限量,以保证其质量安全,其中,欧盟、日本和美国规定蜂产品中双甲脒限量为0.2 mg/kg,意大利和德国规定的限量为0.01 mg/kg,同时检测其代谢物[7-10]。
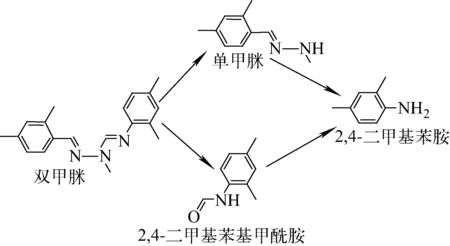
图1 双甲脒的主要代谢路径Fig.1 Metabolism routes of amitraz
目前,测定食品中双甲脒及其最终代谢产物2,4-二甲基苯胺残留量通常采用气相色谱法[11-14]和气相色谱-质谱法[15-19],前处理方式以酸、碱环境下高温水解样品居多。对蜂产品的检测主要集中于蜂蜜样品[11-14,17-18,20-21],而对蜂王浆的检测报道较少[19,22]。随着液相色谱和质谱的不断发展,研究人员通过高效液相色谱(HPLC)法[23-24]和液相色谱-串联质谱(LC-MS/MS)法检测了食品、水和血液等样品中双甲脒及其代谢物[25-28]。
本工作拟采用固相萃取-液相色谱-串联质谱法(SPE-LC-MS/MS)测定蜂王浆中双甲脒、单甲脒、2,4-二甲基苯基甲酰胺和2,4-二甲基苯胺的残留量,希望为蜂王浆的质量控制提供方法和数据参考。
1 实验部分
1.1 主要仪器与装置
1260-6495型液相色谱-串联质谱仪:美国Agilent公司产品,配有电喷雾离子源;固相萃取装置:美国Supelco公司产品;氮吹仪:美国Organomation公司产品;台式离心机:美国Thermo公司产品;Milli-Q超纯水器:美国Millipore公司产品。
1.2 主要材料与试剂
中性Al2O3固相萃取柱(1 g/3 mL)和C18固相萃取柱(500 mg/3 mL):中国上海安谱实验科技股份有限公司产品;HLB固相萃取柱(500 mg/6 mL)和MCX固相萃取柱(150 mg/6 mL):美国Waters公司产品;乙腈、甲醇和甲酸:均为色谱纯,美国Tedia公司产品;实验用水:Milli-Q高纯水;氨水:分析纯,中国上海国药集团产品;双甲脒、单甲脒、2,4-二甲基苯基甲酰胺和2,4-二甲基苯胺标准品:纯度均为99%,德国Dr. Ehrenstorfer公司产品;双甲脒-D6标准品:纯度98%,加拿大TRC公司产品;2,4-二甲基苯胺-D6标准品:纯度98%,加拿大C/D/N Isotopes公司产品。用乙腈将各化合物溶解、稀释并定容,制得10 mg/L标准储备液,再用乙腈将其稀释至所需浓度。
1.3 实验方法
1.3.1样品的提取 精确称取2.00 g蜂王浆样品于50 mL聚塞离心管中,加入20 ng同位素内标和8 mL 5%氨水溶液,以2 000 r/min涡旋混合1 min,静置5 min;再加入10 mL 5%氨水-乙腈溶液,以2 000 r/min涡旋混匀1 min,静置5 min,定容至20 mL,涡旋混匀;以8 500 r/min离心5 min,移取2.0 mL上清液,加入2 mL 5%氨水-乙腈溶液,涡旋混匀;以8 500 r/min离心5 min,取上清液,待净化。
1.3.2样品的净化 将提取液转移至中性Al2O3固相萃取柱,用2 mL 5%氨水-乙腈溶液洗涤固相萃取柱,接收流出液,40 ℃下氮吹至不足0.5 mL;加入乙腈定容至2 mL,再加入2 mL水,涡旋混匀,过0.22 μm滤膜,待测。
1.3.3色谱条件 色谱柱:Agilent Eclipse XDB-C18柱(150 mm×4.6 mm×5 μm);流动相:A为0.15%甲酸溶液,B为乙腈;梯度洗脱程序:0~8.0 min(40%~65%B),8.0~9.0 min(65%~95%B),9.0~14.0 min(95%B),14.0~15.0 min(95%~40%B),15.0~19.0 min(40%B);流速:0~8.0 min(0.4 mL/min),8.0~9.0 min(0.4~0.7 mL/min),9.0~15.0 min(0.7 mL/min),15.0~16.0 min(0.7~0.4 mL/min),16.0~19.0 min(0.4 mL/min);进样量10 μL;柱温25 ℃。
1.3.4质谱条件 电喷雾离子源(ESI),正离子扫描模式;多反应监测模式(MRM);毛细管电压2 500 V;离子源温度130 ℃;干燥气流速16 L/min;鞘气温度250 ℃,流速11 L/min。其他质谱条件列于表1。

表1 各化合物基本信息及质谱测定条件Table 1 Basic informations and optimized mass spectrometric parameters
注:*表示定量离子对
2 结果与讨论
2.1 提取条件的选择
测定蜂王浆中药物残留时通常需要去除蛋白,以降低蛋白质对测定的影响。已有研究表明[26,29],酸性环境下双甲脒易分解。本实验分别考察了1%、3%和5%氨水溶液对样品的提取效果,以及1%、3%和5%氨水-乙腈溶液沉淀蛋白的效果。结果表明,向2 g蜂王浆样品中加入8 mL 5%氨水溶液,提取液pH处于9~10之间,可保持提取液的酸碱度,有助于提高前处理过程中化合物的稳定性。加入5%氨水-乙腈溶液可有效沉淀蜂王浆中蛋白质,同时保持提取液的碱性环境,所以净化固相萃取柱前,向提取液中再加入2 mL 5%氨水-乙腈溶液,可进一步沉淀蛋白质,以减少蛋白质对检测结果的影响。
2.2 净化条件的选择
本实验分别考察了C18、HLB、MCX和中性Al2O3四种固相萃取柱的净化效果。实验添加5 ng标准混合溶液,其中C18和HLB固相萃取柱采用5 mL水上样,5 mL水淋洗,依次用5 mL二氯甲烷、甲醇、乙腈和二氯甲烷-乙腈-甲醇混合液(2∶1∶1,V/V/V)进行洗脱;MCX固相萃取柱采用5 mL酸性水溶液上样,5 mL水淋洗,5 mL 5%氨化甲醇洗脱;中性Al2O3固相萃取柱直接用5 mL 5%氨化乙腈进行洗脱净化,结果示于图2。C18、HLB和MCX固相萃取柱对双甲脒的回收率小于15%,对2,4-二甲基苯胺的回收率低于50%,中性Al2O3固相萃取柱对目标物的回收率均大于70%。因此,选择中性Al2O3固相萃取柱进行样品的净化。
2.3 色谱条件的优化
样品稀释剂对待测物的峰形、分离度和灵敏度有一定的影响,本实验比较了乙腈-0.15%甲酸水溶液(4∶6,V/V)和乙腈-水溶液(1∶1,V/V)作为样品稀释剂对色谱分离效果的影响。结果表明,采用乙腈-0.15%甲酸水溶液(4∶6,V/V)为稀释剂,双甲脒在8 h内几乎完全分解;采用乙腈-水溶液(1∶1,V/V)为稀释剂,各化合物可以在24 h之内稳定存在,且色谱峰峰形良好。故本实验采用乙腈-水溶液(1∶1,V/V)作为样品定容溶液。
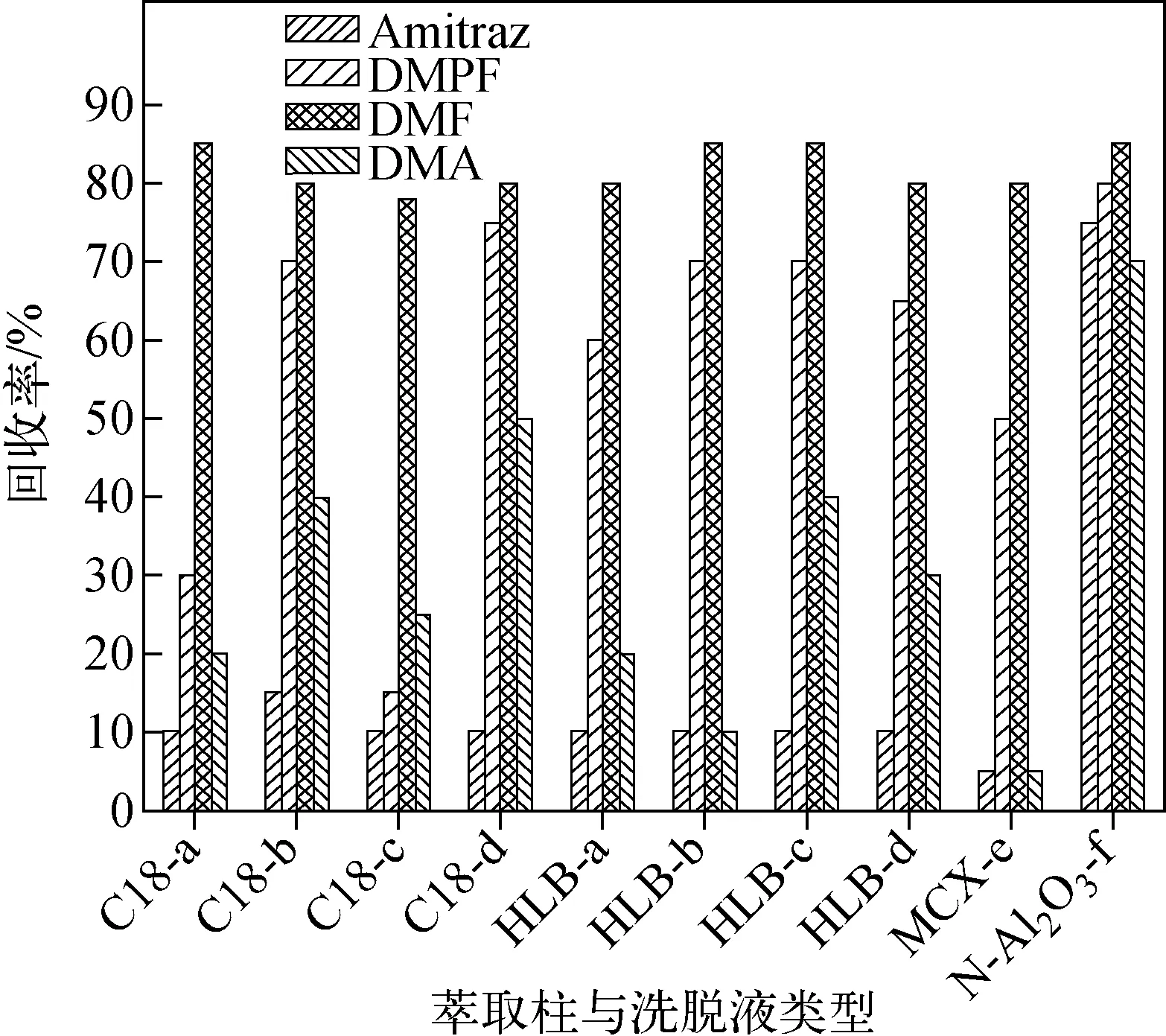
注:a.二氯甲烷;b.甲醇;c.乙腈;d.二氯甲烷-乙腈-甲醇(2∶1∶1,V/V/V);e.5%氨化甲醇溶液;f.5%氨化乙腈溶液图2 使用不同洗脱液,C18、HLB、MCX和N-Al2O3固相萃取柱的净化效果Fig.2 Purification effect of C18, HLB,MCX and N-Al2O3 SPE under different eluent fluid
参考相关文献[26,28],本实验选择C18柱对目标化合物进行分离。选择0.15%甲酸水溶液为流动相的水相,分别考察了甲醇、乙腈为有机相的分离效果。结果表明,采用乙腈-0.15%甲酸溶液为流动相可以实现蜂王浆样品基质干扰峰的良好分离,不影响目标物定量。空白蜂王浆基质加标溶液的检测结果示于图3。
2.4 质谱条件的优化
正离子模式下,采用直接进样方式对1.0 mg/L待测物的标准溶液进行母离子全扫描,以确定分子离子峰,再对其子离子进行全扫描,各化合物的主要子离子及可能的碎片信息示于图4。实验选取信噪比高、峰形好、干扰小的离子对作为定量离子对,以多反应监测正离子模式优化质谱参数,获得的最佳质谱条件列于表1。由于双甲脒容易发生源内裂解生成单甲脒,因此需降低毛细管电压和离子源温度。
3 方法验证
3.1 线性关系和定量限
本实验通过测定混合溶剂标准溶液和空白提取溶液基质加标标准溶液,计算离子抑制率,以评价基质效应[30-31],结果列于表2。可见,单甲脒和2,4-二甲基苯胺的离子抑制率均大于30%,存在明显的抑制效应。实验采用添加同位素内标物和稀释空白蜂王浆提取液配制标准工作曲线溶液的方式减弱基质效应。

图3 空白蜂王浆基质加标溶液检测结果(5.0 μg/kg)Fig.3 Separation results of royal jelly matrix (5.0 μg/kg)
以标准品与同位素内标物峰面积比值y为纵坐标(外标法以谱峰面积为纵坐标),以待测物质量浓度x(μg/kg)为横坐标,绘制各化合物标准溶液工作曲线,结果列于表3,在0~300 μg/kg浓度范围内,线性相关系数R2均大于0.997。蜂王浆样品中双甲脒、单甲脒、2,4-二甲基苯基甲酰胺和2,4-二甲基苯胺的定量限(S/N=10)分别为0.05、0.5、5.0、0.5 μg/kg。
3.2 回收率及精密度
在不含各目标化合物的蜂王浆中进行5、10、100和200 μg/kg浓度水平的添加回收率实验,每个浓度水平取6个平行样,结果列于表3。双甲脒和2,4-二甲基苯胺采用内标法定量,单甲脒和2,4-二甲基苯基甲酰胺采用外标法定量,方法回收率为50.5%~110%,相对标准偏差小于15.0%。
4 阳性样品分析
应用本方法测定12批次不同品牌的蜂王浆样品,未检测到双甲脒及其代谢物,该结果与GB 23200.103—2016检测结果一致。
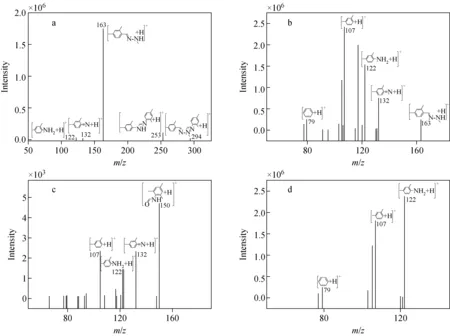
图4 双甲脒(a)、单甲脒(b)、2,4-二甲基苯基甲酰胺(c)和2,4-二甲基苯胺(d)的质谱图和碎片离子结构式Fig.4 Mass spectra and possible fragment ions of amitraz (a), DMPF (b), DMF (c)and DMA (d)

化合物Compound离子对MRMtransition(m/z)溶液浓度Concentration/(μg/L)溶剂线性响应强度Intensity ofsolvent基质加标溶液响应强度Intensity ofblank matrix离子抑制率∗Ration of ionsuppression/%双甲脒294.2/163.20.55040290448487111.0单甲脒163.2/122.20.5133400882627738.12,4-二甲基苯基甲酰胺150.1/107.10.5157411768412.32,4-二甲基苯胺122.1/107.10.569970833420152.2
注:*离子抑制率(%)=(混合溶液中响应强度-空白蜂王浆基质加标溶液响应强度)×100%/混合溶液中响应强度

表3 4种化合物的线性关系和回收率(n=6)Table 3 Results of liner relationships and recoveries (n=6)
5 结论
本研究采用固相萃取-液相色谱-串联质谱法测定蜂王浆中双甲脒、单甲脒、2,4-二甲基苯基甲酰胺和2,4-二甲基苯胺的残留量。蜂王浆经氨水稀释、氨化乙腈沉淀蛋白并提取,中性Al2O3固相萃取柱净化,液相色谱-串联质谱多反应监测正离子模式检测,同位素稀释内标法和外标法定量。该方法简便、快捷,可满足目前国内外相关化合物最大残留限量的检测要求。应用该方法测定了12批次不同品牌的蜂王浆样品,与标准方法测定结果一致。

