UPLC/Q-TOF MS/MS负离子模式下环氧烷型环烯醚萜苷的结构表征
牟德华,胡高爽,李存满
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.河北科技大学,河北省分析测试研究中心,河北 石家庄 050018)
环烯醚萜类化合物是一类分布广泛的重要植物代谢产物,在自然界中一般以苷的形式存在,是许多中药材及其制剂的主要有效成分,具有多种生物活性[1]。从分子结构角度看,环烯醚萜苷含有1个特征的结构骨架,即1个二氢吡喃环顺式连接1个环戊烷类的单元结构,在C1位置上通常连接1个葡萄糖基。根据环烯醚萜苷基本骨架(母核)的结构,可将其分为环戊烯型、环戊烷型、环氧烷型和裂环环烯醚萜苷等同系组分[2]。
近年来,环烯醚萜苷的质谱裂解行为逐渐引起人们关注[3-6],但关于环氧烷型环烯醚萜苷裂解途径探讨的文献[7-8]较少,梓醇是一种研究较多的环氧烷型环烯醚萜苷。卢建秋等[7]利用高效液相色谱(HPLC)-离子阱质谱考察了梓醇在正负离子模式下的裂解途径,发现在负离子模式下,只出现[2M-H]-峰,MS/MS分析只发现了取代基的断裂,未发现其他特征性碎片离子;Nurahmat等[9]利用高效液相色谱-四极杆-飞行时间串联质谱(HPLC-Q-TOF MS/MS)技术对补肾益气方的功能成分进行定性和定量分析,分离鉴定出3个环烯醚萜苷类化合物,其中包括梓醇,获得的质谱碎片离子信息只涉及母环上取代基的断裂;Tao等[10]利用UPLC/Q-TOF MS考察了梓醇在人类肠道菌群作用下的代谢产物,结果表明,正离子模式下代谢产物的质谱信息更丰富;Es-Safi等[8]利用高效液相色谱-三重四极杆质谱(HPLC-QQQ MS)考察了6个环烯醚萜苷(包括3个环氧烷型)的质谱裂解行为,由于四极杆质谱不能给出各化合物的精确质量数,因此,为了确定待测化合物的分子质量,实验选择正、负离子模式同时进行,3个环氧烷型环烯醚萜苷在负离子模式下的质谱信息相对较少,除了发现母环上取代基和葡萄基环的断裂,未发现母环的断裂;Li等[11]在超高效液相色谱-高分辨质谱负离子模式下,从猴面包树果肉中鉴定出6个环烯醚萜苷,包括3个环氧烷型环烯醚萜苷,发现其裂解途径除了母环上取代基的断裂外,还存在母环上半缩醛结构的异构化而造成二氢吡喃环的开裂,这与本课题组考察的环戊烷型和环戊烯型环烯醚萜苷的裂解途径相似[12]。目前,尚未发现针对环氧烷型同系组分的裂解行为进行系统性归纳与总结的报道。
本研究拟应用Q-TOF MS/MS对环氧烷型环烯醚萜苷同系组分(包括胡黄连苷Ⅰ、胡黄连苷Ⅱ、胡麻属苷和梓醇)在大气压化学电离源负离子(APCI-)模式下的质谱裂解行为进行系统性的探讨和归纳,并利用UPLC/Q-TOF-MS/MS对胡黄连提取物中的环烯醚萜苷类化合物进行表征。
1 实验部分
1.1 主要仪器与装置
LC-30A超高效液相色谱仪:日本岛津公司产品;Triple TOF 5600+四极杆-飞行时间质谱联用仪:美国AB Sciex公司产品,配有DouSpray离子源;数据采集软件为AnaLyst®TF 1.6;数据处理软件为Peakview 2.0。
1.2 主要材料与试剂
乙腈:色谱纯,英国Fisher Scientific公司产品;甲酸:色谱纯,美国TEDIA公司产品;梓醇、胡麻属苷、胡黄连苷Ⅰ、胡黄连苷Ⅱ对照品:成都曼思特生物科技有限公司产品,其结构示于图1;胡黄连:购自石家庄神威大药房;实验用水为Milli-Q超纯水。
1.3 实验条件
1.3.1色谱条件 色谱柱:InfinityLab Poroshall120 EC-C18柱(2.1 mm×150 mm×2.7 μm);流动相:A为乙腈,B为0.1%甲酸水溶液;洗脱程序:0~20 min(5%~15%A),20~35 min(15%~40%A),35~40 min(40%A);流速0.40 mL/min;柱温30 ℃;进样体积10 μL。
1.3.2质谱条件 APCI离子源,雾化气压力345 kPa,辅助气压力345 kPa,气帘气压力241 kPa,离子源温度550.0 ℃,喷雾电压5.5 keV,碰撞诱导电压30 V,质量扫描范围m/z50~1 000。
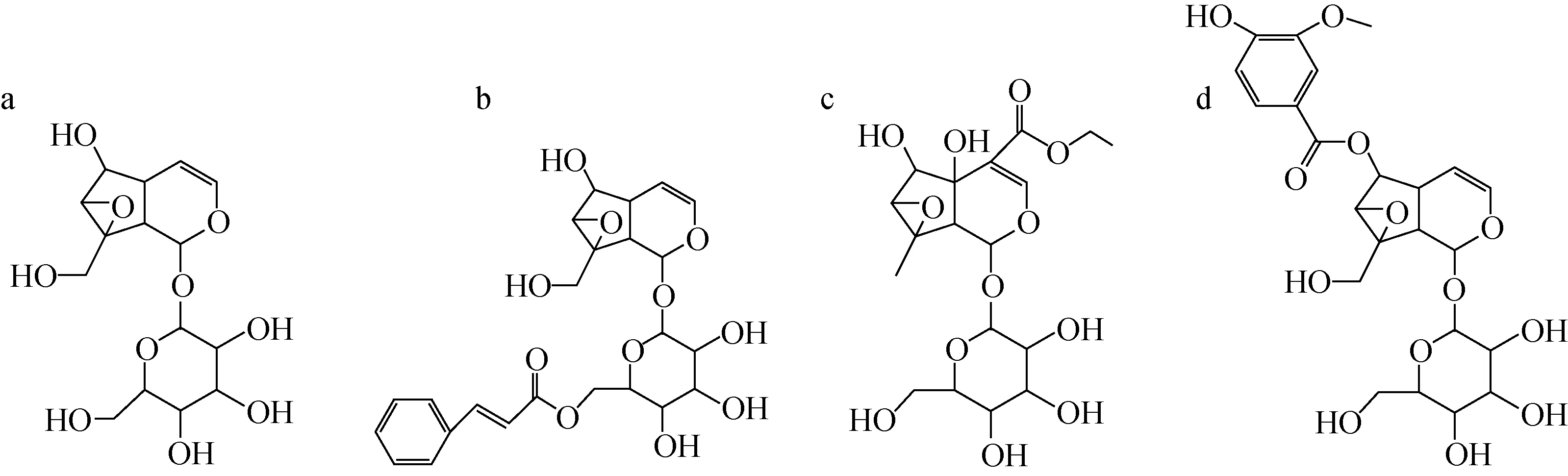
注:a.梓醇;b.胡黄连苷Ⅰ;c.胡麻属苷;d.胡黄连苷Ⅱ图1 环烯醚萜苷4种对照品的结构式Fig.1 Structures of 4 standards of iridoid glucosides
1.4 胡黄连提取物的制备
称取约5.0 g粉碎后的胡黄连药材粉末,利用快速溶剂萃取仪进行提取,提取溶剂为30%乙醇,提取时间5 min,提取温度80 ℃,提取压力10 342 kPa,提取2次。合并提取液,减压浓缩至约5.0 mL,冷却后用水定容至5.0 mL。取2.0 mL提取液上样至预先平衡好的HPD722型大孔树脂柱(10 cm×2 cm)中,静态吸附约15 min,再依次用30 mL水、30%乙醇、50%乙醇、70%乙醇和95%乙醇依次洗脱并收集洗脱液。实验结果表明,环烯醚萜苷主要集中于30%乙醇洗脱液中,因此将该部分作为本实验的分析对象。
1.5 离子命名
环烯醚萜苷骨架断裂产生的诊断性碎片离子的命名沿用本课题组之前对环烯醚萜苷裂解碎片离子的离子命名法进行[12]。其中,i,jF代表从苷元裂解产生的碎片离子,i和j分别表示基本骨架的环上各键之间的断裂;k,lAj、k,lBj、k,lCj代表糖苷部分产生的碎片离子,j是指从苷元处算起,糖苷内部键断裂的数目,k和l是指单糖内部环在不同键之间断裂的情况;Yj和Zj代表包括苷元在内的碎片离子。环烯醚萜苷断裂途径命名示意图示于图2。
2 结果与讨论
2.1 在负离子模式下,环氧烷型环烯醚萜苷对照品的MS分析
在APCI负离子模式下,考察4个环氧烷型环烯醚萜苷对照品的裂解途径。在一级质谱图中,均检测到加合离子[M+HCOO]-以及准分子离子[M-H]-,这与环戊烷型和环戊烯型环烯醚萜苷在流动相加入0.1%甲酸添加剂时的一级MS信息有所不同,对后者而言,只有当C4位为甲酯基或内酯时,该环烯醚萜苷才会出现[M+HCOO]-加合离子[12]。
2.2 在负离子模式下,环氧烷型环烯醚萜苷对照品的MS/MS分析
为进一步探究环氧烷型环烯醚萜苷在负离子模式下的裂解行为,分别以2.1节中4个对照品的[M-H]-为母离子,进行MS/MS分析。根据所生成碎片离子的特点,将上述4个对照品分为2组:第1组包括胡黄连苷Ⅰ和梓醇;第2组包括胡黄连苷Ⅱ和胡麻属苷。
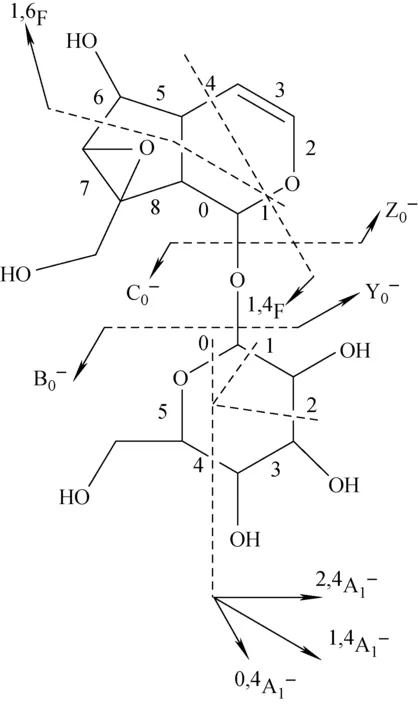
图2 以梓醇为例,环烯醚萜苷在APCI负离子模式下的离子命名示意图Fig.2 Taking catalpol for example, ion nomenclature adopted for fragmentation of iridoid glucoside in APCI- mode
第1组中的胡黄连苷Ⅰ和梓醇的分子结构中苷元部分相同,C6和C8位均有相同的取代基,只是糖基部分不同,示于图1。因此,这2个对照品的质谱裂解途径相似,二者的一级、二级质谱图和梓醇的裂解途径示于图3。根据碎片离子的精确质量数可获得其元素组成,以排除一些碎片离子在定性上的不确定性。由图3e可见,梓醇母环上的取代基断裂丢失葡萄糖基单元,产生m/z199.1[M-H-Glc]-碎片离子,继而丢失1分子H2O和1分子CH2O,生成m/z181.1[M-H-Glc-H2O]-和m/z169.1[M-H-Glc-CH2O]-。同时,发现环烯醚萜苷特征性的母核环上的半缩醛结构异构化,造成二氢吡喃环的断裂,产生碎片离子1,4F-(m/z137.0,127.0),这与环戊烷型和环戊烯型环烯醚萜苷的断裂途径相似[12]。
第2组中胡黄连苷Ⅱ和胡麻属苷的一级、二级质谱图示于图4a~4d,胡麻属苷的裂解途径示于图4e。该组对照品的质谱裂解途径与第1组存在差异,推测其主要原因是第2组对照品的苷元取代基的空间结构较大。由图4e可见,胡麻属苷存在常见的中性丢失,生成m/z401.1[M-H-H2O]-或葡萄糖基m/z257.1[M-H-Glc]-等。另外,还会发生母环半缩醛结构的异构化,形成2个醛基取代基,丢失1分子CO,生成m/z193.0碎片离子,还存在母环结构中C1和C6的断裂,生成1,6F-离子(m/z159.0),进而依次失去1分子CO和1分子H2O而产生m/z131.0和m/z113.0碎片离子。
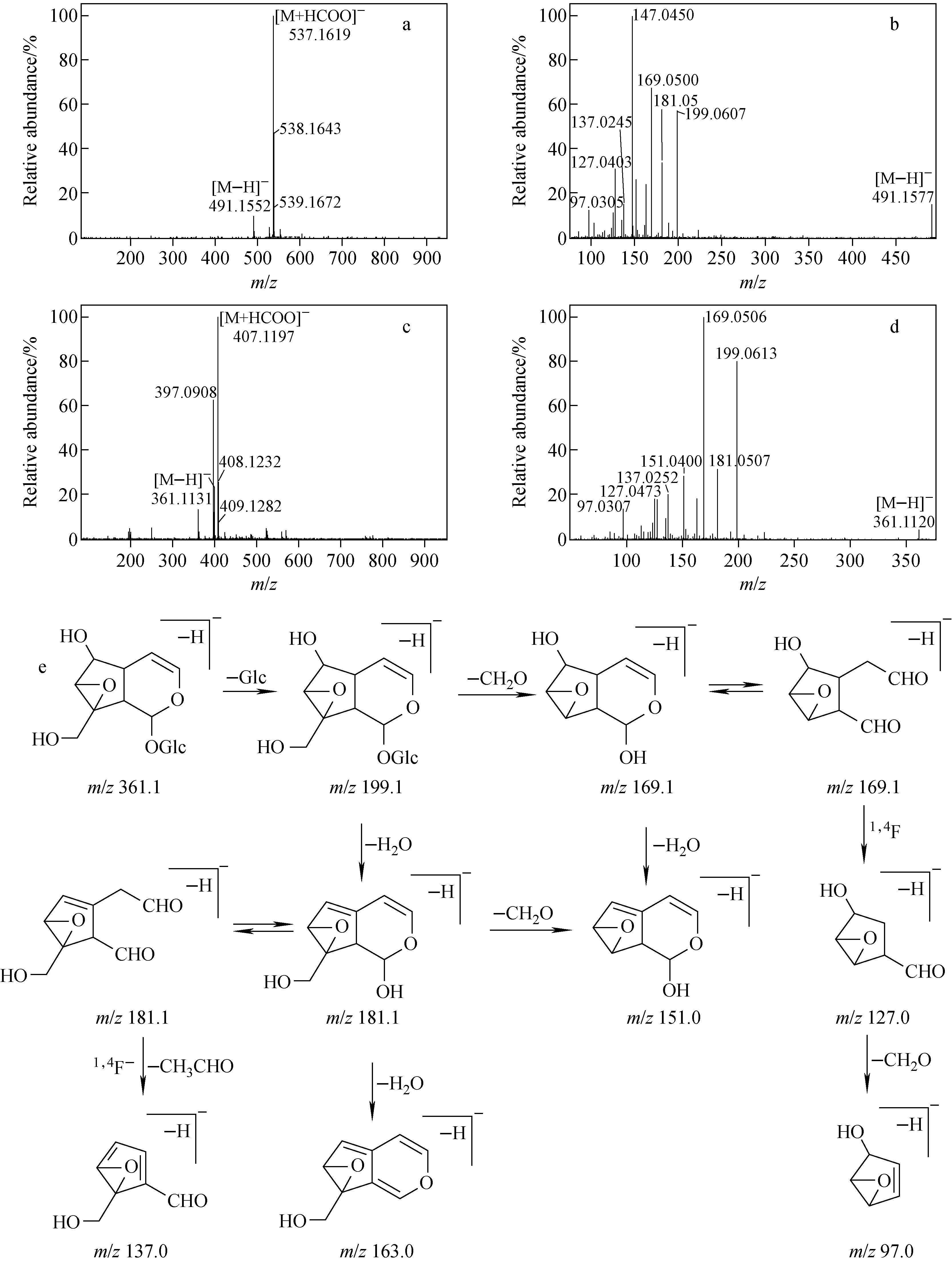
图3 在APCI-模式下,胡黄连苷Ⅰ的Q-TOF MS图(a)和MS/MS图(b),梓醇的MS图(c)、MS/MS图(d)及其裂解途径示意图(e)Fig.3 Q-TOF MS spectrum (a) and MS/MS spectrum (b) of picroside Ⅰ, MS (c), MS/MS (d) and the fragmentation pathway (e) of catalpol in APCI- mode
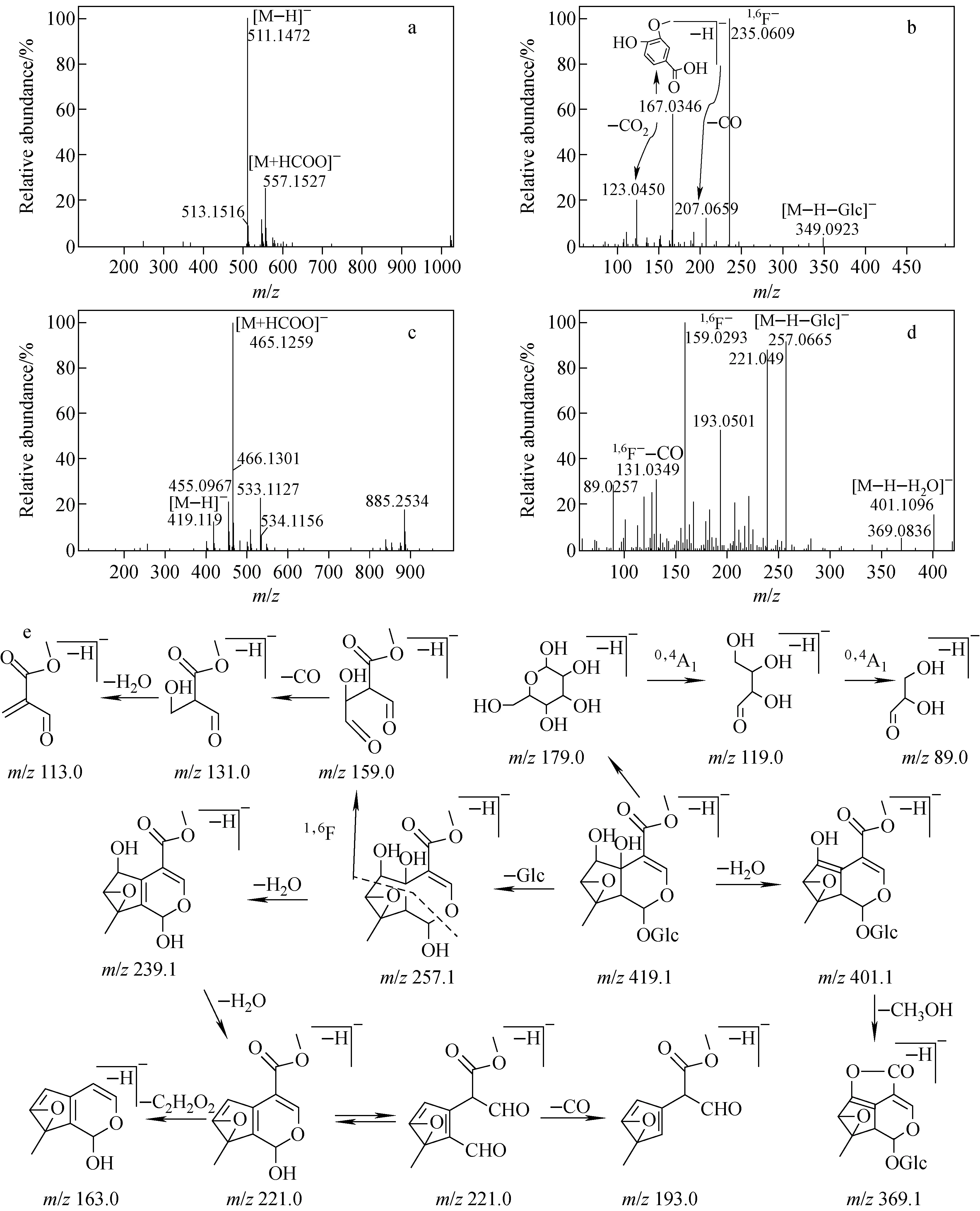
图4 在APCI-模式下,胡黄连苷Ⅱ的Q-TOF MS图(a)和MS/MS图(b),胡麻属苷的MS图(c)、MS/MS图(d)及其裂解途径示意图(e)Fig.4 Q-TOF MS spectrum (a) and MS/MS spectrum (b) of picroside Ⅱ, MS (c), MS/MS (d) and the fragmentation pathway (e) of sesamoside in APCI- mode
综上所述,在APCI-模式下,环氧烷型环烯醚萜苷主要的质谱裂解途径不仅包括常见的母环上取代基的断裂,如丢失H2O、CO2和葡萄糖基等;还有该类同系组分特征的母环断裂,生成1,4F-、1,6F-等特征碎片离子。这是由于环烯醚萜苷骨架上存在1个二氢吡喃环,这种半缩醛结构趋向于异构化,形成2个醛基取代基,从而造成二氢吡喃环的断裂,生成1,4F-离子;而1,6F-碎片离子的生成与环戊烷型及环戊烯型环烯醚萜苷断裂生成2,6F-和2,7F-离子[12]的规律不同,可能是由于该类同系组分结构中存在环氧烷造成的。同时,该类同系组分还存在葡萄糖基环的断裂,生成0,4A1-、1,4A1-及2,4A1-等碎片离子。在APCI+模式下,环氧烷型环烯醚萜苷一级质谱中主要出现准分子离子[M+H]+以及加合离子峰[M+Na]+、[M+H2O]+、[M+K]+等;二级质谱中,除了失去葡萄糖基、H2O或CH3OH等,特征性碎片离子相对较少(另文发表)。环氧烷型环烯醚萜苷在APCI-模式下的MS/MS碎片离子信息较APCI+模式丰富,碎片离子特征性更强。
2.3 胡黄连提取物的MS及MS/MS分析
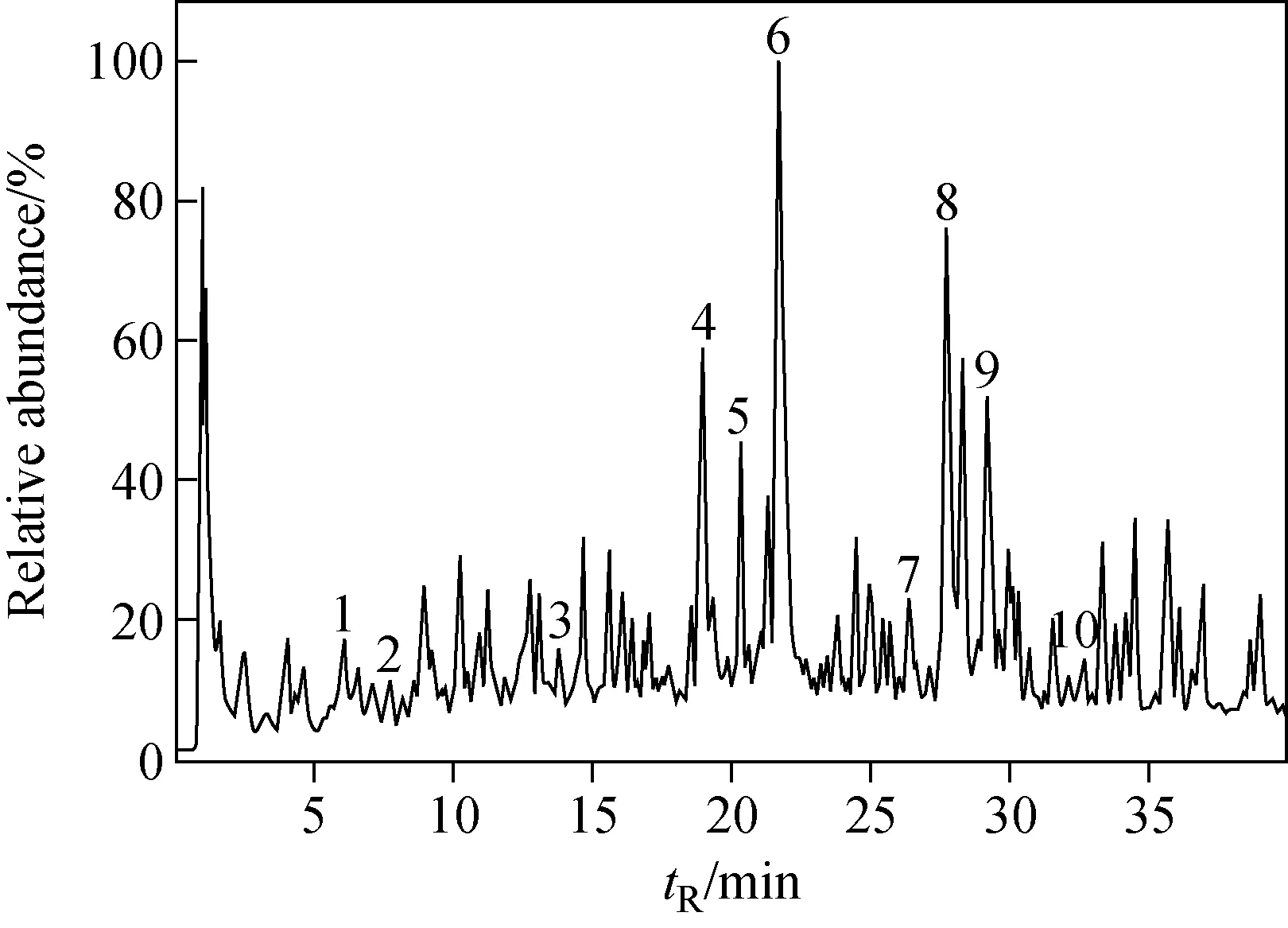
图5 负离子模式下,胡黄连提取物的总离子流图Fig.5 Total ion chromatogram of extract of Picrorhiza scrophulariiflora Pennell in APCI- mode
利用UPLC/Q-TOF MS和MS/MS对胡黄连提取物中环烯醚萜类化合物进行表征。该提取物在负离子模式下的总离子流图示于图5。从胡黄连提取物中共鉴定出10个环烯醚萜苷,其主要的质谱信息列于表1。通过比对峰6、8与对照品的保留时间(tR)以及质谱信息,确定二者分别为胡黄连苷Ⅱ和胡黄连苷Ⅰ;推测另外8个化合物依次为Boschnaloside、Mussaenosidic acid、梓苷、Piscroside B、胡黄连苷Ⅲ、黄金树苷、胡黄连苷Ⅳ、婆婆纳苷,它们二级质谱图及分子结构式示于图6。
峰1的准分子离子[M-H]-为m/z343.104 2[C16H23O8]-。在[M-H]-的二级质谱中,出现碎片离子C0-(m/z179.1)、0,4A1-(m/z119.0)、1,4A1-(m/z89.0)和2,4A1-(m/z59.0),表明峰1化合物的苷元部分连接1个葡萄糖基团[12]。碎片离子m/z181.1[M-H-Glc]-对应苷元部分,2,7F0-(m/z85.0)和2,6F0-(m/z101.0)特征离子的出现[12]表明该化合物为环戊烷型环烯醚萜苷。因此,推测峰1为Boschnaoside,该化合物曾在胡黄连中发现[13]。
在峰2的一级质谱图中,只发现准分子离子峰[M-H]-(m/z375.128 8,C16H23O10)。以[M-H]-为母离子,在其二级质谱图中,碎片离子m/z213.1是由中性丢失1分子葡萄糖基([M-H-Glc]-)生成的,基峰碎片离子m/z169.1对应[M-H-Glc-CO2]-,表明苷元部分含有1个羧基取代基。另外,还出现1,4F-(m/z125.1)和2,7F0-(m/z101.0)特征离子,表明C8位可能连接1个CH2OH或1个OH和1个CH3。由于碎片离子m/z107.0可能是由1,4F-(m/z125.1)进一步丢失1分子H2O生成的,因此,C8位可能连接1个OH和1个CH3。碎片离子m/z113.0是2,7F-特征离子,由此推测C6位无取代基。综上,推测峰2为Mussaenosidic acid,该化合物曾于胡黄连中发现[13]。在峰2化合物的一级质谱图中未发现加合分子离子[M+HCOO]-,这与文献[12]报道的当C4位取代基不是甲酯基或内酯时,该环烯醚萜苷只形成[M-H]-,而不形成加合离子的结论一致。
峰3的一级质谱图中同时出现准分子离子[M-H]-(m/z481.137 6,C22H25O12)和加合离子峰[M+HCOO]-(m/z527.167 6,C23H27O14),因此,较容易确定该化合物的分子质量及分子式。以[M-H]-为母离子的MS/MS图中,碎片离子m/z319.1是由母环上丢失1分子葡萄糖基生成,基峰碎片离子m/z205.1是环氧烷型环烯醚萜C1和C6断裂产生的1,6F-特征离子,碎片离子m/z137.0是丢失苷元上的对羟基苯甲酸(p-HBA)生成。因此,推测峰3为梓苷,该化合物也曾在胡黄连中发现[13]。
在峰4的一级质谱图中,出现准分子离子m/z507.2([M-H]-)、加合分子离子峰m/z553.154 1([M+HCOO]-)和二聚体分子离子峰m/z1 015.3([2M-H]-),依据精确分子质量确定峰4分子式为C24H28O12,分子质量为508.2。

表1 UPLC/Q-TOF MS检测到的胡黄连提取物中的环烯醚萜苷信息Table 1 Information of IGs detected by UPLC/Q-TOF MS from the extract of P. scrophulariiflora Pennell
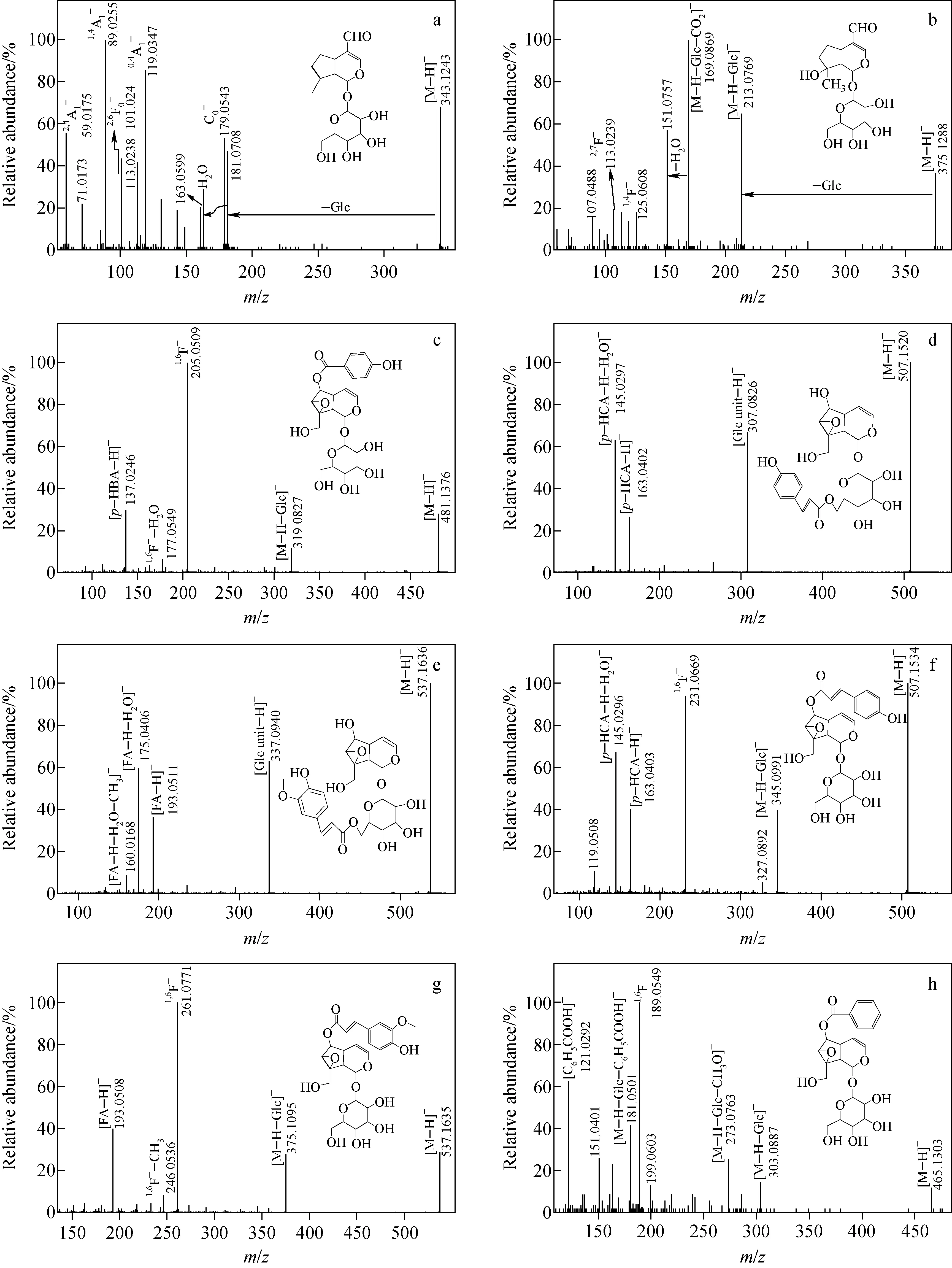
图6 峰1(a),2(b),3(c),4(d),5(e),7(f),9(g),10(h)的准分子离子峰[M-H]-二级质谱图及化合物结构式Fig.6 MS/MS spectra of the [M-H]- ions of peak 1(a), 2(b), 3(c), 4(d), 5(e), 7(f), 9(g), 10(h) and their structures
以[M-H]-(m/z507.2)为母离子的MS/MS图中,碎片离子m/z307.1是由母环丢失1分子葡萄糖基(葡萄糖基上带有1分子肉桂酸基团)生成的,碎片离子m/z163.0是糖基上丢失的1分子对羟基肉桂酸(p-HCA)取代基;m/z145.0可能是由p-HCA继续丢失1分子H2O生成的。综上,推测峰4为环氧烷型环烯醚萜苷Piscroside B,该化合物曾在胡黄连中发现[13-14]。
在峰5的一级质谱图中,出现准分子离子[M-H]-(m/z537.163 6,C25H29O13)和[M+HCOO]-(m/z583.164 9,C26H31O15)。在[M-H]-的MS/MS图中,碎片离子m/z337.1是葡萄糖基(葡萄糖基上带有1分子阿魏酸基团FA),碎片离子m/z193.1、175.0和160.0分别是[FA-H]-、[FA-H-H2O]-和[FA-H-H2O-CH3]-。因此,推测峰5为胡黄连苷Ⅲ。
峰7的准分子离子为[M-H]-(m/z507.153 4,C24H27O12),据此推测其与峰4互为同分异构体。在MS/MS图中,碎片离子m/z345.1是苷元丢失1分子葡萄糖基而产生的,基峰碎片离子m/z231.1是环氧烷型环烯醚萜苷特征离子1,6F-。此外,碎片离子m/z163.0的存在进一步确认峰7化合物含有1对羟基肉桂酸取代基。峰7的质谱裂解碎片信息与化合物黄金树苷一致,该化合物曾在胡黄连中发现[13-14],因此,推测峰7为黄金树苷。
峰9的准分子离子为[M-H]-(m/z537.163 5,C25H29O13),与峰5互为同分异构体。基峰碎片离子m/z261.077 1对应1,6F-特征离子,碎片离子m/z375.1是由母离子丢失苷元连接的葡萄糖基生成的;m/z193.1表明苷元上连接有1个阿魏酸(FA)取代基。因此,推测峰9为胡黄连苷Ⅳ。
峰10的保留时间为32.7 min。在一级质谱图中,出现准分子离子峰[M-H]-(m/z465.130 36,C22H25O11)和加合分子离子峰[M+HCOO]-(基峰,m/z511.145 9,C23H27O13),表明该化合物的分子质量为466.1。以[M-H]-(m/z465.130 3)为母离子进行MS/MS分析,出现碎片离子m/z303.1,推测该化合物失去1个葡萄糖基,继而失去1分子苯甲酸,生成碎片离子m/z181.1([M-H-Glc-C6H5COOH]-);碎片离子m/z121.0对应苯甲酸基[C6H5COO]-。作为基峰的碎片离子m/z189.1,对应环氧烷型环烯醚萜苷的特征离子1,6F-。因此,推测峰10为已在胡黄连中发现的环氧烷型环烯醚萜苷婆婆纳苷[13-14]。
3 结论
本研究利用Q-TOF MS/MS系统考察了4种环氧烷型环烯醚萜苷同系组分的质谱裂解规律。在APCI-模式下,环氧烷型环烯醚萜苷主要的质谱裂解途径除了常见的母环上取代基的断裂外(如丢失H2O、CO2和葡萄糖基等),还有该类同系组分特征的母环断裂,生成1,4F-、1,6F-等特征碎片离子。同时,该类同系组分还存在葡萄糖基环的断裂,生成0,4A1-、1,4A1-和2,4A1-等碎片离子。在此基础上,利用UPLC/Q-TOF MS/MS对胡黄连提取物中的环烯醚萜苷类化合物进行表征,结合本课题组先前的工作[12],共鉴定出10个环烯醚萜苷。实验结果表明,在APCI-模式下,环烯醚萜苷的质谱裂解途径与ESI-模式下的裂解途径相似,没有明显差异。该研究有助于推动胡黄连在物质基础表征、质量控制和临床应用上的开发和利用。

