质谱鸟枪法非靶向快速初筛青鱼中微囊藻毒素残留
崔益玮,林亚楠,李诗言,戴志远,3,王 扬,沈 清,3
(1.浙江工商大学海洋食品研究院,浙江 杭州 310012;2.浙江省水产质量检测中心,浙江 杭州 310023;3.浙江省水产品加工技术研究联合重点实验室,浙江 杭州 310012)
青鱼(Mylopharyngodonpiceus)又称黑鲩、乌鲭,是长江中下游和沿江湖泊的重要渔业资源[1],具有肉质细嫩、味道鲜美、饲料系数低、生长速度快等诸多特点,一直深受广大消费者的青睐[2]。近年来,由于环境、饲料等因素导致的青鱼病害问题不断发生,尤其是水体富营养化污染容易急性大范围暴发,造成青鱼大规模死亡,带来巨大的经济损失。
微囊藻毒素(microcystins, MCs)是一类由水体富营养化引起的蓝藻水华产生的肝脏毒素,具有较大的毒害性[3]。MCs具有单环七肽分子结构,为环-(D-丙氨酸-L-R1-赤-β-甲基-D-异天冬氨酸-L-R2-Adda-D-异谷氨酸-N-甲基脱氢丙氨酸),其中R1和R2在不同的MC异构体中代表不同的L-氨基酸,并以此命名该毒素[4]。MCs异构体种类多,且性质稳定,煮沸后不失活,耐酸碱变化。MCs进入肝细胞后,甲基脱氢丙氨酸(methyldehydroalanine, Mdha)的不饱和羧基可与C亚基活性位点的半胱氨酸的巯基共价连接形成蛋白加合物,从而抑制蛋白磷酸酶2A(protein phosphatase2A, PP2A)的活性[5]。其中,微囊藻毒素LR(MC-LR)是公认的肝毒素和促癌剂,目前已知的生理毒性仅次于二噁英[6]。MCs主要通过饮用水和被污染的水产品(鱼虾、软体动物及藻类制品等)进入人体,严重威胁人类健康,世界卫生组织设定临时可耐受的每日摄取量为0.04 μg/(kg·d)[7]。
MCs常用的检测手段主要包括小鼠腹腔注射生物分析法、化学分析法、酶联免疫法、蛋白磷酸酶抑制法等[8-10]。Kaya等[11]将MCs氧化生成2-甲基-3-甲氧基-4-苯基丁酸(MMPB),经甲酯化衍生后用气相色谱-质谱(GC/MS)测定MCs总含量。郭坚等[12]采用固相萃取-液相色谱/紫外检测法(SPE-HPLC/DAD)测定水体、土壤等样品中的MCs。近年来,因液相色谱-串联质谱技术(HPLC-MS/MS)既可以准确定量,又能够提供化合物的结构信息,被广泛用于食品中兽药残留等污染物的检测分析[13-15]。但上述方法普遍存在操作复杂,且无法实现不同种类MCs分析鉴定等缺点。“鸟枪法”是在电喷雾电离质谱技术基础上改进后,利用源内分离原理,创立的无需色谱分离就可直接分析的质谱技术。这不仅可以避免液相色谱法中经常存在的样品残留问题,还简化了操作步骤,且能够同时检测多种MCs。
本研究针对MCs的分子结构特征,通过优化前处理及检测条件,以MCs的共有特征官能团为线索,拟建立一种基于串联质谱技术的鸟枪法非靶向快速筛查青鱼中MCs,希望为开展青鱼中MCs污染研究提供技术支持。
1 实验部分
1.1 仪器与装置
1200高效液相色谱系统:美国Agilent公司产品;4000Qtrap串联飞行时间质谱仪:美国AB Sciex公司产品,配有Harvard Pump11恒流注射泵、电喷雾离子源(ESI)及Analyst1.5数据处理系统;高速冷冻离心机:美国Thermo Scientific公司产品;MDF-382E超低温冰箱:日本Sanyo公司产品;Milliplus 2150超纯水处理系统:美国Millipore公司产品。
1.2 材料与试剂
鲜活青鱼样品:购自杭州本地市场,经鉴定为青鱼(Mylopharyngodonpiceus);微囊藻毒素RR(MC-RR)、YR(MC-YR)、LR(MC-LR)、LA(MC-LA)、LF(MC-LF)、LY(MC-LY)及LW(MC-LW)标准品(纯度>95.0%):中国台湾Algal Science公司产品;Oasis HLB固相萃取柱:美国Waters公司产品;甲醇、乙腈和甲酸:均为色谱纯,德国Merck公司产品;纯净水:由Milli-Q超纯水处理系统制得;其他试剂均为分析纯。
1.3 实验条件
1.3.1样品处理 新鲜青鱼经去鳞、去头、去内脏后取背部和胸部肌肉,切成小块,剔除明显骨刺;组织肌肉经斩拌成鱼糜后,置于4 ℃冰箱冷藏,备用。
各取0.01 g MCs标准品,甲醇溶解,定容至10 mL棕色容量瓶,制得1.0 g/L的MCs标准品溶液,于4~6 ℃冷藏,备用。
1.3.2MCs提取 取1 g青鱼肌肉组织肉糜于15 mL离心管中,加入5 mL乙醇-水-甲酸萃取液(90∶9.9∶0.1,V/V/V),剧烈振荡20 min,随后用探头式超声(25 kHz,60%变幅)辅助提取10 min,混合物在4 ℃下以8 000 r/min冷冻离心15 min。用移液枪转移离心管中上清液至新移液管,并继续向沉淀中加入5 mL萃取液,重复上述操作,提取2次。合并3次提取的上清液,氮气吹干,用甲醇-水溶液(90∶10,V/V)复溶至1 mL。
依次用6 mL甲醇和水活化Oasis HLB固相萃取柱。萃取液均匀上样,并依次用6 mL超纯水和乙醇-水淋洗液(5∶95,V/V)淋洗,弃去淋洗液,用5 mL纯甲醇洗脱吸附在HLB柱上的MCs,控制流速约为1滴/秒,收集洗脱液。氮气吹干,用甲醇复溶至1 mL,过0.22 μm有机滤膜,待质谱分析。
1.3.3质谱条件 注射泵进样流速10 μL/min;质量扫描范围m/z400~1 200;电喷雾离子源(ESI),正离子模式;Q1全扫描和母离子扫描(precursor ion scan, PreIS)模式,特征碎片离子m/z135.2;喷雾电压5.5 kV;干燥温度550 ℃;源内碰撞诱导解离气为氮气。具体质谱参数列于表1。
1.3.4数据处理和统计分析 采用Analyst QS v2.0软件进行数据采集与分析,用Excel对MCs提取中6组平行数据进行标准差分析,并用Origin软件作图。
2 结果与讨论
2.1 固相萃取优化
由于青鱼组织样品的基质较复杂,选取合适填料的固相萃取柱对降低基质效应和提高MCs回收率至关重要。实验比较了Florisil柱(10 mm×1 mm)、HLB柱(10 mm×1 mm)和C18柱(10 mm×1 mm)的富集、净化效果,结果示于图1。由图可见,HLB对MCs的回收率最高(68.2%~83.4%),其次为C18(63.5%~78.5%),而Florisil对MCs的固相萃取效果不佳,回收率仅为60%左右。HLB柱的吸附剂是由亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合而成的大孔共聚物,对极性污染物的富集效率高,且具有相对较高的容量因子[16]。考虑到样品中MC种类多且复杂,实验选用HLB固相萃取柱富集净化样品中MCs。

表1 5种MCs质谱参数Table 1 Mass spectrometry parameters of MC species

图1 不同固相萃取填料对MCs回收率的影响Fig.1 Effect of sorbent types on the recovery of MCs
青鱼组织样品基质较复杂,在洗脱MCs前有必要对SPE柱进行淋洗,通常是在淋洗液中加入一定比例的甲醇或乙腈以去除色素等干扰物质,但会造成目标化合物一定程度的损失。本实验分别用2%、5%、10%和15%的甲醇-水溶液淋洗SPE固定相。结果发现,5%甲醇会造成MCs流失,且流失程度随甲醇比例的提高而增加,因此选用2%甲醇-水溶液作为淋洗液。本实验还考察了80%、90%和纯甲醇作为洗脱液的洗脱效果。实验发现,80%甲醇作为洗脱液时,MCs回收率较低,无法将吸附在HLB填料上的MCs解吸完全;而用纯甲醇作为洗脱液时,会同时洗脱一些杂质,造成质谱峰干扰。因此,选用90%甲醇作为洗脱液。
2.2 质谱条件的优化
将MCs母液稀释100倍得到10 mg/L的工作液,通过直接进样的方式优化母离子和子离子参数。由于MC是一类环肽化合物,且ESI离子源是一种软电离方式,因此MCs会同时形成+1价、+2价离子以及其他钠、钾等加合离子。在Q1全扫描模式下,化合物质谱峰主要集中在低分子质量段(m/z450~550),MCs母离子以双电荷母离子[M+2H]2+为主,其中信号响应最强的为m/z520.3([RR+2H]2+),其次为m/z523.8([YR+2H]2+)。将高分子质量段窗口放大后,可观察到MCs的单电荷母离子,如m/z996.1([LR+H]+)、m/z1 024.9([LW+H]+)以及m/z1 046.0([YR+H]+)等,但其信号响应强度比双电荷母离子小2个数量级,示于图2。因此,本实验选取双电荷母离子[M+2H]2+为主要研究对象。
在子离子扫描(product-ion scan, PIS)模式下分析各个MC的裂解规律与碎片特征。以MC-RR为例,选取m/z520.3([RR+2H]2+)为母离子进行碰撞诱导解离,通过编辑Ramp观察碰撞电压(CE)动态变化过程中的碎片特征。结果发现,在不同CE下,MC-RR的典型碎片峰包括m/z375、213和135等,其中m/z135为MC的共有基团Adda的甲氧键断裂形成的特征碎片峰([C9H11O+H]+),示于图3a;m/z213是基团D-Glu断裂形成的特征碎片峰([C9H14O4N2+H]+);m/z375为([C11H15O+Glu+Mdha+H]+)。这3种离子为大部分MC共有结构的特征碎片,本实验所检测的5种MCs子离子谱图中均产生这3种特征碎片峰。通过优化CE能量,在各个碎片峰最优能量下,m/z135信号强度最大,达3.5×107。因此,本实验选择m/z135为MCs的特征碎片进行PreIS扫描。

图2 Q1全扫描模式下,MCs的质谱图Fig.2 Mass spectrum of MCs under Q1 full scan

图3 MC-RR的二级质谱图(a)和以m/z 135.2为特征碎片的母离子扫描图(b)Fig.3 MS2 mass spectrum of MC-RR (a) and precursor ion scan of m/z 135.2 (b)
使用MC-RR标准工作液直接进样,以m/z135为特征碎片进行PreIS扫描,示于图3b。可见,质谱图较为纯净,m/z520.2[RR+2H]2+为信号响应最强峰,除此之外,也可观察到少量的m/z531.3[RR+H+Na]2+和m/z542.2[RR+2Na]2+;在m/z1 039.0处未检测到单电荷离子峰[RR+H]+。MC-YR、MC-LR、MC-LF和MC-LW的质谱碎裂特征与RR相似。使用5种MCs混合标准工作液直接进样后的结果示于图4。虽然进样浓度相同,但是各个MC的离子化效率不同,导致信号响应强度差异较大,MC-YR和MC-LR较容易离子化,因此离子峰强度相对较高,达到了2.5×105,而MC-RR、MC-LF和MC-LW信号相对较弱。该结果进一步验证了MCs离子化后更倾向于生成双电荷离子,以m/z135为特征碎片离子的PreIS扫描几乎不产生单电荷[MCs+H]+。

图4 母离子扫描模式下5种MCs质谱图Fig.4 Mass spectrum of MC species using precursor ion scan mode
2.3 基质对方法线性的影响
MCs鸟枪法没有将样品经色谱分离即直接进样,因此混合物成分较复杂。基质效应主要来自两方面:1) 样品中的杂质分子会对MCs的离子化产生干扰;2) 不同种类MCs之间存在离子化竞争效应,会影响信号的强度和稳定性[17]。通常以基质对目标化合物回收率的增强和减弱效应评价基质效应的影响。本实验采用实际样品基质加入混合标准品的方法同时建立5种MCs标准曲线,通过标准曲线的线性关系间接反映基质效应的影响,结果列于表2。可见,在线性范围内,各个MC的相关系数R2介于0.992 5~0.997 1之间,各个数据点的基质效应在拟合标准曲线的过程中部分抵消,线性关系良好,能够满足一般分析测试需求。
2.4 方法学验证
采用标准添加法测定方法灵敏度,根据3倍和10倍信噪比(S/N)确定MCs的方法检出限(LOD)和定量限(LOQ),结果列于表2。可知,该方法的灵敏度较高,检出限和定量限分别不大于 1.25 μg/L和3.99 μg/L,能够满足MCs高灵敏度检测的要求。在空白青鱼样品中添加MCs标准品工作溶液,制成100、200 μg/L的加标样品,按1.3节方法进行精密度和回收率实验,每个添加水平做6次平行测定,结果列于表3。可知,MCs的日内精密度和日间精密度的相对标准偏差分别为6.8%~8.6%和7.2%~9.1%,说明该方法的重现性较好;回收率为68.2%~83.4%,RSD为4.5%~6.8%,能够满足一般分析测试的要求。

表2 鸟枪法非靶向快速筛查MCs的线性和灵敏度Table 2 Linearity and sensitivity of shotgun untargeted screening of MCs using mass spectrometry
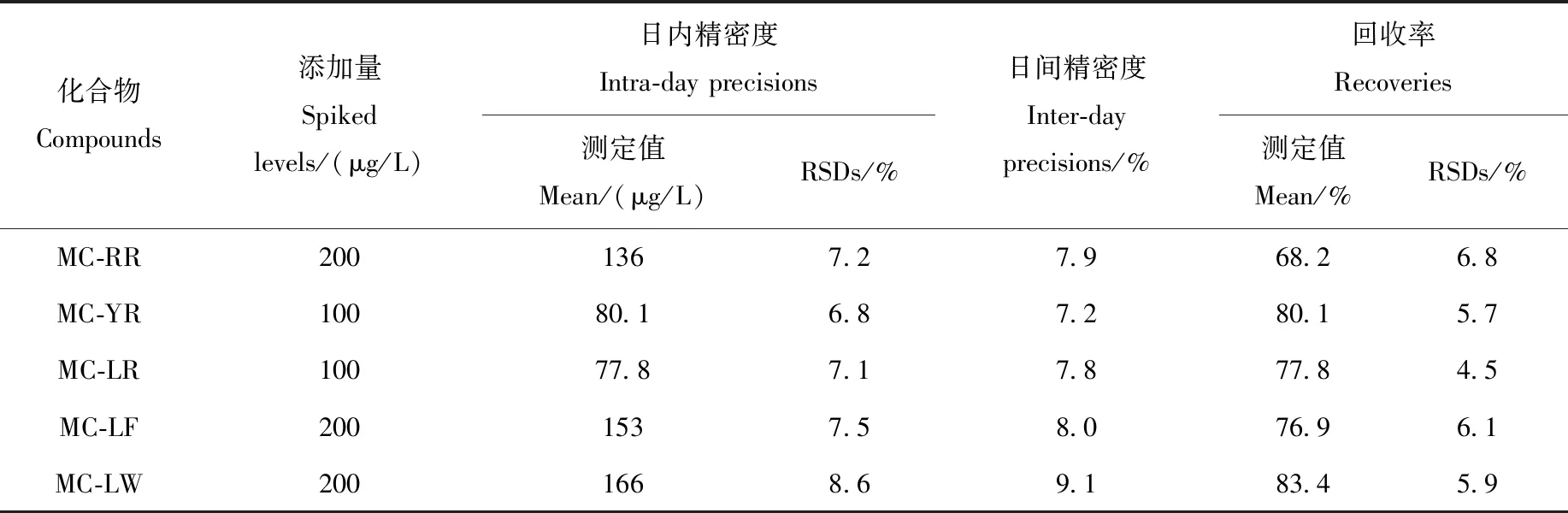
表3 鸟枪法非靶向快速筛查MCs的灵敏度、精密度和回收率Table 3 Sensitivity, accuracy and recovery of shotgun untargeted screening of MCs using mass spectrometry
2.5 样品检测
为了解市场上青鱼中MCs污染情况,采用建立的质谱鸟枪法快速初筛市售20个青鱼样品,并对结果进行数理统计分析。结果发现,20个青鱼样品中,共计3个样品检出MCs为阳性,检出率为15%,主要检出的MCs种类为MC-RR和MC-LR,MCs总浓度为3.4~15.8 μg/kg,其余样品均未检出MCs。青鱼喜好以螺蛳等贝类为食,而螺蛳常以泥土中的微生物和腐殖质、水中浮游植物、幼嫩水生植物、青苔等为食,因此MCs较容易通过食物链富集到青鱼体内。
3 结论
本研究建立了一种鸟枪法非靶向快速筛查青鱼中MCs残留。该方法在准确度、回收率等方面略逊于常规的LC-MS/MS MRM模式,但鸟枪法的检测速度极快,可靠性和线性基本满足要求,尤其适合在待检样品数量巨大的情况下快速初步筛查MCs阳性样品,然后通过HPLC-MS/MS对阳性样品进行准确定量,可显著提高工作效率,提高检测通量。

