UHPLC-LTQ-Orbitrap质谱法鉴定染料木素在大鼠体内的代谢产物
赵文靖,梁耀月,王子健,侯君钊,张连中,王志斌,张加余
(1.北京中医药大学中药学院,北京 100102;2.北京中医药大学,北京中医药研究院,北京 100029;3.中国合格评定国家认可中心,北京 100062;4.北京鸿测科技发展有限公司,北京 100176)
染料木素(Genistein, GS),又称5,7,4’-三羟基异黄酮、染料木苷元、金雀异黄素、染料木黄酮,存在于多种可食性植物中,尤其在葛根、苜蓿、燕麦、槐角、小麦、大麦和广豆根中含量较高[1-2]。染料木素作为一种活性功能较高的天然酪氨酸激酶,具有与雌激素相似的结构,因此被称为“植物雌激素”[3-4]。近年来研究发现,染料木素还具有抗氧化[5]、降血脂[6]、抗肿瘤[7]和防治骨质疏松[8]等活性,现已广泛应用于医药、保健品等领域。染料木素在体内可能生成脂肪酸酯化产物[9],但并未见其体内代谢过程的报道[10]。
液相色谱-质谱联用技术(LC-MS)结合了色谱的分离能力和质谱的高灵敏度、高专属性的检测能力,已成为中药化学成分结构鉴定的手段之一[11-13]。其中,离子阱-静电轨道场的联用质谱(LTQ-Obitrap-HR-MS)兼有高分辨率、高质量精度等优点,可用于复杂物质体系中化学成分及体内代谢产物的快速分析[14-16]。SPE技术可从样品中纯化、浓缩微量成分或其代谢产物,目前已广泛应用于生物样品的前处理中。此方法解决了体内样品成分复杂、干扰物质多、待测药物浓度低等影响药物分析的问题,从而获得体内样品成分分析的高灵敏度和低检测限[17]。
本研究拟采用UHPLC-LTQ-Orbitrap MS技术分析染料木素体内代谢产物,希望为阐明染料木素药效物质基础提供科学依据。
1 实验部分
1.1 主要仪器与装置
Thermo Fisher DIONEX Ultimate 3000超高效液相色谱仪和LTQ-Orbitrap XL线性离子阱-静电场轨道阱质谱仪器:美国Thermo Fisher公司产品,配有电喷雾离子源(ESI),Xcalibur 2.1工作站;R200D型电子分析天平(1/10万):德国Sartorius公司产品;Milli-Q Synthesis超纯水纯化系统:美国Millipore公司产品;KQ-250DE型数控超声波清洗器:昆山市超声仪器有限公司产品;Grace PureTMSPE C18-Low固相萃取小柱(500 mg/3 mL):美国Grace Davison Discovery Science公司产品。
1.2 主要材料与试剂
染料木素、染料木苷、大豆苷元、大豆苷的对照品:成都曼思特生物科技有限公司产品,经HPLC面积归一化法,测定其纯度均大于98%;乙腈、甲醇:质谱级,美国Thermo Fisher公司产品;甲酸:色谱级,德国Merck公司产品;分析用水:Millipore超纯水;其他试剂均为分析纯。
1.3 实验条件
1.3.1色谱条件 色谱柱Acquity UPLC BEH C18柱(2.1 mm×100 mm×1.7 μm);柱温40 ℃;流动相:A为0.1%甲酸水溶液,B为乙腈;梯度洗脱:0~2 min(5%~20%B),2~27 min(20%~85%B),27~30 min(85%B),30~32 min(85%~5%B),32~35 min(5%B);流速0.30 mL/min;进样量3 μL。
1.3.2质谱条件 电喷雾离子源(ESI),负离子检测模式,毛细管温度350 ℃,鞘气流速30 L/h位,辅助气流速10 L/h,喷雾电压3 kV,毛细管电压-35 V,管透镜电压-110 V。样品采用高分辨傅里叶扫描,分辨率30 000,质量扫描范围m/z50~800,隔离宽度2 u;二级和三级质谱采用数据依赖性扫描(data dependent scan, DDS),选取上一级丰度最高的2个峰进行碰撞诱导解离(CID)碎片离子扫描,激活能量单位0.25 q,激活时间30 ms,归一化碰撞能量为40%。
1.4 动物分组与实验
12只SD大鼠(雄性,体重220~250 g,许可证号为SCXK(京)2012-0001):购自北京维通利华实验动物技术有限公司。SD大鼠随机平均分为空白组和染料木素给药组,实验前适应性饲养3天(室温22~26 ℃,湿度40%~70%,12 h昼夜更替),受试前禁食12 h,全程不禁水。
给药剂量:给药组按200 mg/kg剂量给予CMC-Na混悬液;空白组大鼠灌胃等体积0.5%CMC-Na溶液。
1.5 生物样品采集与处理
1.5.1生物样品采集 空白组和给药组大鼠灌胃后,立即置于代谢笼中开始计时,分别在0.5、1.0、1.5、2.0、4.0 h于眼眶静脉丛下取约0.5 mL静脉血,置于含肝素钠抗凝EP管中;缓慢上下颠倒混匀,静置15 min,于4 ℃以3 000 r/min离心15 min,合并同组上述5个时间点的血浆,即得空白血浆和含药血浆。另一方面,收集两组大鼠给药后0~24 h内的尿液,于4 ℃以3 000 r/min离心15 min,取上清液。将上述样品置于-80 ℃超低温冰箱冷冻储存,备用。
1.5.2生物样品的固相萃取处理 依次使用5 mL甲醇和5 mL水活化固相萃取小柱,取1 mL解冻后的血样或尿样上样,用5 mL水洗脱,然后用3 mL甲醇洗脱并收集洗脱液,室温下氮气吹干;向残渣中加入80 μL初始比例流动相(含5%乙腈)复溶,于4 ℃涡旋3 min后,以13 500 r/min离心15 min,取上清液,待LC-MS分析[17]。
2 结果与讨论
2.1 染料木素的质谱裂解行为
在ESI负离子模式下,染料木素产生准分子离子峰m/z269.044 4,其二级质谱图示于图1。在ESI-MS2图谱中,产生的多级质谱碎片离子有m/z241[M-H-CO]-、m/z240[M-H-CHO]-、m/z225[M-H-CO2]-、m/z213[M-H-2CO]-和m/z197[M-H-CO2-CO]-[18],示于图2。除此之外,染料木素还易发生RDA裂解,即C环1位和3位断裂,产生碎片离子m/z151,裂解规律示于图3。结合其他标准品的质谱裂解规律,本研究以连续产生CO中性丢失作为此类化合物的特异性裂解规律,为实现染料木素代谢产物的快速筛选及结构鉴定提供依据。
2.2 大鼠体内染料木素的代谢产物分析
根据获得的精确分子质量数据推断可能的元素组成,结合多级质谱裂解碎片和染料木素、染料木苷、大豆苷元、大豆苷的特征性质谱裂解规律等信息,对染料木素的代谢产物进行结构分析,结果列于表1,对应的提取离子流图示于图4(误差在±5×10-6以内),代谢途径示于图5。
在负离子检测模式下,化合物M0、M5、M9、M13、M14均产生准分子离子峰m/z269.044 4,推测其分子式为C15H9O5。在多级质谱图中,均产生m/z241(脱去CHO基团)、m/z240(脱去一分子CO2)、m/z225(脱去一分子CO)、m/z201(脱去C8H6O2)、m/z197(连续脱去两分子CO)、m/z185(脱去两分子CO的基础上开环脱去1个C原子)。鉴于以上化合物具有相似的质谱裂解规律,M0的色谱保留时间与染料木素标准品一致,因此,鉴定M0为染料木素,推测M5、M9、M13和M14为染料木素的同分异构体[19-20]。

图1 负离子模式下,染料木素的MS2质谱图Fig.1 MS2 spectrum of Genistein in negative ion mode

图2 负离子模式下,染料木素主要的质谱裂解规律Fig.2 Fragment pathways of Genistein in negative ion mode
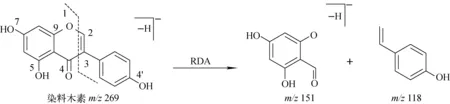
图3 负离子模式下 ,染料木素RDA质谱裂解规律Fig.3 Retro-Diels-Alder (RDA) rearrangement of Genistein in negative ion mode





注:a.分子质量为m/z 239.070 2、253.049 5、255.065 2、257.080 8、267.065 2的代谢产物;b.分子质量为m/z 269.044 4、271.060 0、283.060 0、285.039 3、285.075 7的代谢产物;c.分子质量为m/z 287.091 3、299.055 0、333.006 3、337.037 6的代谢产物;d.分子质量为m/z 415.102 3、417.118 0、429.081 5、431.097 2的代谢产物图4 给药组大鼠生物样品中染料木素代谢物的提取离子流图Fig.4 High resolution extracted ion chromatograms of Genistein metabolites in rats of drug group

注:中括号为未确定取代基团的位置;虚线框为初步确定取代基团的位置——A环、B环或C环;R为取代基团图5 染料木素在大鼠体内可能的代谢途径Fig.5 Proposed metabolic patterns of Genistein in vivo in rats
在负离子检测模式下,化合物M4和M19均产生准分子离子峰m/z283.060 0,其分子式为C16H11O5,分子质量较染料木素多14 u,初步推测为染料木素的甲基化产物。在多级裂解过程中,该离子失去一分子甲基,产生特异性碎片离子m/z268[M-H-CH3]-,表明甲基与羟基相连。其中,M4和M19产生特异性离子m/z165(在1位和3位发生RDA裂解),进一步证明了甲基存在于A环。根据色谱保留行为,7-O-methylgenistein相对于5-O-methyl-genistein的ClogP越小,在反向色谱柱上的保留时间越短。因此,推断M4和M19分别为5-O-methylgenistein(ClogP, 2.09)和7-O-methylgenistein(ClogP, 2.99)。
化合物M15、M23、M24和M25均产生准分子离子峰m/z299.055 0[M-H]-,推测其分子式为C16H11O6。在二级质谱图中,均产生m/z284(脱去一分子CH3),表明存在羟甲基。在三级质谱图中,由m/z284的基峰离子产生m/z256(脱去一分子CO)和m/z228(脱去两分子CO),与染料木素类成分的裂解规律一致。因此,初步鉴定M15、M23、M24和M25为染料木素的甲基化和羟基化产物。
代谢产物M17产生准分子离子峰m/z285.039 3[M-H]-,其分子式为C15H9O6,分子质量较染料木素多16 u,推测为染料木素的羟基化产物。在多级质谱中,准分子离子通过连续丢失CO基团产生碎片离子m/z257、229;而特征性离子m/z151在1位和3位发生RDA裂解,进一步证明羟基化反应发生在B环。因此,鉴定M17为羟基化染料木素。
化合物M22产生准分子离子峰m/z271.060 0[M-H]-,其分子式为C15H11O5。在多级裂解过程中产生特异性离子m/z165(在C2和C3发生断裂)和m/z151(在1位和3位发生RDA裂解)。因此,推断M22为染料木素的还原产物,结构式列于表1。M20产生准分子离子峰m/z285.075 7[M-H]-,较M22分子质量多14 u,推测其为M22的甲基化产物。M20在MS2中通过中性丢失CH3产生特异性碎片离子m/z270,表明母核中存在甲氧基取代基团;碎片离子m/z164、150的产生进一步证明甲基化发生于B环上。因此,鉴定M20为染料木素的甲基化及还原反应产物。
化合物M8和M11在负离子检测模式下均产生准分子离子峰m/z431.097 2,由精确分子质量推测其分子式为C21H19O10。在多级裂解过程中产生了特异性离子m/z269(中性丢失一分子葡萄糖),推测其发生了葡萄糖基化反应。与染料木苷对照品对比,M8与染料木苷具有相同的保留时间和质谱裂解规律。因此,推测M8为染料木苷,M11为染料木苷的同分异构体。
负离子检测模式下,化合物M3产生准分子离子峰m/z253.049 5,推测其分子式为C15H9O4。通过与大豆苷元对照品质谱裂解规律和保留时间的比对,鉴定其为大豆苷元。
化合物M1产生准分子离子峰m/z415.102 3[M-H]-,其分子式为C21H19O9,分子质量较大豆苷元多162 u,推测是大豆苷元的葡萄糖结合产物。在ESI-MS2质谱裂解中,产生特征性碎片离子m/z253[M-H-Glu]-进一步表明了葡萄糖基的存在;m/z197、196、135等碎片离子均提示与大豆苷元的裂解规律一致。通过与对照品比对,将其鉴定为大豆苷[21]。
化合物M2产生准分子离子峰m/z429.081 5[M-H]-,其分子式为C21H17O10。M2比大豆苷元多176 u,可初步推断为大豆苷元的葡萄糖醛酸化产物。由于其多级裂解规律与大豆苷元类似,因此,将M2鉴定为大豆苷元的葡萄糖醛酸化产物[22]。
化合物M7、M16和M30均产生准分子离子峰m/z255.065 2[M-H]-,推测其分子式为C15H11O4,分子质量较大豆苷元多2 u,推测为大豆苷元的还原产物。在多级质谱中产生了特征性离子m/z149(在C2和C3发生断裂)和m/z135(在1位和3位发生RDA裂解),进一步证明脱氢反应发生在C环的双键处。因此,将M7、M16和M30鉴定为大豆苷元的还原产物。
化合物M18和M27均产生准分子离子峰m/z257.080 8[M-H]-,推测其分子式为C15H13O4。在多级质谱中,M27产生特征性离子m/z163(在1位和3位发生断裂)和m/z109(在C4和C10发生断裂),根据文献[23]报道,将其鉴定为O-demethylangolensin。M18产生特异性离子m/z121、137,与文献[23]报道一致,因此将其鉴定为大豆苷元的双还原产物。
化合物M6产生准分子离子峰m/z337.037 6[M-H]-,其分子式为C15H13O7S。在ESI-MS2质谱裂解中,检测到了中性丢失一分子磺化基团而产生碎片离子m/z257。而m/z257离子的进一步裂解规律与M18类似,提示该化合物与大豆苷元的质谱碎片信息类似,通过查阅文献[24],将其鉴定为M18的硫酸酯化产物。
负离子检测模式下,化合物M21和M28均产生准分子离子峰m/z287.091 3[M-H]-,其分子式为C16H15O5。在二级质谱图中产生了特异性离子m/z272(中性丢失一分子CH3),证明母核中存在甲氧基取代基团。其中,M21通过RDA裂解产生特异性离子m/z151,据此推测甲基化反应和羟基化反应均未发生在A环。在M28的二级质谱中,经RDA裂解产生特异性离子m/z124,推测甲基化可能发生在A环。由于发生反应的具体位置未知,仅将M21和M28推测为M27的羟基化和甲基化产物。
化合物M12产生准分子离子峰m/z417.118 0[M-H]-,其分子式为C21H21O9。在多级质谱中产生了碎片离子m/z241,该离子较雌马酚多176 u;且碎片离子m/z135、121与文献[25]报道的雌马酚裂解规律一致,因此将其鉴定为雌马酚的葡萄糖醛酸化产物。代谢产物M26产生了准分子离子峰m/z239.070 2,其分子式为C15H11O3,比雌马酚多2 u,推测为雌马酚的还原产物,其质谱裂解规律与M12一致,均产生碎片离子m/z135、121。因此,将M26鉴定为雌马酚的还原产物。
3 结论
本研究通过分析大鼠尿样和血浆中染料木素代谢产物的精确分子质量、异黄酮类标准品的质谱裂解规律,并与空白组样品进行比较,共筛选鉴定出31种染料木素代谢产物。染料木素在大鼠体内主要发生葡萄糖醛酸化、葡萄糖结合、羟基化、还原反应、甲基化、硫酸酯化及其结合反应等反应类型。研究表明,基于高分辨质谱技术的天然产物体内代谢研究方法,可较全面地用于染料木素的代谢过程研究,为染料木素进一步的药动学研究、药理活性研究等提供理论参考,同时也可为其他天然产物的代谢研究提供借鉴。

