涂布介入器械的人血管内皮生长因子真核表达载体的构建
张一林 贺迎坤 李天晓 刘刚 胡延忠 崔秀坤
介入器械的快速发展为脑血管病的治疗带来了许多新的思路和方法,比如血管内支架成形术已经成为脑血管狭窄的治疗方式之一,辅助药物治疗的支架成形术有可能会减少重度脑血管狭窄患者的卒中风险[1]。有研究表明积极的药物治疗效果要优于支架置入[2],究其原因除了置入支架的早期卒中风险增高以及药物治疗的卒中风险低于预期外,较高的支架内再狭窄率导致的脑血管相应供血区域早期缺血性事件的大大增加也是重要的原因之一[3]。Zhu 等[4]研究发现,在中位随访期7 个月时的支架内再狭窄率为30.8%,这个数值比人们的预期要高出不少。在介入治疗中,如何减少介入器械对机体的影响,降低再狭窄率,改善血流动力学,减轻炎症反应则成为了一个急需解决的问题,许多学者把焦点放在了局部的血管微环境方面。
血管内皮细胞为单层扁平上皮细胞,构成了血管壁的内表面,在调节血管张力、维持血流动力学稳定、炎症反应、抗凝以及新生血管形成方面起着重要作用[5]。有研究证实在多种心脑血管疾病如高血压、动脉粥样硬化中,常伴随有内皮损伤,进一步探索内皮损伤的因素和机制发现,内皮损伤现在被视为这些心脑血管疾病的始动环节,在这些疾病的发生发展中起着不可忽视的作用[6-7]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管内皮细胞特异性的肝素结合生长因子,由内皮细胞、巨噬细胞、成纤维细胞和平滑肌细胞产生,其与受体结合后在体内体外均可直接促进内皮细胞增殖,此外,它还可以通过激活纤维酶原激活物,增强胶原酶活性等方法间接促进新生血管的形成[8]。VEGF 是一个家族,当前有7 个成员,分 别 为VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E,VEGF-F 及胎盘生长因子(placenta growth factor,PIGF),其中VEGF-A 为最有代表性的因子,其亚型VEGF-A165为形成新生血管的主要关键因子[9-10]。鉴于VEGF 强大的促血管生成能力以及对血管内皮细胞高度的亲和性,早在1996 年,Isner 等[11]就将phVEGF165涂布于球囊上直接导入1 例拟行截肢手术的足部缺血性坏疽患者体内,虽然在5 个月后患者仍未能避免截肢,但在此期间观察到了侧支血管明显增多、血流量增加。这初步证实了将基因涂布于装置上直接导入体内,不经过细胞转染也可以使基因在局部得以表达,虽然表达水平有限,但足以在局部发挥治疗效果,过高的表达水平反而有可能导致全身性的副作用。但是,关于在装置上涂布基因的方式以及涂布的基因量与局部表达水平的关系尚未有定论。本实验首次构建搭载人VEGF基因的真核表达质粒pIRES2-ZsGreen1-homo-VEGFA,使绿色荧光蛋白ZsGreen1 与目的基因VEGFA 共表达,翻译绿色荧光蛋白方便研究者检测目的基因的表达水平,为下一步探索血管内VEGF基因治疗及恰当有效的涂布治疗基因至介入器械提供支持。
材料与方法
一、材料
1. 实验材料及试剂∶DH5α 感受态细胞和真核表达载体pIRES2-ZsGreen1 购自BIOFAVOR 公司。人VEGFA(NM_001025366)cDNA 购自优宝生物。
2. 试剂∶各种限制性内切酶购自TAKARA 公司,T4 DNA 连接酶购自TRANS 公司,Taq Plus DNA聚合酶以及DNA Ladder 购自TIANGEN 公司,质粒大提试剂盒购自康为世纪公司,胶回收试剂盒购自GENERAY Biotechnology 公司。
二、方法
1. 制备目的基因片段及载体∶根据人VEGFA(NM_001025366) 目的序列,在蛋白编码序列(Coding sequence,CDS)翻译起始位点及终止位点附近设计引物如下∶Homo VEGFA-F:CCGCTCGAG CTGACGGACAGACAGACAGACAC,Homo VEGFAR:CGCGGATCCTCACCGCCTCGGCTTGTC。PCR 反应条件∶94 ℃变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸80 s,30 个循环;72 ℃延伸10 min,4 ℃保存4 min。PCR 条带约为1200 bp(图1),使用胶回收试剂盒回收纯化产物homo VEGFA,通过DNAMAN8 分析比较,真核表达载体pIRES2-ZsGreen1 存在,而目的基因片段CDS 区不含有Xho I与BamH I 酶切位点,故使用Xho I 与BamH I 双酶切载体 pIRES2 -ZsGreen1 和目的基因 homo VEGFA,电泳后得到两者的条带见图2。
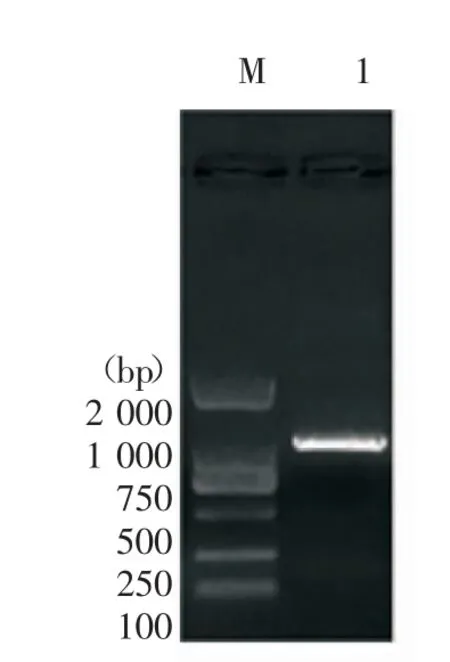
图1 制备目的基因(M∶DNA Marker;1∶homo VEGFA)

图2 双酶切载体与目的基因(M∶DNA Marker;1∶pIRES2-ZsGreen1;2∶homo VEGFA)
2.连接转化与鉴定∶T4 连接酶连接回收纯化的目的基因片段与载体,连接产物转化DH5α 感受态细胞,涂布含Kana 抗性的LB 平板,37 ℃恒温箱培养过夜。次日从培养皿上各挑取数个单菌落接种于含Kana 抗性的LB 培养液中,37 ℃恒温摇床过夜后取菌液做菌落PCR,引物选取载体上序列,设计引物 为 ∶CMV -F:CGCAAATGGGCGGTAGGCGTG,IRES-R:CCTCACATTGCCAAAAGACG。PCR 反应条件∶94 ℃变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸80 s,30 个循环;72 ℃延伸10 min,4 ℃保存4 min。选菌液送生物实验室进行测序。
结 果
连接产物转化入大肠杆菌后涂平板过夜。次日平板长出多个菌落,挑菌后接种于含Kana 抗性的LB 培养液,过夜后随机取菌液做PCR,琼脂糖电泳结果示4 份样本PCR 条带大约为1400 bp,基本可确认目的基因已连接到载体(图3),送菌液至生物实验室测序,与人VEGFA(NM_001025366)目的序列比对结果一致,未见变异。至此,质粒pIRES2-ZsGreen1-homo-VEGFA 构建成功,使用质粒大提试剂盒提取质粒后保存,为下一步实验做准备。

图3 构建重组质粒(M∶DNA Marker;1∶pIRES2-ZsGreen1-homo-VEGFA-1;2∶pIRES2-ZsGreen1-homo-VEGFA-2;3∶pIRES2-ZsGreen1-homo-VEGFA-3;4∶pIRES2-ZsGreen1-homo-VEGFA-4)
讨 论
现有的支架置入方法主要是通过金属支架来扩张血管、解除血管狭窄或者梗阻。但是作为一种有创治疗,血管损伤会导致新生内膜的过度增生,从而导致再狭窄。而药物洗脱支架(drug-eluting stent,DES)由金属支架与可控释药物的载体部分构成[12],既能扩张狭窄血管,又可以通过局部释放药物来抑制新生内膜过度增生。不过常用的涂布药物会影响血管内皮的正常生长,容易引发血栓,最终导致动脉粥样硬化以及再狭窄。随着基因治疗概念的兴起,有学者认为在介入器械的表面涂上一层治疗基因,可以将治疗作用局限在病变部位,最大限度的发挥其再内皮化、修复血管损伤的作用,同时降低对全身的毒副作用[13]。
通过输注外源性的血管内皮生长因子,利用血管自身潜在的生长潜能,在VEGF 的作用下形成新生血管,改善血运,达成修复血管内皮损伤或治疗缺血性血管疾病的目的,这一方法称为“治疗性血管生成”。目前应用VEGF 进行治疗有两种方式,一种是于血管内直接注入VEGF 蛋白,另一种为转入VEGF 基因。蛋白注入的方法操作简单,见效较快,在动物实验[14]及临床研究[15]中均证实外源性的VEGF 蛋白可以有效增加血流量,改善血运,达到治疗目的。但是蛋白注入法同时存在着诸多问题,如蛋白在体内易被稀释,血浆半衰期较短,不容易在病灶处达到有效治疗浓度等,在整个治疗过程中需要VEGF 维持一定的血浆浓度,故单纯给予蛋白难以满足临床治疗的需要。
与注入蛋白相比,基因治疗一直是近些年的热点,陈良万等[16]将带有外源性基因的医用缝合线缝合于大鼠的颈总动脉,证明外源性基因通过简单的缝线法即可在血管壁中表达出相应的蛋白质。黄志雄等[17]将可溶性支架在含Adv5-CMV/LacZ 质粒的高浓度葡萄糖溶液中浸泡半小时后置于血管腔内进行吻合,然后行β-半乳糖苷酶(LacZ 基因的表达产物)活性测定和组织化学染色,结果表明这种转基因方法能使外源性基因在血管壁内获得有效表达。与直接注入蛋白相比较,基因转入稍复杂,但只要成功表达,一次转入就可以获得短期内的持续表达,并且不需要大量的质粒DNA。由于VEGF 基因第一外显子含有一个分泌肽序列,能使VEGF 从细胞内完整的分泌出来,因此,虽然基因的转染效率不高,但通过旁分泌也能发挥很大作用。也有动物实验证明,每天持续小量的VEGF 刺激,不会影响正常循环系统,但可以特异性地刺激缺血性组织的血管生长,这一现象可能与缺血性组织中VEGF 受体的表达增加有关[18]。
本次实验选取搭载人VEGFA cDNA 的载体pDONR223 为模板,选择含有内部核糖体结合位点(IRES)的pIRES2-ZsGreen1 真核表达载体,使绿色荧光蛋白ZsGreen1 和目的基因共表达,经相同mRNA 转录分别翻译绿色荧光蛋白基因和目的基因,使其高效表达,方便地检测到目的基因的表达水平和转染效率,此时的绿色荧光蛋白只作为目的蛋白转录和翻译的指示剂而不影响目的蛋白的功能。通过设计的引物,由载体pDONR223 上扩增人VEGFA cDNA,利用软件prime premer 5.0 查找合适的限制性内切酶,利用引物在目的基因两侧非CDS区添加限制性内切酶Xho I 和BamH I 的结合位点,方便下一步双酶切载体pIRES2-ZsGreen1 和目的基因homo VEGFA 后连接。双酶切后将两者连接转化入感受态大肠杆菌中,培养后进行测序,结果示其核苷酸序列与人VEGFA(NM_001025366)目的序列一致无变异,至此,本研究成功构建了重组质粒pIRES2-ZsGreen1-homo-VEGFA,为下一步探索血管内的VEGF 基因治疗及相应治疗基因涂布介入器械装置奠定了基础。
——一道江苏高考题的奥秘解读和拓展

