心房钠尿肽与急性颈部脊髓损伤后低钠血症的相关性*
尚明富,冯 飞,祁 健
低钠血症(hyponatremia,HN)是急性颈部脊髓损伤后常见的严重并发症之一,发生率高达45%~77.8%[1,2],其危害性较大,如能及时治疗,可提高急性颈部脊髓损伤(acute cervical spinal cord injury,ASCI)患者的生存率[1,3,4]。 但是目前关于 ASCI 后HN的发生机制尚没有一个完善的理论能够解释,一般认为属于中枢性HN范畴。主要有两种仍存在较大争议的理论包括抗利尿激素分泌异常综合征(syndrome of inappropriate secretion of antiduretic hormone,SIADH)[5,6]和脑耗盐综合征(cerebral salt wasting syndrome,CSWS)[7]。
这两种理论对HN的治疗原则完全相反,SIADH的治疗原则是限水为主,而CSWS的治疗原则是积极补充血容量的容量替代疗法。因此,不适当的诊断、治疗,不但不能及时地纠正HN,反而会加重神经系统的进一步损伤,甚至会使已恢复的神经功能再次丧失。因此,早期、快速、正确的找出ASCI患者HN发生的原因有助于及时、正确的处理与治疗,对改善预后亦有很大帮助。据报道ASCI患者血浆心房钠尿肽(atrial natriuretic peptide,ANP)水平明显增高[8]。
近年来各种心血管疾病、呼吸系统疾病、休克及脓毒症等疾病中ANP分泌变化的研究日趋增多,研究发现ANP与上述疾病的严重程度及预后有明显相关性。临床观察ASCI患者特别是损伤平面较高,损伤程度较重者,常伴有肺部或者泌尿系的感染、中枢性体温升高、低蛋白血症、甚至合并创伤性休克等,常导致患者心肺功能不全,同时多数患者血浆中ANP浓度显著增高,血钠水平明显降低,24 h尿钠总量及24 h尿量增多。
笔者通过观察HN患者临床表现、检测血电解质、血浆 ANP、AVP、ALD,24 h 尿量、24 h 尿钠总量及其影响因素,来研究ASCI并发HN的相关因素,就HN患者血浆ANP水平与血钠、24 h尿钠及24 h尿量进行相关性分析,以初步探讨ANP与HN的关系,及ANP在HN发生过程中的可能的作用机制,为临床上预防、诊断和治疗HN提供依据和参考。
1 资料与方法
1.1 一般资料 试验组受试者主要为2006年6月—2008年3月期间,笔者所在医院脊髓修复科收治的急性颈部脊髓损伤(ASCI)患者,共35例;患者入院后均行X、CT、MRI检查,损伤部位:C4及C4以上7例,C512例,C6 11例 C7 5例。瘫痪程度按Frankel分级A级9例,B~D级26例。对照组18例(C组),为无急性颈部脊髓损伤及急性创伤患者,主要为同期住院的颈椎病、腰椎间盘突出症、骨性关节病的患者。两组年龄均数t检验及性别构成的χ2检验,差异均无统计学意义。试验组及对照组均排除心、肺、肝、肾、内分泌系统疾病,及长期限盐、严重呕吐和消耗性疾病。
1.2 方 法
1.2.1 血生化 颈部脊髓损伤 (简称颈髓损伤)组入院后查血浆Na+1次/2 d,对照组常规检查。连续两次出现血钠低于135 mmol/L认为出现HN。
1.2.2 尿生化及尿量 颈髓损伤组入院后常规记录24 h尿量及液体入量,在伤后8~20 d期间或估计HN达到最高峰时,留置1次24 h尿标本,检测24 h尿Na+总排出量、尿量。对照组入院后连续3 d检测24 h尿量,取其平均值,留置1次24 h尿标本,检测24 h尿Na+总排出量。
1.2.3 ANP、醛固酮(ALD)、抗利尿激素(AVP)检测两组在入院后8~20 d期间,分别取清晨(7~8 am)卧位静脉血6 ml,注入各自的乙二胺四乙酸(EDTA)、胰肽酶的试管中,低温离心,取上清液,提取完毕,放入-20℃冰箱保存。用放免法(RIA)检测各指标中ANP、ALD、AVP的浓度。心钠素、醛固酮药盒由北京北方生物技术研究所提供,AVP RIA试剂盒由美 Diagnostic Systems Laboratories Inc.提供,测定方法按说明进行。
1.2.4 数据分析及统计学处理 统计学分析均采用SPSS 11.5统计软件进行分析和处理。所得数据计量资料以均数±标准差表示(),分析前进行正态检验和方差齐性检验,组间差异的比较采用t检验。对血浆中ANP浓度与血钠浓度、24 h尿钠、24 h尿量进行直线相关性分析,均以P<0.05为差异有统计学意义。
2 结果
该试验组Frankel分级A级7例患者出现HN,平均血钠(120.5±6.02) mmol/L,最低达到 105 mmol/L。Frankel分级B~D级7例伤后出现HN。将颈髓损伤组按是否出现HN分为低钠血症组 (A组),14例;开始出现 HN的时间为(5.6±1.4)d;其中男 9例,女 5 例;年龄(24~48)岁,平均(36.6±8.3)岁。 非低钠血症组(B组),21例;其中男13例,女8例;年龄 20~47 岁,平均(37.8±9.6)岁。 对照组(C 组),18例。
2.1 颈髓损伤程度与HN的关系 HN的发生率与颈髓的损伤程度有关,颈髓损伤越重,HN的发生率越高。见表1。
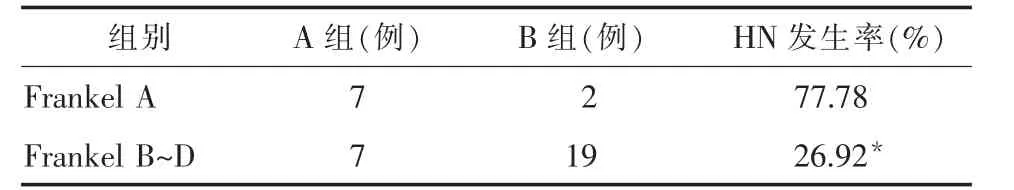
表1 颈髓损伤程度与HN的关系
2.2 颈髓损伤平面与HN的关系 HN的发生率与颈髓损伤平面有关,颈髓损伤平面越高,HN的发生率越高。见表2。

表2 颈髓损伤平面与HN的关系
2.3 肺部感染情况与HN的关系 HN的发生率与肺部感染有关,肺部感染可能是HN发生的危险因素。见表3。
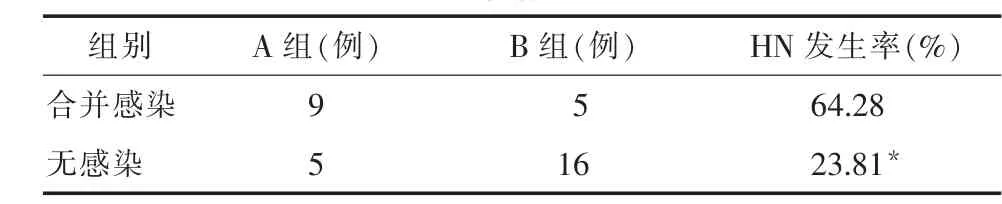
表3 肺部感染情况与HN的关系
2.4 ANP、ALD、AVP 的血浆浓度 A组患者ANP的浓度高于B组、C组血浆ANP的浓度,差异有统计学意义 (P<0.05),B组、C组血浆ANP的浓度差异没有统计学意义(P>0.05)。A组患者ALD的浓度低于B组、C组血浆ALD的浓度,差异有统计学意义 (P<0.05),B组、C组血浆ALD的浓度差异没有统计学意义(P>0.05)。A组患者AVP的浓度高于B组、C组血浆AVP的浓度,差异有统计学意义(P<0.05),B 组、C 组血浆 AVP 的浓度差异没有统计学意义(P>0.05)。 见表4。
表4 ANP、ALD、AVP 的血浆浓度()
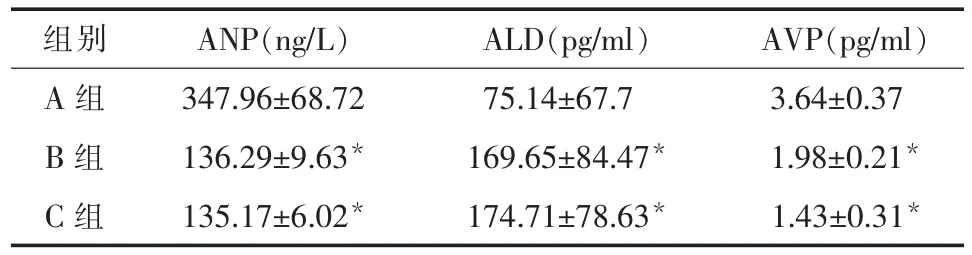
表4 ANP、ALD、AVP 的血浆浓度()
注:与 A 组比较,*P<0.05。
组别 ANP(ng/L) ALD(pg/ml) AVP(pg/ml)A 组 347.96±68.72 75.14±67.7 3.64±0.37 B 组 136.29±9.63* 169.65±84.47* 1.98±0.21*C 组 135.17±6.02* 174.71±78.63* 1.43±0.31*
2.5 24 h尿钠总量、24 h尿量及血钠浓度 A组患者24 h尿钠总量明显增加,与B组、C组的差异有统计学意义 (P<0.05),B组与C组的差异无统计学意义(P>0.05)。A组患者24 h尿量明显增加,与B组、C组的差异有统计学意义(P<0.05),B组与C组的差异无统计学意义(P>0.05)。A组患者血浆钠浓度低于正常范围,与B组、C组的差异有统计学意义(P<0.05),B 组与 C 组的差异无统计学意义(P>0.05)。 见表5。
2.6 血浆ANP浓度与血钠的相关性分析 A组经直线相关分析,P<0.05,说明血浆ANP与血浆Na+呈显著负相关性 (r=-0.84);B、C组经直线相关分析,P>0.05,两者无相关性。见表6。
表5 24 h尿钠总量、24 h尿量及血钠浓度()

表5 24 h尿钠总量、24 h尿量及血钠浓度()
注:与 A 组比较,*P<0.05。
组别 24 h尿钠(mmol/d) 24 h尿量(ml/d) 血Na+浓度(mmol/L)A 组 482.7±165.4 4081±856 120.6±5.32 B 组 243.6±78.9* 1892±823* 139.13±2.47*C 组 213.7±95.2* 1905±723* 142.7±4.28*

表6 血浆ANP浓度与血钠的相关性分析
2.7 血浆ANP浓度与24 h尿钠总量的相关性分析 A组经直线相关分析,P<0.05,说明血浆ANP浓度与24 h尿钠总量呈显著正相关性(r=0.81)。B、C组经直线相关分析,P>0.05,说明两者无相关性。见表7。
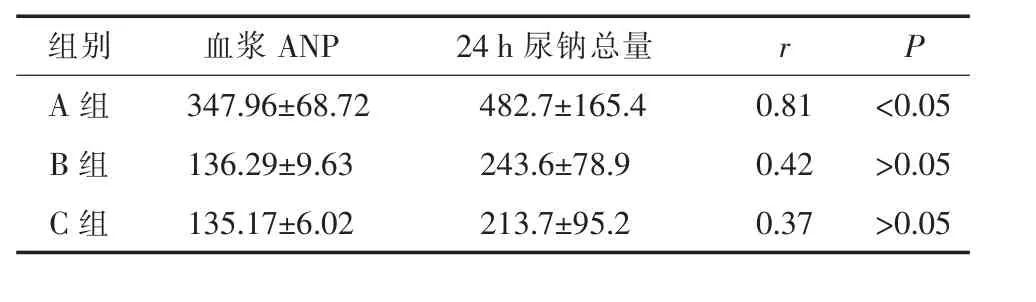
表7 血浆ANP浓度与24 h尿钠总量的相关性分析
2.8 血浆ANP浓度与24 h尿量的相关性分析A组经直线相关分析,P<0.05,说明血浆ANP浓度与24h尿量呈显著正相关性(r=0.82)。B组、C组经直线相关分析,P>0.05,两者无相关性。见表8。
3 讨论
近年来,各种心血管疾病[9-11]、呼吸系统疾病[12,13]、休克[14]及脓血症[11]等疾病中 ANP 分泌变化的研究日趋增多,发现ANP与上述疾病的严重程度及预后有明显相关性。上述疾病越严重,其血浆ANP浓度越高。然而,ANP与ASCI后继发HN的相关性在国内外研究报道较少。
ANP是由28个氨基酸组成的多肽类激素由哺乳类动物心房肌细胞分泌,肺静脉的壁细胞和肺泡上皮细胞也可产生和分泌,在体内降解快,生物半衰期仅2 min,具有多种生物活性,是血管平滑肌舒缩的介质,具有排钠利尿作用。受年龄、盐摄入量、细胞外液渗透压、动脉氧分压、心房肌牵张力等因素影响[16]。相关研究表明ANP升高的原因可能是:(1)颈髓损伤患者均有不同程度的呼吸功能障碍,缺氧及高碳酸血症使肺内小气道阻塞致肺动脉高压,右心房内压升高,心肌牵张力增大,刺激心房肌内心钠素感受器引起 ANP 分泌增加[17];(2)颈髓损伤患者长期卧床,咳痰功能障碍,气道分泌物积聚刺激引起局部炎症,刺激肺脏释放心房肽样物质;(3)血压和容量负荷:因损伤后交感神经功能障碍,使血容量降低,给予大量输液后使正常心脏压力和容量负荷升高,导致ANP升高;(4)动脉氧分压降低[16]。
3.1 HN的发生与脊髓损伤程度有关 研究显示,瘫痪越严重越容易发生HN,Frankel A级的HN发生率为 77.78%,Frankel B~D级的 HN发生率为26.92%,两者相比差异有显著性(P<0.05)。可能是因为瘫痪越重,越易出现呼吸和心功能的衰竭,越易导致心室压力升高、肺部感染、肺动脉压力升高,ANP的分泌增加。
3.2 HN的发生与颈髓损伤平面有关 研究发现,颈髓损伤平面越高越易发生HN,损伤平面不低于C4患者发生HN的概率为85.71%,损伤平面低于C4患者发生HN的概率为28.57%,两者比较差异有显著性(P<0.05)。可能是因为颈髓损伤平面越高,越接近延髓(呼吸、心跳中枢),越容易引起呼吸、心功能衰竭,越容易引起ANP的分泌。
3.3 HN的发生与感染有关 脊髓损伤后,患者常合并肺部感染,从而使通气/血流比例失调,动脉氧分压减低,而引起ANP的分泌增加。研究发现,14例合并感染的患者中HN的发生率为64.28%,而21例无合并感染的患者中HN的发生率为23.81%,两者比较差异有显著性(P<0.05)。说明感染可能是ASCI患者发生HN的危险因素。
3.4 ASCI患者的血浆ANP水平及其分析 研究显示,A组患者血浆ANP浓度较B、C组水平均显著增高,差异均有统计学意义(P<0.05)。同时A组开始出现HN的时间为(5.6±1.4)d。分析原因可能是ASCI患者特别是损伤平面较高,损伤程度较重者,常伴有肺部或者泌尿系的感染、中枢性体温升高、低蛋白血症、甚至合并创伤性休克等,常导致患者心肺功能不全,从而使血浆中ANP水平异常增高。
3.5 ASCI患者的血浆ALD水平及其分析 ALD是肾上腺皮质球状带所分泌的一种激素,其作用是促进远曲小管和集合管对Na+的主动重吸收,同时排K+,所以ALD具有保钠排钾的作用。研究显示,A组患者血浆ALD浓度较B、C组水平均显著降低,差异均有统计学意义(P<0.05)。分析其可能原因为:(1)增高的ANP抑制了RAAS,使ALD分泌减少;(2)ASCI后出现以SNS抑制为主的自主神经功能紊乱[18],肾交感神经释放去甲肾上腺素较少,导致肾素释放减少,从而抑制 RAAS,导致血浆ALD水平下降。
3.6 ASCI患者的血浆AVP水平及其分析 研究显示,A组患者血浆AVP浓度较B、C组水平均显著升高,差异均有统计学意义(P<0.05)。分析其可能原因为增高的ANP发挥了其强大的利尿利钠作用后,A组出现HN、低渗血症、低血容量症,反射性引起AVP分泌增加以拮抗ANP的利尿作用,保水的同时导致了血钠进一步降低(稀释性HN)。有研究认为,血中AVP的升高是颈髓损伤者循环血容量下降,刺激牵张感受器,通过神经垂体而致血AVP升高。研究表明ASCI后发生HN的机制为:一方面急性颈髓损伤患者存在低蛋白血症,低蛋白血症的后果导致血容量降低,由于血容量的不足反射性地引起AVP的过度分泌,导致游离水排泄障碍,引起稀释性HN;另一方面急性颈髓损伤后,交感神经功能障碍,血管张力降低,血容量相对不足,反射性地引起AVP的过度分泌,导致游离水排泄障碍,引起稀释性HN。
3.7 ASCI患者24 h尿量、24 h尿钠总量的分析A组患者24 h尿量较B、C组水平均显著升高,差异均有统计学意义(P<0.05)。A组患者24 h尿钠总量较B、C组水平均显著升高,差异均有统计学意义(P<0.05)。说明 ASCI患者 24 h 尿量、24 h 尿钠总量明显升高。考虑与ANP的升高有关。
3.8 血浆ANP浓度与血钠浓度、24 h尿量、24 h尿钠总量的相关性分析 血浆ANP的浓度越高,血钠浓度越低,相关性分析提示两者呈显著负相关(r=-0.84,P<0.05);血浆 ANP 浓度越高,尿钠总量、尿量越高,呈明显的正相关(r=0.82,P<0.05;r=0.81,P<0.05)。这表明,ANP在ASCI并HN的患者中发挥了强大的利尿利钠作用。
相关研究表明ANP参与水电解质的调节主要表现在:(1)选择性舒张肾入球小动脉,肾小球滤过率增大;(2)ANP通过cGMP使集合管上皮细胞管腔膜上的Na+通道关闭,抑制NaCl的重吸收;(3)抑制 RAAS 的活性[15];(4)由于急性颈髓损伤后交感神经功能障碍,外周血管舒张以及出血等使血容量降低,这时快速输入大量液体,容量负荷升高,心肌牵张力增大,刺激心房肌内心钠素感受器导致心钠素分泌增加,尿钠排出增多致HN。
笔者认为ASCI后HN的发生的可能机制是:(1)ASCI的患者,特别是损伤平面较高,损伤程度较重者,常伴有肺部或者泌尿系的感染、中枢性体温升高、低蛋白血症、甚至合并创伤性休克等,常导致患者心肺功能不全,从而使血浆中ANP水平持续增高,增高的ANP发挥了强大的利尿利钠作用,使患者体内钠及水大量丢失。(2)ASCI后出现以SNS抑制为主的自主神经功能紊乱[18],肾交感神经释放去甲肾上腺素较少,从而导致肾素释放减少,抑制 RAAS,导致血浆ALD水平下降,其保钠作用降低。(3)血容量、血渗透压的降低引起AVP分泌增加,使水的丢失减少,但尿钠总量持续偏高,导致HN。
对急性脊髓损伤并发低血钠的15例患者随机分为吸氧组和非吸氧组的研究表明:吸氧组血浆ANP和血清钠在第7天基本恢复正常,且两者的恢复呈一致性,而非吸氧组血浆ANP和血清钠则在第13天左右恢复正常,两组之间有明显的区别,说明吸氧可促进血浆ANP的下降和血清钠的恢复,提示纠正缺氧可降低血浆ANP水平,从而纠正颈髓损伤后顽固性低血钠。这说明HN的发生是由ANP引起。
笔者认为,ASCI患者常伴有心肺功能不全,从而使血浆中ANP水平持续增高,并发挥了强大的利尿利钠作用,降低的ALD使肾脏的保钠作用降低,反射性增高的AVP保水的同时使血钠进一步降低,它们的共同作用导致了临床上顽固的HN,其中ANP起主导作用。可以在积极治疗原发病的基础上,通过改善患者的心肺功能(如:吸氧)来降低患者的血清ANP浓度,从而纠正ASCI后的顽固的HN。ASCI患者的临床表现与数据均表明HN的产生可能与ANP的产生存在着直接或间接的联系,因此,可以认为,ANP浓度的升高可能是导致ASCI后HN的原因。
该研究不足之处:由于收集的病例数相对少,不能完全真实反应血清ANP浓度与脊髓损伤后的顽固的HN之间的关系,应增加样本数加以分析,更有效说明血清ANP浓度与脊髓损伤后的顽固的HN之间的关系。结论:(1)ASCI后HN患者血浆ANP浓度显著升高;(2)ASCI患者血浆ANP浓度与血浆钠浓度成明显负相关,与24 h尿钠、24 h尿量呈明显正相关;(3)ASCI后血浆ANP浓度的升高可能是导致ASCI后HN发生的原因。

