喜树碱对人原代角质形成细胞自噬的影响
郝阳阳 张梁宇 王翔 童云峰 孙颖 陈杨
313000浙江湖州,解放军第九八医院皮肤科[郝阳阳(现在湖州市第一人民医院皮肤科,313000)、张梁宇、童云峰、孙颖、陈杨],药械科(王翔)
细胞自噬是一种普遍存在于真核细胞中的自我保护机制,通过形成自噬溶酶体来清除失去功能和变性受损的细胞器、大分子物质以及入侵的微生物等,以维持细胞的稳态和更新[1-2]。角质形成细胞自噬水平降低导致细胞分化不全、炎症水平升高,参与银屑病的病理过程[3-4]。前期研究[5]发现,喜树碱可诱导HaCaT细胞自噬,本研究中我们探讨喜树碱对人原代角质形成细胞(human primary keratinocytes,HPK)自噬的影响。
材料与方法
一、材料
1.主要试剂:喜树碱(含量>95%,日本东京化成工业公司),二甲基亚砜(DMSO,美国Sigma公司)。DMEM培养基、胎牛血清(FBS)、胰酶+乙二胺四乙酸(EDTA)消化液、Epilife培养基、人角质形成细胞生长添加剂、庆大霉素/两性霉素、TrypLE™Express酶均为美国Gibco公司产品。中性蛋白酶Ⅱ(dispaseⅡ),膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)细胞凋亡检测试剂盒(美国BD公司),CCK8试剂盒(日本同仁化学公司),兔抗人微管相关蛋白1轻链3(LC3)单克隆抗体(美国Novus公司),兔抗人p62单克隆抗体(美国Proteintech公司),兔抗人角蛋白6单克隆抗体(CK6,英国Abcam公司),辣根过氧化物酶标记山羊抗兔二抗(美国Santa Cruz公司)。
2.标本:标本来源于2016年5-12月在解放军第九八医院泌尿外科行包皮环切术的健康成年及青少年男性,共12例,年龄10~23岁。本研究通过本院医学伦理委员会批准,入选者均签署知情同意书。
二、方法
1.完全培养基的配制:将5 ml人角质形成细胞生长添加剂加入500 ml Epilif培养基中,混匀,分装。
2.HPK的分离培养:获取包皮组织后立即放入加有20 mg/L庆大霉素/两性霉素的磷酸盐缓冲液(PBS)中,PBS清洗3次,将组织放入含庆大霉素/两性霉素的完全培养基中,去除皮下组织,将皮肤组织剪成5 mm ×5 mm小块,加dispaseⅡ(1.2 U/ml)4℃避光过夜;次日分离表皮和真皮,弃真皮,用0.5%胰酶37℃消化表皮5~10 min,用含10%胎牛血清的DMEM培养基终止消化,在孔径100 μm的滤网上研磨表皮,过滤、离心,PBS洗涤2次,用含抗生素的培养基重悬细胞,以1×106个/ml的密度接种于25 cm2培养瓶中;待细胞贴壁,可见细胞成簇生长,2~3 d换液1次,细胞融合度达到80%时,用TrypLE™Express酶消化细胞,传代。在传代过程中,逐渐降低培养基中抗生素的浓度。取第3代细胞用于实验。
3.药物处理:喜树碱以DMSO溶解后,-20℃避光保存,存储浓度为10 mol/L,使用时用完全培养基稀释成工作浓度。DMSO的终浓度≤0.1%。
4.CCK8检测细胞增殖抑制率:将对数生长期HPK以1×104/孔接种于96孔板中,于37℃、5%CO2培养箱中培养24 h,弃上清液,实验组每孔加入含不同浓度(200 nmol/L、2 μmol/L、6 μmol/L)喜树碱的完全培养基100 μl,对照组加入含0.1%DMSO的完全培养基,并设置正常对照组(不做任何处理),每组设置6个复孔,分别培养24、48 h后,去除培养液,每孔加入含10 μl CCK8的培养液100 μl。同时设空白组,不加细胞,只加含10 μl CCK8的培养液100 μl。37 ℃、5%CO2条件下孵育2 h,酶标仪检测450 nm波长下吸光度(A值)。细胞增殖抑制率=[1-(实验组A450值-空白组A450值)/(正常对照组A450值-空白组A450值)]×100%。实验重复3次,取均值。
5.Annexin-FITC/碘化丙锭(PI)双染法检测细胞凋亡:细胞分组及处理同方法“二、4”,处理细胞24 h后检测细胞凋亡。方法同文献[5]。以Annexin V阳性细胞为凋亡细胞。
6.免疫印迹法检测LC3、p62蛋白的表达水平:细胞分组及处理同上,处理细胞24 h后进行检测,方法同文献[5]。
7.间接免疫荧光法检测LC3:细胞分为两组,对照组(用含0.1%DMSO的完全培养基处理)和2 μmol/L喜树碱组,处理24 h后检测,方法同文献[5]。在细胞质或细胞核周围观察到3个或以上高密度的绿色荧光点即判定为自噬体阳性细胞。随机在荧光显微镜下选取5个200倍视野,统计每个视野中自噬体阳性细胞数,计算阳性细胞百分率,取均值。
8.透射电镜观察细胞自噬超微结构:将HPK以1×105/ml的密度接种于100 mm培养皿中,每皿加10 ml完全培养基,培养24 h后,去除上清液,对照组加入含0.1%DMSO的完全培养基,实验组加入含2 μmol/L喜树碱的培养基,继续培养24 h,用2.5%戊二醛4℃固定细胞过夜,PBS洗涤3次,加入1%锇酸于4℃下振荡固定3 h,PBS洗涤3次,乙醇逐级脱水,环氧丙烷置换,Suprr树脂浸透包埋,最后在70℃烘箱中聚合。将不同材料的包埋块在超薄切片机上切片,厚度70 nm,经醋酸双氧铀和柠檬酸铅染色,透射电镜下观察并拍照。
9.统计学分析:采用SPSS 16.0统计分析,计量资料以±s表示。各均数经Levene检验方差齐性。不同浓度喜树碱组细胞增殖抑制率以及凋亡的总体差异采用单因素方差分析,组间多重比较采用Dunnettt检验,自噬体阳性细胞率采用独立样本t检验。P<0.05为差异有统计学意义。
结 果
一、不同浓度喜树碱对HPK增殖的影响
对照组和200 nmol/L、2 μmol/L、6 μmol/L喜树碱组HPK增殖抑制率(表1)在24 h时总体差异有统计学意义(P<0.01),2 μmol/L、6 μmol/L组抑制率显著高于对照组(t=12.09、18.76,均P< 0.01),200 nmol/L组与对照组差异无统计学意义(t=2.24,P>0.05)。48 h时各组增殖抑制率差异有统计学意义(P<0.01),各实验组抑制率均高于对照组(t=4.27、13.63、16.83,均P< 0.01)。
二、不同浓度喜树碱对HPK凋亡的影响
对照组、200 nmol/L、2 μmol/L、6 μmol/L喜树碱组24 h时凋亡率差异有统计学意义(P<0.01),实验组凋亡率均高于对照组(t=6.19、12.30、15.01,均P<0.01)),随着药物浓度增加,促凋亡作用增强。见表1。
三、喜树碱作用于HPK后LC3、p62蛋白的表达
不同浓度喜树碱作用HPK 24 h后,自噬相关蛋白LC3-Ⅱ在喜树碱浓度为2、6 μmol/L时表达显著上调,与对照组比较差异有统计学意义(P<0.01);p62蛋白在2、6 μmol/L组轻度下调,与对照组比较差异均有统计学意义(P<0.01),见表1、图1。在喜树碱浓度为2 μmol/L时,LC3-Ⅱ蛋白显著上调,提示在此浓度时细胞自噬水平升高,因此选取该组细胞观察自噬体及其超微结构。
四、喜树碱对HPK自噬体阳性细胞的影响
2 μmol/L喜树碱作用HPK 24 h后,LC3间接免疫荧光染色观察发现,细胞核周及胞质呈现高密度绿色荧光点,实验组绿色荧光强度较对照组明显增强,对照组细胞胞质内也存在数量较多的荧光聚集点,见图2。对照组和实验组自噬体阳性细胞百分率分别为(38.96±13.12)%、(60.16±8.78)%,两组差异有统计学意义(t=3.003,P< 0.05)。
表1 不同浓度喜树碱对人原代角质形成细胞增殖抑制率、凋亡率及LC3、p62蛋白表达的影响(±s)

表1 不同浓度喜树碱对人原代角质形成细胞增殖抑制率、凋亡率及LC3、p62蛋白表达的影响(±s)
注:n=3。a与对照组比较,P<0.01
组别24 h凋亡率(%)对照组200 nmol/L喜树碱组2 μmol/L喜树碱组6 μmol/L喜树碱组F值P值增殖抑制率(%)24 h 1.60±0.78 7.59±1.82 33.90±3.65a 51.72±5.06a 152.9<0.01 48 h 4.18±1.56 19.21±5.74a 52.09±3.01a 63.37±5.45a 123.8<0.01 2.30±1.68 15.90±2.14a 29.33±3.51a 35.28±3.05a 89.57<0.01自噬相关蛋白与β肌动蛋白灰度比值LC3-Ⅱ0.747±0.045 0.690±0.052 1.213±0.063a 1.292±0.057a 97.52<0.01 p62蛋白1.203±0.133 1.287±0.117 0.905±0.103a 0.904±0.046a 9.47<0.01
五、喜树碱处理24 h后HPK内自噬体超微结构
2μmol/L喜树碱组细胞胞质内可见较多高电子密度的由双层或单层膜包裹的囊泡样结构,结构内为胞质成分,部分囊泡内可见损伤的细胞器成分,如线粒体、内质网等;对照组胞质内细胞内容物均一,线粒体、内质网等细胞器结构清晰,囊泡样结构相对较少。见图3。
讨 论

图1 不同浓度喜树碱作用人原代角质形成细胞24 h后LC3、p62蛋白表达
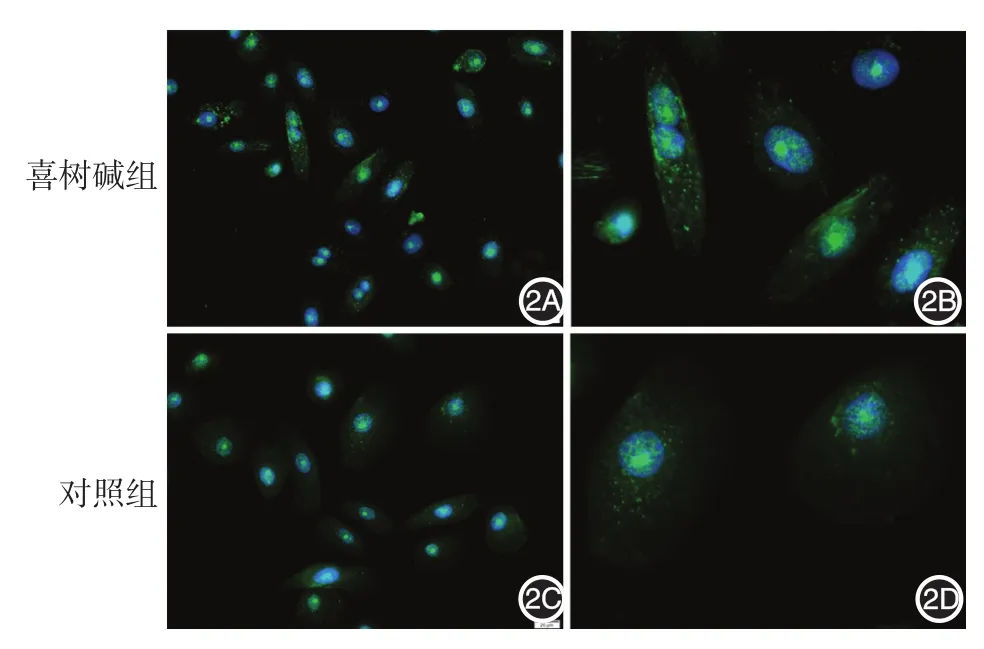
图2 LC3间接免疫荧光观察人原代角质形成细胞自噬体的形成
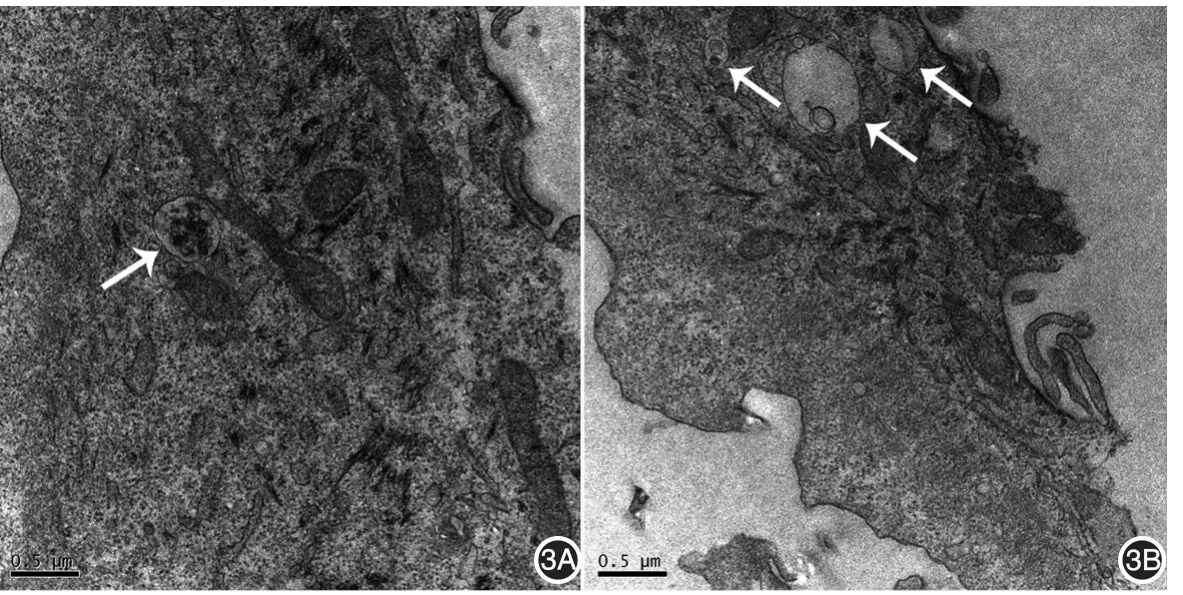
图3 人原代角质形成细胞自噬体超微结构
因HPK培养周期长、细胞稳定性难以保证、培养基昂贵,既往对于角质形成细胞的研究多采用人角质形成细胞系HaCaT。HaCaT细胞与HPK在细胞形态、生长周期以及对外界刺激反应方面均存在较大差异。实验中HaCaT细胞增殖明显较HPK快,在抵御外界刺激如紫外线时,易受外界刺激损伤,而HPK更耐受中波紫外线照射引起的损伤,在细胞自噬水平上两者也不同,HPK的基础自噬水平远高于HaCaT细胞[6]。上述差异说明,HaCaT细胞不能较好地代表人角质形成细胞的正常生理状态。因此,使用HPK能充分模拟人生理条件下的角质形成细胞,在细胞生物学研究中HPK的参考价值更高。
我们前期研究[5]发现,5、10 nmol/L喜树碱可诱导HaCaT细胞发生自噬,对细胞增殖、凋亡无显著影响,50、100、200 nmol/L喜树碱抑制 HaCaT细胞增殖,促使细胞发生凋亡,自噬水平降低。本研究中2、6 μmol/L喜树碱可明显抑制HPK增殖,200 nmol/L喜树碱作用24 h对细胞增殖无显著影响,但作用48h对细胞增殖产生部分抑制。200nmol/L、2μmol/L、6 μmol/L喜树碱作用细胞24 h,均可诱导细胞凋亡。在细胞自噬方面,2 μmol/L、6 μmol/L喜树碱作用24 h可诱导HPK产生自噬,自噬相关LC3蛋白表达量明显增加,p62蛋白水平轻度下降,间接免疫荧光、透射电镜均证明喜树碱可诱导HPK自噬水平升高。p62蛋白是一种支架蛋白,在自噬小体形成过程中其作为连接LC3和聚泛素化蛋白之间的桥梁,通过泛素信号途径将变性蛋白、受损的细胞器以及入侵细胞的微生物转运到自噬小体进行降解[6]。自噬抑制可导致p62聚集,自噬水平升高时p62降解增加,因此p62蛋白的多少可以作为自噬流的测定指标[7]。本研究还表明,HPK基础自噬水平较高,与以往研究一致[8]。喜树碱抑制HPK增殖、诱导凋亡及自噬的药物浓度均较HaCaT细胞(自噬诱导浓度5 ~ 10 nmol/L,凋亡诱导浓度 50 nmol/L)[5]明显增加,提示HPK对喜树碱有较好的耐受性,而HaCaT细胞易受到药物损伤,两者对药物反应性不同。这种差异性与细胞本身性质不同有关。
细胞在正常生理状态下存在一定水平的自噬,以维持细胞内物质的更新,促进细胞内稳态平衡[9]。自噬在维持角质形成细胞正常功能中起重要作用,自噬水平下降可导致角质形成细胞的异常增殖、分化和炎症[3-4,10],而银屑病的发病与角质形成细胞的异常增殖、分化及炎症密切相关。Akinduro等[11]研究发现,自噬在皮肤颗粒层的形成中起关键作用,胎鼠皮肤在颗粒层形成之前,基底层和棘层细胞自噬相关蛋白LC3、自噬相关蛋白1(ATG1)、beclin1、自噬相关蛋白(ATG)5-ATG12复合物表达水平低,而颗粒层的形成伴自噬相关蛋白的显著升高。细胞自噬在角质形成细胞的终末分化中起重要的作用,在角质层细胞核逐渐消失的过程中,核自噬(nucleophagy)是其主要机制之一。研究发现,自噬相关蛋白7(ATG7)缺陷可使角质形成细胞抵抗内外氧化应激功能严重受损,并且导致了DNA损伤[12]。
在角质形成细胞的老化过程中,衰老的细胞并非死于凋亡,而是死于高水平的自噬活动[13-14]。喜树碱可通过抑制端粒酶的活性诱导正常细胞启动凋亡程序,还可通过肿瘤坏死因子α和Fas/Fas L途径诱导肿瘤细胞直接凋亡[15]。在HPK中,喜树碱诱导细胞自噬的同时,细胞凋亡增加,可能出现了自噬性程序性死亡,也可能同时出现了自噬和凋亡。但自噬和凋亡在原代角质形成细胞和HaCaT细胞中的相互关系并不相同。
总之,喜树碱可诱导HPK产生自噬,提高角质形成细胞的自噬水平。然而,喜树碱诱导原代角质形成细胞自噬的机制以及自噬与凋亡的关系有待进一步研究。

