基于实时荧光定量监测逆转录病毒MuLV/Friend感染方法的建立与评价
宋姝庭,孙 丽,蒋金凤,黄 海,王建华
(1. 上海大学生命科学学院,上海 200444;2. 中国科学院上海巴斯德研究所,上海 200031)
MuLV/Friend感染小鼠模型的建立,在研究逆转录病毒致病机制、抗病毒策略评价,以及肿瘤的发生中具有重要的意义。MuLV/Friend感染急性阶段,血液中病毒载量快速上升,引发机体免疫反应以抑制病毒复制,随后,感染进入慢性阶段,在此过程中,病毒整合到宿主基因组中[7]。由于MuLV/Friend与人类免疫缺陷病毒I型(human immunodeficiency virus type 1,HIV-1)病毒复制特性及急性临床症状相似,MuLV/Friend感染的小鼠艾滋病模型被用来研究机体抗逆转录病毒免疫机制,以及用于体内评价抗HIV-1药物的安全性和有效性[8],且因为MuLV/Friend在慢性感染阶段会诱发肿瘤,这一模型也被广泛地应用到探讨肿瘤发生、发展机制及评价治疗策略等方面[4,9-10]。
目前,对于检测病毒的复制主要采用计算病毒感染导致的脾肿大指数(splenic index,SI)的方法[11],该方法不能实时、精确地定量病毒复制及在其它组织中的分布。本研究中,我们建立了一种基于实时荧光定量(qRT)-PCR[12]的病毒复制检测方法,可用于实时定量小鼠各组织内病毒载量,为利用MuLV/Friend小鼠感染模型研究抗逆转录病毒策略或宿主免疫等,提供一种特异、快速、灵敏的监测病毒复制的手段。
1 材料与方法
1.1实验动物MuLV/Friend病毒感染6~8周龄♀ BALB/c小鼠,购自上海灵畅生物科技有限公司,动物合格证号为:SCXK(沪)2013-0018。实验获得中国科学院上海巴斯德研究所动物伦理批件(IPS动伦审第2013014号)。
1.2试剂与仪器戊巴比妥钠(上海隆盛公司);TRIzol试剂(Life Technologies公司);三氯甲烷、异丙醇(上海沪试公司);RNA逆转录试剂盒(TOYOBO公司);DNA聚合酶(Vazyme公司);T4 DNA连接酶(NEB公司);PMD-19T载体(TaKaRa公司);快速质粒小提试剂盒(TIANGEN公司);qRT-PCR TaqMan试剂盒(康为世纪公司)。Prism7900实时荧光定量PCR仪(美国ABI公司)。
1.3qRT-PCR定量标准品的构建MuLV/Friend病毒株由广州中医药大学符林春教授惠赠。TRIzol试剂提取病毒基因组RNA,利用RNA逆转录试剂盒逆转录为cDNA;扩增病毒gag区域,连入PMD-19T载体,构建标准品质粒;利用Nanodrop测量质粒浓度,并根据标准品质粒分子量,计算质粒拷贝数。扩增gag使用上游引物序列为5′-CTCTTTCTCCGAGGACCCAG-3′,下游引物序列为5′-GTCATTGGGCAGCTGAGTTG-3′,合成特异性荧光探针,探针序列为5-Carboxyfluorescein(5-FAM)-ACAGCTTTGATCGAGTCCGTTCTCCT-Carboxytetramethylrhodamine(TAMRA-3)。gag扩增条件为:95℃,10 min,预变性;95℃,15 s,变性;60℃,1 min,退火/延伸,40个循环。
1.4BALB/c小鼠感染、组织RNA的抽取及病毒载量检测6~8周龄BALB/c小鼠饲养于SPF级动物房。BALB/c小鼠腹腔接种MuLV/Friend;感染2、4、5、7、10、12、16、20、28 d后,戊巴比妥钠安乐死,小鼠解剖后获取各组织。将组织充分研磨,50 mg组织加入1 mL TRIzol试剂,充分混匀,室温静置10 min,待组织充分裂解;加入200 μL三氯甲烷,摇晃15 s,室温静置10 min,液体分层; 4℃、12 000×g离心10 min;将上清转入新的EP管中,加入500 μL异丙醇,上下颠倒6~8次,室温静置10 min;4℃、12 000×g离心10 min,弃上清,加1 mL 4℃预冷的75%乙醇;4℃、12 000×g离心5 min,弃上清,待沉淀干燥后,加入适量DEPC水溶解抽提的RNA,并利用Nanodrop测量RNA浓度。利用上述条件,qRT-PCR扩增病毒gag区域,参考标准曲线,定量各组织内病毒载量。
2 结果
2.1qRT-PCR定量标准品的构建利用DNA聚合酶试剂盒扩增病毒gag区域,连入PMD-19T载体,构建标准品质粒;Nanodrop测量质粒浓度,根据标准品质粒分子量,计算出质粒拷贝数,标准品质粒进行10倍比稀释,共7个浓度梯度(Tab 1)。在扩增反应中,qRT-PCR仪检测gag区域探针荧光信号,并获得各浓度标准品的Ct值(Tab 1),该Ct值与各浓度标准品拷贝数的Log值可构建标准曲线(Fig 1A),能够对MuLV/Friend病毒进行定量。核酸电泳验证目的扩增条带的分子量(Fig 1B);以水为模板作阴性对照,扩增所得Ct值为34.3,高于稀释10-10倍的标准品Ct值,因此,利用该建立的qRT-PCR方法,最低可以监测到10-9倍稀释的标准品,其对应的MuLV/Friend拷贝数为1.54×105copies·L-1。该检测方法具有较高的灵敏度。
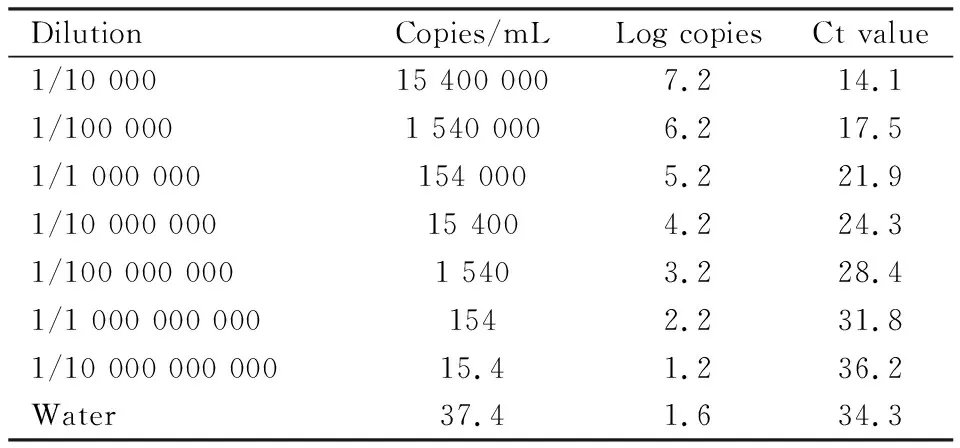
Tab 1 Serial dilution of MuLV/Friend gag standard substanceand summary of Ct values from real-time quantitative RT-PCR
2.2急性感染阶段各组织中病毒分布监测为分析急性感染阶段MuLV/Friend在各组织器官内的分布情况,BALB/c小鼠腹腔接种1×109拷贝数的病毒,感染14 d后,戊巴比妥钠安乐死,解剖后取小鼠的心、肝、脾、肺、肾、肠道、胸腺、脑、十二指肠、空肠、回肠、结肠、直肠、肠系膜淋巴结、payers’淋巴结、血清和白细胞,利用建立的qRT-PCR法,检测各组织器官中gag区域的Ct值,并将所得Ct值引入标准曲线公式,计算可得各组织器官中的病毒载量拷贝数。感染14 d,发现明显的脾肿大(Fig 2A),并发现心、肝、脾、肺、肾、肠道、胸腺、脑、十二指肠、空肠、回肠、结肠、直肠、肠系膜淋巴结、payers’淋巴结、血清和白细胞中,均有不同程度的病毒复制,而血液和脾脏中病毒载量高于其他组织(Fig 2B)。结果表明,感染后14 d,病毒已建立了系统感染,且病毒在血液和脾脏中复制较高。
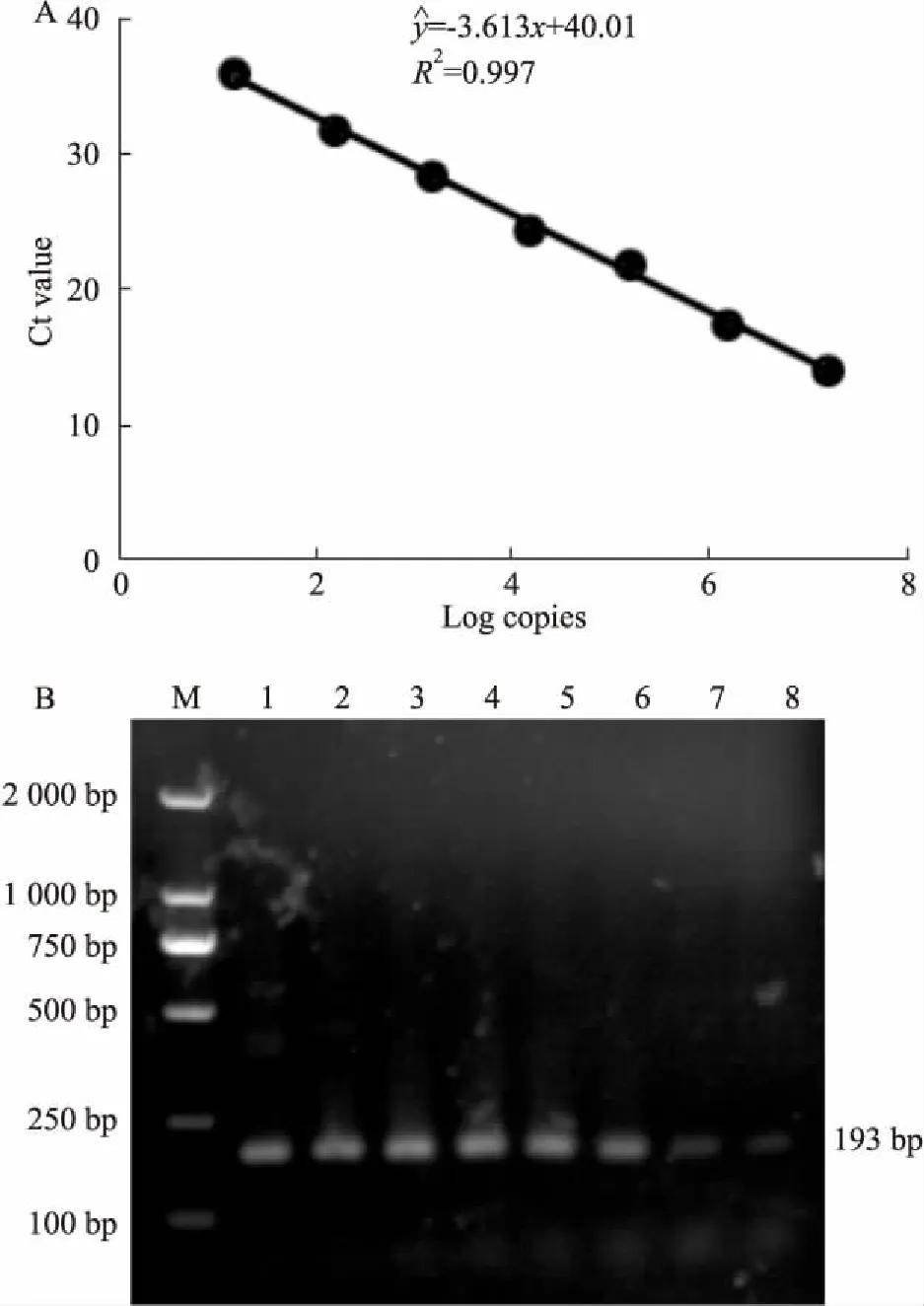
Fig 1 Establishment of standard curve for real-timequantitative reverse transcription PCR assay
2.3急性感染阶段血液和脾脏中病毒复制的动态监测为进一步监测MuLV/Friend急性感染期病毒复制动力学,我们分析了急性阶段脾脏和血液中病毒载量的动态变化。BALB/c小鼠腹腔接种1×109拷贝数的病毒,分别感染2、4、5、7、10、12、16、20、28 d,每组3只小鼠,戊巴比妥钠安乐死,解剖后取小鼠的血液和脾脏,利用qRT-PCR检测法检测血液和脾脏中的gag区域的Ct值,并将所得Ct值引入标准曲线公式,计算后得血液和脾脏中MuLV/Friend的拷贝数(Fig 3)。结果表明,在感染10 d时,病毒载量达到了顶峰,随即下降。
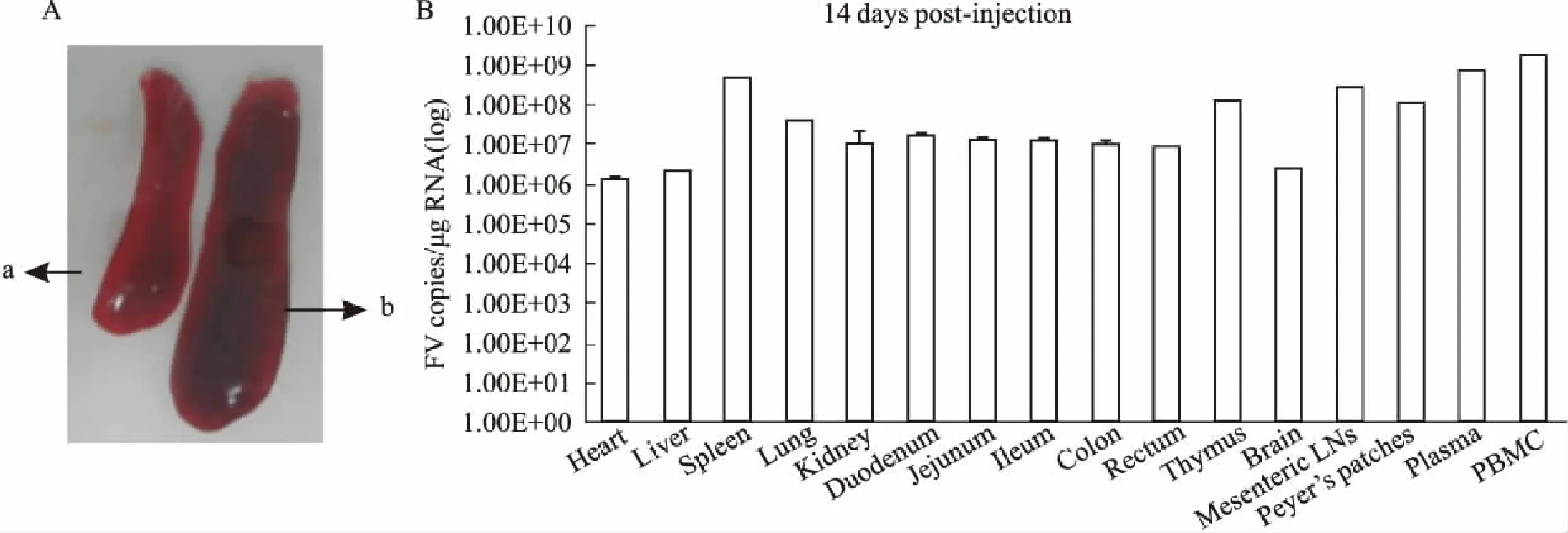
Fig 2 Viral distribution in tissues(n=8)
BALB/c mice were infected via i.p. with MuLV/Friend for 14 d,and the splenomegaly was observed (A). a:mock (PBS) infection;b:virus infection. Viral loads in multiple tissues were quantified (B).
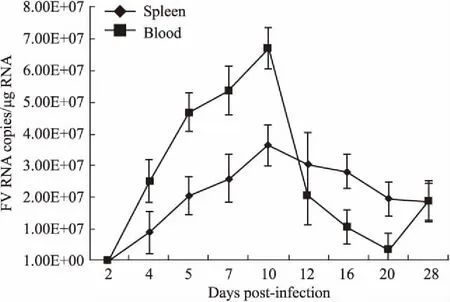
Fig 3 Dynamic kinetics of virus replication
Viral loads in blood and spleen were quantified at the indicated time of post-infection.
3 讨论
MuLV/Friend是一种逆转录病毒,能引起小鼠红白细胞血症,其发病过程与HIV-1引起的人类免疫缺陷综合症相似,常用于感染小鼠建立小鼠艾滋病模型,研究宿主抗病毒反应和评价抗病毒策略[9]。感染初期,MuLV/Friend能促使红系祖细胞在不依赖红细胞生长素情况下在脾脏中大量分化,形成红细胞,导致脾脏肿大[5-6,13]。感染后期,会使原癌基因和抑癌基因发生突变,诱发肿瘤[11]。传统方法主要通过计算脾肿大指数检测病毒复制,但敏感度不够高,结果不够精确,需要建立一种灵敏度更高,且操作简便的方法检测MuLV/Friend 的感染复制。因此,我们构建了基于qRT-PCR的方法,可用于实时监测MuLV/Friend的复制。本研究通过构建MuLV/Friend病毒标准品,并设计病毒gag区域特异性探针,利用qRT-PCR,最低可监测到1.54×105copies·L-1的MuLV/Friend 病毒,相较于过去计算病毒导致脾肿大指数的方法,更为直接和精确,操作也相对简便,为定量分析MuLV/Friend复制提供了有效手段。利用该方法检测感染后d 14各组织器官的病毒载量,发现脾脏和血液中的病毒载量高于其他组织,说明脾脏和血液是MuLV/Friend主要复制位点,提示在分析MuLV/Friend急性感染动力学中,应更多关注脾脏和血液中的病毒复制状况。监测MuLV/Friend急性感染期脾脏和血液中的病毒复制动态曲线,发现病毒载量在感染d 10最高,随后下降,这与之前文献报道相一致[7,14],也说明了该方法的可靠性。
借助MuLV/Friend感染小鼠模型,可研究逆转录病毒感染初期宿主免疫反应。利用该模型已分析了 CD4+、CD8+T细胞及B淋巴细胞在感染中的作用,如CD4+和CD8+T淋巴细胞产生IFN-γ可以抑制病毒复制;CD4+辅助型T细胞和滤泡辅助型T细胞可以增加细胞毒性淋巴细胞(cytotoxic lymphocyte,CTL)反应,促使B细胞产生中和性抗体[7-8,15]。利用MuLV/Friend感染小鼠模型分析逆转录病毒急性感染阶段的宿主免疫反应,与猴免疫缺陷病毒(simian immunodeficiency virus,SIV)感染非人灵长类模型以及病人取材相比,更具有可控性、方便性,因此,这一模型在逆转录病毒感染研究中具有重要的应用意义。
(致谢:感谢广州中医药大学符林春教授惠赠MuLV/Friend病毒株。)