新型PPARγ激动剂CMHX008对高脂饮食诱发的糖尿病肾病的改善作用
刁俊玲,刘灵俪,杜 鹃,李佳渝,李继斌,肖晓秋
(重庆医科大学 1. 附属第一医院重大代谢性疾病转化医学重庆市高校重点实验室、2. 公共卫生与管理学院, 重庆 400016)
糖尿病已经成为影响全球主要的健康问题之一,因肥胖引起代谢性紊乱而诱发胰岛素抵抗是现代人发生2型糖尿病的主要原因[1]。脂质代谢异常和紊乱、炎症因子的上调、氧化应激增多等容易导致糖尿病相关心血管类和肾病疾病的发生[2]。糖尿病肾病(diabetic nephropathy, DN)作为糖尿病最危险的主要并发症之一,与潜在的病理生理机制和糖尿病本身不同的治疗效果有关,其肾损伤与肾脏纤维化的程度相关,而细胞外基质异常沉积容易引起肾脏的纤维化[3],DN影响了30%~40%的II型糖尿病患者[4]。
噻唑烷二酮类(thiazolidinediones, TZDs)药物主要用于增加2型糖尿病患者的胰岛素敏感性。临床实践指南建议指出,TZDs可以用于肾功能受损的糖尿病患者血糖水平的改善[5]。罗格列酮为TZDs的一种过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)完全激动剂,增加胰岛素敏感性的同时,伴随着肾脏对Na+的重吸收而引起水肿的发生[6]。PPARγ受体在肾脏中主要存在于肾小球系膜细胞、肾小管上皮细胞和肾小管间质细胞中,而PPARγ受体的活化在肾脏纤维化中显示出抗纤维化作用[7]。
近年来,临床发现罗格列酮用于糖尿病患者后出现了骨折、心衰、体重增加、水钠潴留等副作用[8]。因此,研究者以PPARγ为靶点进行研究,发现激动能力较弱的 PPARγ激动剂既发挥胰岛素增敏作用,又能减少副反应的发生[9]。本课题组前期合成了TZDs类衍生物——CMHX008(结构式见Fig 1),发现CMHX008激动PPARγ活性弱于罗格列酮,但能够有效降低血糖,增强脂联素的表达水平,以及促进前脂肪细胞分化和细胞内脂质沉淀能力弱于罗格列酮[10],而CMHX008对糖尿病相关的肾损伤的影响尚不清楚。本研究以长期高脂饮食喂养诱发的糖尿病小鼠肾功能损伤为模型,以传统胰岛素增敏药物罗格列酮作为阳性对照,探讨CMHX008是否能够改善DN小鼠的肾脏功能,减弱肾脏纤维化的发生。
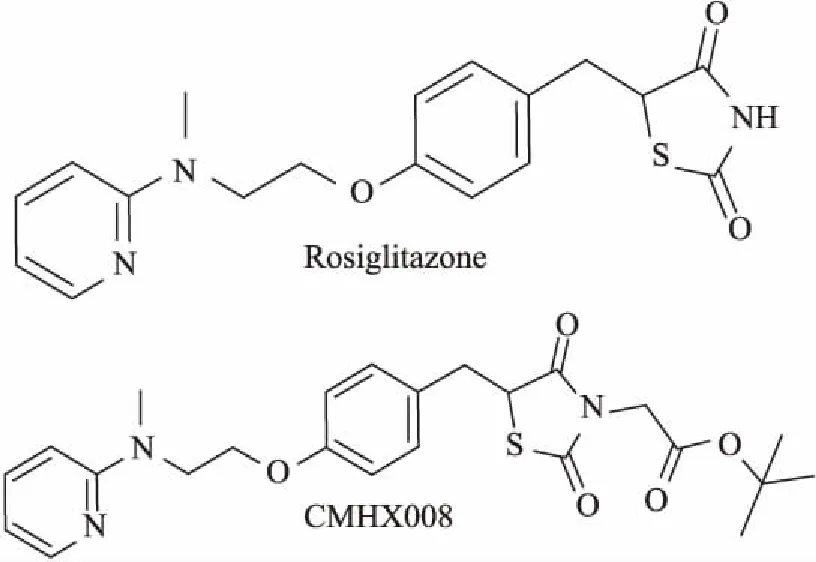
Fig 1 The chemical structure of TZDs rosiglitazone and CMHX008
1 材料
1.1实验动物SPF级♂8周龄C57BL/6小鼠,由重庆医科大学动物实验中心提供,实验动物使用许可证号:SYXK(渝)2017-0023。
1.2试剂低脂饮食(含10 kcal%脂肪)和高脂饮食(含60 kcal%脂肪),购自惠特比科技发展(北京)有限公司;罗格列酮(重庆太极集团);CMHX008(专利号: 201210202455.2)由本校药学院合成,纯度99%;TRIzol(Invitrogen公司,货号15996026);逆转录试剂盒(TaKaRa公司,货号RR037A); SYBER Green(Roche公司,货号06924204001);Masson染液(D026)和天狼星红染色液 (DC0041),购自南京建成科技有限公司;PCR引物由英潍捷基(上海)贸易有限公司合成。
1.3仪器1-15PK型低温离心机(Sigma公司);ND-2000型分光光度计(Thermo Scientific公司);VERITI型梯度PCR仪(Applied Biosystems公司);CFX96型实时荧光定量PCR仪(Bio-Rad公司);DM40008型生物显微镜(Leica公司)。
2 方法
2.1动物模型的建立与分组8周龄SPF级C57BL/6♂小鼠随机分为两组,分别饲以高脂饮食(H)和低脂饮食(L),喂养12周后,将高脂饮食诱发的肥胖小鼠随机分为3组,分别给予溶媒0.8%羧甲基纤维素钠(CMC-Na)(HV组)、罗格列酮(HR组)、CMHX008(HC组);低脂饮食饲养的小鼠给予0.8% CMC-Na作空白对照(LV组)。即共计4组: 低脂空白组(LV)、高脂空白组(HV)、罗格列酮组(HR)、CMHX008组(HC),每组6只,给药方式为灌胃给药(10 mg·kg-1·d-1)[9-10],每日光照时间和黑暗时间均为12 h,室内温度为24℃左右,自由饮水,每周称取小鼠体质量,给药16周后,收集小鼠尿液及血液,离心取上清液,保存待用。
2.2常规光镜检查肾组织经4%多聚甲醛固定后,常规脱水包埋,切成4 μm厚的切片备用。将石蜡切片60℃烤箱烘烤4 h后,依次放入二甲苯(2次,每次30 min)、梯度乙醇(100%、95%、85%、75%,各5 min)中,经蒸馏水冲洗后,用苏木精-伊红染色(hematoxylin-eosin staining,HE) 在镜下观察组织形态变化,Masson及天狼星红染色观察肾脏肾小管间质及肾小球区域纤维化存积情况。
2.3生化检测处死前收集小鼠24 h尿液,离心后,取上清液于-80℃保存。小鼠乙醚麻醉后,眼眶取血,将血液离心后,取上清液于-80℃保存。将尿液和血液样本送检于重庆医科大学附属儿童医院检验科,全自动生化检测仪检测小鼠尿液中的Na+、K+、尿蛋白(urine protein,Upro)、尿肌酐(urine creatinine, UCr)、尿素氮(blood urea nitrogen,BUN),以及血清中的血肌酐(serum creatinine,Scr)、BUN、胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白(low-density lipoprotein, LDL)、高密度脂蛋白(high-density lipoprotein, HDL)的浓度,并进行分析。
2.4实时荧光定量PCR取小鼠肾脏组织,剪碎后,加入TRIzol裂解液进行匀浆裂解,提取总RNA,用分光光度计检测RNA浓度。采用20 μL逆转录体系于梯度PCR仪进行逆转录,并获得模板cDNA,加入180 μL DEPC水,补齐至200 μL。取2.5 μL cDNA,加入5 μL SYBER、1.5 μL DEPC水、上下游引物各0.5 μL,补齐至10 μL,于RT-PCR仪中进行扩增。PCR扩增目的基因上、下游引物序列见Tab 1。
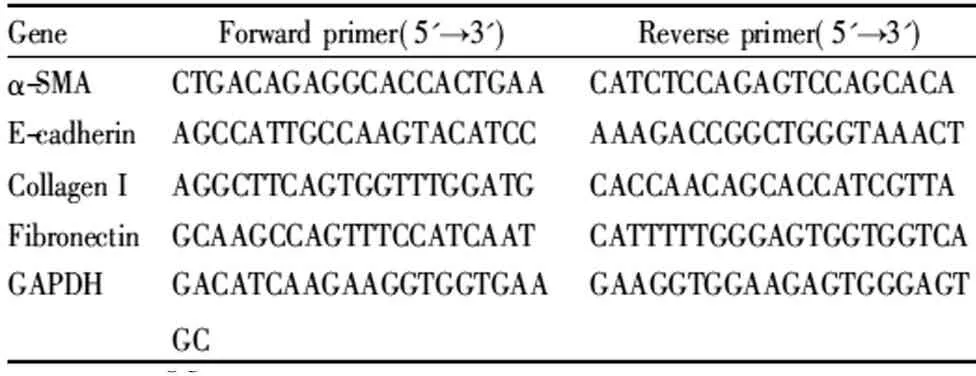
Tab 1 Primer sequence for real-time RT-PCR
3 结果
3.1CMHX008对糖尿病小鼠肾脏的损伤有明显的改善作用前期研究表明[10],高脂饮食喂养后,小鼠显示出2型糖尿病的糖耐量受损和胰岛素抵抗这两个主要特征,CMHX008给药后的小鼠体质量较高脂组明显降低。通过各组间肾脏组织重量的比较发现,HV组肾重明显高于LV组(P<0.05), HR组肾重明显高于HV组(P<0.01),HC组肾重与HV组差异无统计学意义(Fig 2A)。而肾重比结果显示,各组间差异无统计学意义,可能是由于我们所观察的DN处于早期阶段,肾重比结果不明显(Fig 2B)。肾脏对Na+的重吸收为水钠潴留的主要特征[9],全自动生化分析检测结果显示(Tab 2),与LV组比较,HV组小鼠尿液Na+浓度明显降低(P<0.05);与HV组比较,HR组Na+浓度无明显改善,HC组Na+浓度明显增加(P<0.01)。

Fig 2 Comparison of the kidney mass(A) and ratio of
*P<0.05vsLV group;##P<0.01vsHV group
肾损伤通常是无症状的,表现为蛋白尿、血尿或者肾小球滤过率(glomerular filtration rate, GFR)的减少[2]。Tab 2、3结果表明,与LV组比较,HV组小鼠Upro浓度、Upro/Cr比值、Scr浓度明显上升(P<0.05,P<0.01),表明长期高脂饮食喂养会影响小鼠肾脏对Upro、Scr的排泄,造成肾脏的损伤。通过16周的长期给药,与HV组比较,HR组、HC组Upro浓度减少约40%、50%;HR、HC组Upro/Cr比值均减少约50%(Tab 2)。分析小鼠血清各指标结果显示(Tab 3),与HV组比较,HR组Scr浓度明显增加(P<0.01),而BUN的浓度较HV组差异无显著性;HC组BUN、Scr浓度明显降低,表明CMHX008较罗格列酮能更加有效降低血清中BUN、Scr水平。结果表明,罗格列酮和CMHX008对高脂诱发的2型糖尿病小鼠肾功能受损有改善作用,CMHX008较罗格列酮改善更为明显。
3.2罗格列酮和CMHX008能够减少高脂饮食诱发的2型糖尿病小鼠肾脏胶原纤维的沉积本研究通过28周高脂喂养C57BL/6小鼠后,肾脏组织HE染色发现,糖尿病模型HV组肾脏组织管腔增大,肾小管上皮细胞空泡变性,HR和HC给药组肾小管显示出明显的改善。天狼星红染色和Masson染色观察发现,HV组肾小球及肾小管间质的胶原纤维较LV组明显增多,与HV组比较,HR组、HC组肾间质纤维化面积明显减少,HC组胶原纤维较HR组也有所减少(Fig 3)。结果表明,罗格列酮、CMHX008能够明显改善肾损伤,减缓糖尿病小鼠肾脏的纤维化进程。
3.3罗格列酮和CMHX008对肾脏纤维化的改善作用可能与肾小管上皮细胞表型转化的减弱有关检测肾脏组织中相关分子mRNA相对表达量发现(Fig 4),与LV组比较,HV组间基质α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、I型胶原(Collagen I)、纤连蛋白(fibronectin,FN)mRNA表达明显上调,上皮标志蛋白E-钙蛋白(E-cad )mRNA表达明显下调;与HV组比较,HR组α-SMA、Collagen Ⅰ、FN mRNA的表达明显下调,E-cad mRNA表达明显上调,HC组α-SMA、Collagen I、FN mRNA表达明显下调,E-cad mRNA的表达明显上调,其中HC组Collagen I表达下调比HR组更为明显(P=0.05)。结果表明,与高脂空白组比较,罗格列酮和CMHX008给药后小鼠肾脏中间基质成分α-SMA、Collagen I、FN mRNA表达下调,而上皮组织中E-cadmRNA表达上调,提示纤维化的改善可能是由于肾小管上皮细胞的表型转化(epithelial-mesenchymal transition,EMT)的减弱所导致的。
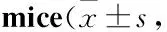
Tab 2 The analysis of related indices detection in urine of C57BL/6 n=4~5)
*P<0.05,**P<0.01vsLV group;#P<0.05,##P<0.01vsHV group
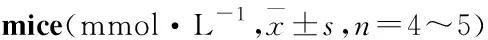
Tab 3 The analysis of related indices detection in serum of C57BL/6
*P<0.05,**P<0.01vsLV group;#P<0.05,##P<0.01vsHV group
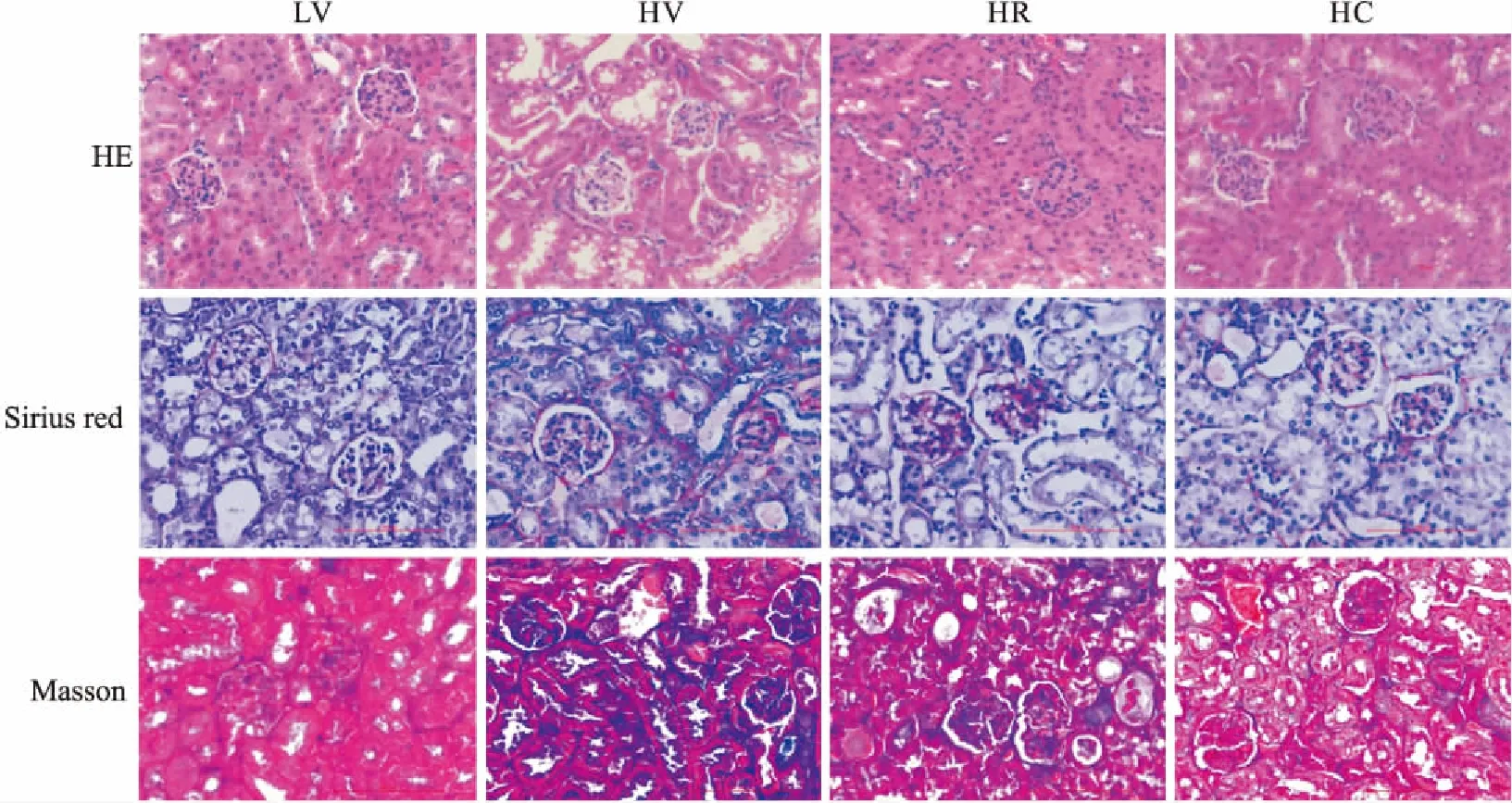
Fig 3 HE, Sirius red and Masson’s trichrome staining of kidney tissues(×400)
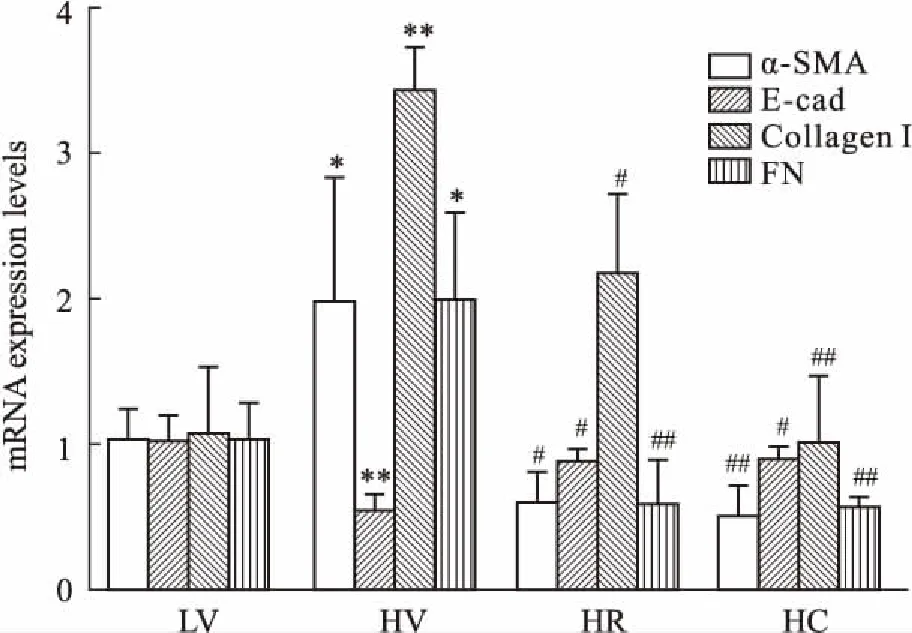
Fig 4 mRNA levels of tubule EMT n=3~5 )
*P<0.05,**P<0.01vsLV group;#P<0.05,##P<0.01vsHV group
4 讨论
据报道,使用罗格列酮后常见的不良反应有体重增加、水肿、骨量丢失、心衰等[8]。目前已有研究证明,肥胖糖尿病患者体重减轻后,蛋白尿明显减少,对肾功能的改善是有益的[11]。研究发现,CMHX008给药后,小鼠体质量明显低于高脂饮食小鼠[10]。Wang等[12]通过系统分析DN患者服用TZDs的安全性,发现TZDs会增加糖尿病患者水肿的风险。而Na+重吸收的增加是导致水肿的主要原因[6]。本研究中,尿液Na+浓度检测结果显示,CMHX008能够明显降低2型糖尿病小鼠肾小管对Na+的重吸收,而罗格列酮处理后的肥胖小鼠尿液中Na+浓度无明显改善。
DN是一种缓慢进程性的疾病,长期肥胖不仅影响2型糖尿病的发展,对肾脏也有明显的影响[13]。DN以蛋白尿增加和肾功能减退为主要特征[14]。因此,本研究采用高脂饮食长达28周喂养,模拟人的脂质代谢紊乱引起糖耐量受损和胰岛素抵抗为主要特征的2型糖尿病模型,通过HE染色发现,高脂空白组肾小管上皮细胞空泡变性,尿蛋白、血肌酐和胆固醇明显升高,有明显的肾损伤。指南指出,TZDs类是活化PPARγ受体的降糖药物,主要由肝脏代谢,伴有肾损伤的糖尿病患者服用TZDs不需要调整剂量,可能对肾脏有一定的保护作用[15]。本研究从组织形态学方面的观察发现,罗格列酮和CMHX008对高脂诱发的糖尿病小鼠肾小管损伤有明显的改善作用。生化检测结果显示,罗格列酮和CMHX008给药后肾功能有一定的改善,并且CMHX008对高脂诱发的糖尿病肾损伤有更好的改善作用。
Zhao等[7]通过特异性敲除肾近端小管上皮的PPARγ受体的小鼠模型发现,敲除PPARγ会加剧EMT的发生,激动PPARγ则可改善肾脏的纤维化。本实验通过天狼星红、Masson染色观察了糖尿病小鼠模型给药后肾小球和肾间质纤维化的存积情况,证明了罗格列酮和CMHX008都能有效改善糖尿病小鼠肾脏的纤维化存积,其中CMHX008改善效果更为明显。近年来有研究发现,肾小管间质纤维化主要是由病理损伤的肾小管上皮细胞向成纤维细胞的表型转化,而转化后的细胞能够向间质区浸润迁移,分泌细胞外基质(extracellular matrix, ECM),促进纤维形成,上皮细胞的表型转化涉及到上皮蛋白(E-cad、紧密连接蛋白ZO-1、细胞角蛋白)的消失,波形蛋白(Vimentin)、α-SMA、间基质成分I型胶原和纤维连接蛋白等新的间充质标志物的增加[3]。 因此,我们通过实时荧光定量PCR实验检测了EMT相关的分子mRNA的表达。结果显示,DN小鼠模型在给予罗格列酮和CMHX008后,间充质标志物α-SMA、Collagen Ⅰ、FN mRNA的表达明显下调,小管上皮E-cad mRNA的表达明显上调。提示罗格列酮和CMHX008可能是通过减少EMT的发生,进而改善糖尿病相关肾脏的纤维化。
本研究证明了PPARγ完全激动剂罗格列酮和部分激动剂CMHX008能明显减少对Na+的重吸收,减弱2型糖尿病肾病小鼠肾脏的纤维化存积,对高脂诱导的糖尿病小鼠肾脏功能损伤有明显的改善作用。伴有肾脏疾病、肥胖等高危因素的糖尿病患者使用罗格列酮可能引起不适,而CMHX008在增加胰岛素敏感性、维持体内葡萄糖稳态以及不增加体重的同时,对肾脏有明显的保护作用。因此,CMHX008作为一个潜在的新药在未来的糖尿病患者的治疗中具有非常重要的意义。
(致谢:本实验在重庆医科大学附属第一医院重大代谢性疾病转化医学重庆市高校重点实验室完成,在此衷心地感谢实验室的所有老师和同学们的帮助!)