下丘脑室旁核胶质细胞活化在大鼠炎性痛调节过程中的作用
陈彬彬,孟 娜,黄思婷,花景煜,孙国林,陈盼盼,章功良,张咏梅
(1. 江苏省麻醉学重点实验室,徐州医科大学麻醉学院,江苏 徐州 221002;2. 安徽医科大学基础医学院,安徽 合肥 230032)
研究表明,中枢神经系统胶质细胞活化参与外周炎症性疼痛反应[1],而长期以来,胶质细胞被认为是神经元的间质细胞或支持细胞。近年来发现,胶质细胞的激活对炎症性疼痛的发生和发展发挥了重要作用,它们的激活可以分泌多种致痛物质,增强外周有害刺激激活的神经元疼痛信号传导[2]。小胶质细胞是中枢免疫反应效应细胞,其分支状突起可即时感知周围环境的变化,对脑组织内的微小病理变化即发生强烈反应,在自闭症[3]、阿尔茨海默病[4]、Rett综合征[5]等神经发育障碍性疾病中发挥重要作用,其激活时不仅可以释放出经典的神经、胶质活性物质,还可以释放出促炎或抗炎细胞因子,并且在疼痛信号传递过程中发挥重要作用[6]。星形胶质细胞与神经元以及突触紧密接触,这不仅可以支持和营养神经元,而且在调节突触传递过程、神经元胞外化学环境稳定方面发挥重要作用[7]。传统研究认为,慢性疼痛的产生是由于神经元可塑性改变引起的外周和中枢敏化作用,本课题组前期研究发现,下丘脑室旁核小胶质细胞活化可能参与了新生期母婴分离致成年小鼠内脏痛敏反应[8]。因此,胶质细胞在慢性疼痛易化过程中同样起着重要作用,而室旁核胶质细胞活化参与炎性痛反应的研究甚少。
炎症性疼痛是一种组织损伤性应激反应,下丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)在应激及疼痛调节中发挥着重要的作用[9]。本研究采用完全弗氏佐剂(complete Freund’s adjuvannt,CFA)诱导的炎性痛模型,采用免疫荧光方法检测炎性痛条件下,PVN中小胶质细胞和星形胶质细胞活化情况,进一步通过小胶质细胞特异性抑制剂米诺环素作用后,观察其热痛行为学改变,为进一步理解炎性痛的发病机制及探讨室旁核胶质细胞活化在炎性痛过程中的作用提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 健康成年SD大鼠34只,♂,体质量230~250 g,由山东济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)20140007。大鼠置于昼夜(12 h/12 h)节律光照条件下,室温(23±1)℃,自由饮水和摄食,所有大鼠实验前静养1周。所有实验均遵守《实验动物使用规范》。
1.1.2试剂与仪器 钙离子接头蛋白1(ionized calcium binding adaptor molecule-1,Iba1)抗体(lot:GR264097-1)购自Abcam公司;胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(lot:2110541)购自Millipore;米诺环素(lot # BCBG8005V)、CFA均购自Sigma。热痛敏刺激仪(IITC series 8-390)购自中国医学科学院生物工程研究所。
1.2CFA炎症性疼痛模型的制备及实验分组轻轻固定大鼠,用微量注射器吸取100 μL CFA注入大鼠左侧后肢足底中心皮下,建立炎症性疼痛模型;生理盐水对照组于相同位置注射100 μL生理盐水。模型建立成功的标志为大鼠局部出现典型的外周炎症症状,包括注射局部红、肿以及疼痛表现等,持续时间超过1周。
将SD大鼠随机分为两组:生理盐水对照组(Control)组,即0.9% NS(100 μL)皮下注射;CFA组即CFA皮下注射,注射部位均为左后肢足底中心皮下。根据免疫荧光结果,在CFA炎症性疼痛模型建立后,对大鼠进行PVN给药,分为室旁核微量注射生理盐水(NS)组和给药(米诺环素)组,每组6只大鼠,NS组为PVN微量注射0.9% NS 0.5 μL;米诺环素组为微量注射米诺环素(0.4 g·L-1)0.5 μL。
1.3PVN注射CFA致炎后d 1、6,大鼠七氟烷吸入麻醉后,头部固定于大鼠脑立体定位仪上,暴露颅骨,30% H2O2清洁颅骨表面,参考Watson &Paxinos大鼠脑图谱,结合本课题组对大鼠(230~250 g)PVN核团定位摸索,确定核团坐标为:ML=±0.4 mm,AP=-1.4 mm,DV=7.7 mm[9]。用针尖外径为0.3 mm的微量注射器向核团内注射,1 min内注射完毕,留针5 min以防药液反流,统一选取右侧PVN进行注射:米诺环素(0.4 g·L-1)0.5 μL。注射后0.5、1、2、3、4 h检测热痛阈。
1.4热缩足反射潜伏期(thermalwithdrawallatency,TWL)测定在同一时间段、同一室温、同一湿度下进行测定。按照Hargreaves法,将大鼠放置于3 mm厚的15 cm×15cm×15 cm的有机玻璃箱中,待大鼠在其中适应30 min安静后,用热痛敏刺激仪照射大鼠左后肢足底后外侧。从照射开始至大鼠出现抬腿回避的时间为TWL;光源刺激强度恒定不变,自动切断时间为25 s,以防止组织损伤。每只动物连续测定5次,测量间隔3 min,取其中3次比较平稳的数据平均值为大鼠TWL。
1.5免疫荧光(immunofluorescence,IF)检测10%水合氯醛(3 mL·kg-1)大鼠腹腔注射麻醉后,灌注取脑,放入4%的多聚甲醛中,于4℃固定4~6 h,然后放入30%蔗糖中大约2 d,待组织块沉底后,作冰冻冠状连续切片,片厚30 μm,切片PBS漂洗后,放入一抗Iba1(1 ∶200)、GFAP(1 ∶200)中,4℃孵育过夜,TBS漂洗3次后,加入相应的二抗,避光常温孵育2 h,TBS漂洗后贴片,荧光共聚焦显微镜下观察,拍片。Image-Pro Plus软件分析计算室旁核Iba1和GFAP阳性表达的细胞数目。
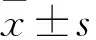
2 结果
2.1CFA炎性痛大鼠PVN小胶质细胞和星形胶质细胞的活化情况如Fig 1所示,与对照组相比,CFA炎性痛大鼠PVN小胶质细胞于d 1开始明显活化,于d 14仍处于活化状态(P<0.01);星形胶质细胞于d 3开始明显活化,于d 14同样处于活化状态(P<0.01)。
2.2CFA炎性痛急性期PVN注射米诺环素对热痛行为学的影响CFA炎性痛大鼠于d 1急性期,PVN内微量注射小胶质细胞特异性抑制剂米诺环素(0.4 g·L-1)0.5 μL 2 h后,活化的小胶质细胞受抑制程度最大,且所需米诺环素剂量最低(Fig 2A),因此,认为此剂量为药物的最适剂量。与NS组相比,米诺环素组大鼠的TWL于1、2、3 h明显升高(P<0.05),于4 h衰减到给药前水平(Fig 2B)。
2.3CFA炎性痛慢性期PVN注射米诺环素对热痛行为学及胶质细胞活化的影响CFA炎性痛大鼠于d 6进入慢性期,PVN内微量注射米诺环素后,与NS组相比,米诺环素组大鼠的TWL无明显变化(Fig 3A);并在给药后2 h,室旁核小胶质细胞活化明显被抑制,星形胶质细胞仍处于活化状态(Fig 3B)。
3 讨论
以往研究表明,在疼痛调节过程中,神经元及神经环路发挥了重要作用,而胶质细胞只起着支持、营养神经元的作用。然而,最近的研究表明,胶质细胞在疼痛调节过程中同样发挥了重要作用,比如伤害性刺激激活外周感觉神经元,进一步传入脊髓,可致脊髓小胶质细胞膜上嘌呤受体P2X4R表达上调,从而促进胞内信号分子传导,增加脑源性神经营养因子BDNF的释放,释放的BDNF可促进脊髓Ⅰ层神经元过度兴奋,增强疼痛反应[10];星形胶质细胞可以通过胞内激酶、缝隙连接通道、胞膜受体、转运体以及释放的炎症介质等,参与疼痛调节反应,并且这一作用主要与慢性疼痛的维持有关[11]。
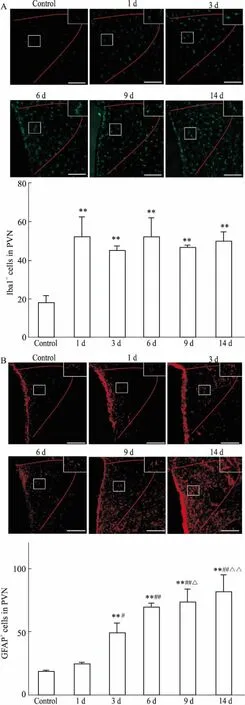
Fig 1 Activation of microglia(A) andastrocytes(B) in PVN in CFA treated rats
**P<0.01vscontrol;#P<0.05,##P<0.01vs1 d group;△P<0.05,△△P<0.01vs3 d group
Fig 2 Changes of activation of microglia and TWL afterinjecting microglia specific inhibitor minocycline in PVN onthe 1st day post CFA injection
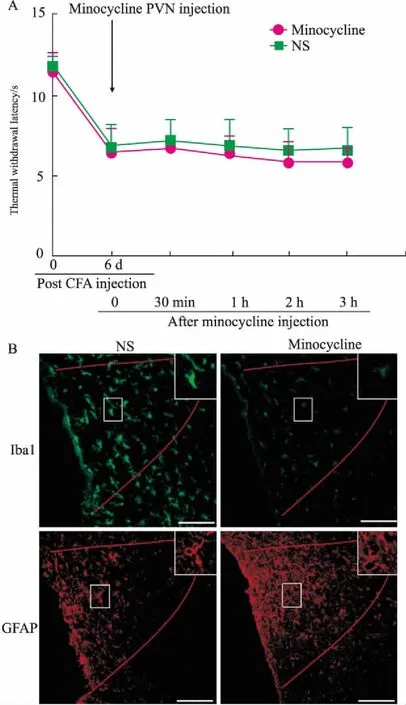
Fig 3 Changes of TWL and activation of microgliaand astrocytes after injecting minocyclinein PVN on the 6th day post CFA injection
本课题组前期研究发现,PVN小胶质细胞胞膜上Toll样受体4(Toll-like receptor 4,TLR4)参与新生期母婴分离致成年小鼠慢性内脏痛的过程。这一作用可能和生命早期应激致成年小鼠室旁核小胶质细胞活化有关,活化的小胶质细胞可以释放大量IL-1β、TNF-α等炎症因子,可致大脑区域性对氧化应激产生易感状态,敏化促肾上腺皮质激素释放激素(corticotropin releasing factor,CRF)神经元,进而激活下丘脑-垂体-肾上腺轴,参与内脏痛敏反应[8]。虽然中枢神经系统胶质细胞参与疼痛的调节有很多报道,但室旁核中表达的胶质细胞对炎症性疼痛的调节作用还知之甚少。本研究中,通过CFA足底注射后,可诱导明显的炎性痛模型,并在急性期d 1,室旁核小胶质细胞明显活化,一直持续到d 14仍处于活化状态;d 3进入亚急性期,室旁核星形胶质细胞开始明显活化,持续到d 14同样仍处于活化状态,这与有关报道小胶质细胞激活早于星形胶质细胞的结论相一致[12]。实验于致炎后d 1,室旁核微量注射小胶质细胞特异性抑制剂米诺环素后,小胶质细胞活化明显受到抑制,且可明显减轻大鼠热痛敏反应,说明小胶质细胞参与调节了炎症性疼痛急性期热痛敏反应。致炎后d 6,进入慢性期,室旁核微量注射米诺环素后,小胶质细胞活化同样明显受到抑制,但不能明显减轻大鼠热痛敏反应,而此时星形胶质细胞仍处于明显活化状态。因此认为室旁核小胶质细胞激活可能主要参与炎性痛敏的形成,而在慢性期小胶质细胞仍处于持续活化状态,可能与此时星形胶质细胞的持续活化刺激有关,同样持续活化的小胶质细胞也可以通过分泌相关炎性因子,促进星形胶质细胞的持续激活,且星形胶质细胞的持续激活对炎性痛敏的维持可能更具意义。
PVN在应激及疼痛调节中发挥了重要作用[9],当CFA致炎后,外周伤害性刺激激活信号传入中枢,在急性期,可诱发PVN小胶质细胞活化,活化的小胶质细胞可大量释放IL-1β、IL-6、TNF-α等促炎因子或趋化因子,促使室旁核神经元激活,导致室旁核对外周炎症性痛刺激反应性增强。在亚急性期,室旁核星形胶质细胞明显活化,活化的星形胶质细胞不仅可以分泌炎症介质和兴奋性神经递质,如谷氨酸、乙酰胆碱等,兴奋邻近的神经元,而且可以包裹神经元突触,与神经元突触产生有效的直接联系,调节神经元突触传导作用[13]。并且当疼痛相关神经递质激活星形胶质细胞时,激活的星形胶质细胞可以通过大量的缝隙连接,以钙波形式向外传播,激活邻近或者远处的星形胶质细胞,促使痛相关神经递质大量释放,调节疼痛反应[14],这可能与星形胶质细胞参与慢性疼痛过程的维持有关。本研究将为临床炎性痛的治疗提供一定的理论基础和治疗靶点。