对乙酰氨基酚对不同妊娠期小鼠肝肾功能的影响及机制研究
俸 珊,俸 娜,付玉颖,邹 利,刘 珂,任 巧,徐晓玉
(1. 西南大学药学院,重庆 400715;2. 成都市青白江区人民医院重症监护病房,四川 成都 610300)
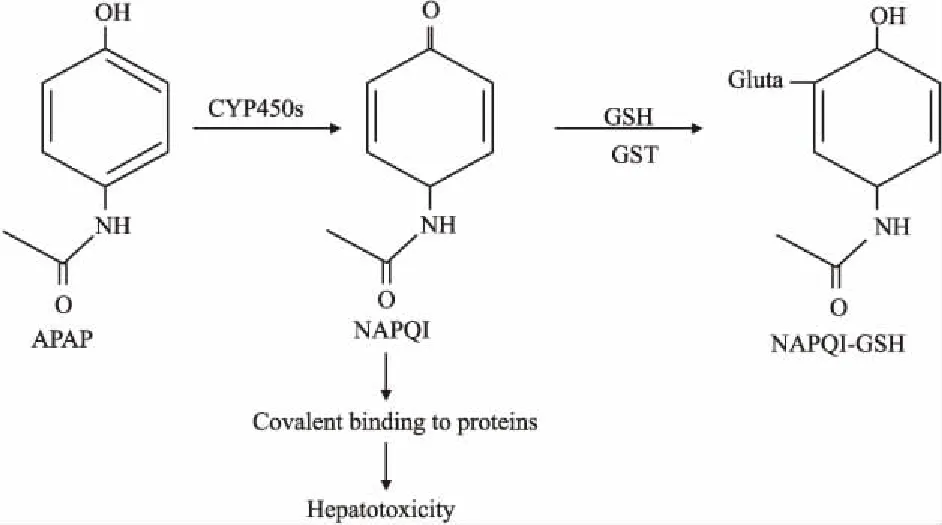
Fig 1 Formation of reactive NAPQI from APAP and relatedmechanism for induced hepatotoxicity
妊娠后,体内激素水平会随着妊娠周期有所波动,而该波动会影响肝脏CYP450s活性水平。研究显示,妊娠期间肝脏CYP2C9、2D6、2E1、3A的活性均会上调[3-4],故孕期用药药物药代动力学参数的变化一直是研究的热点。早在1986年,Miners等[5]便报道了孕期APAP的口服清除率较非孕期高58%。随后Larrey等[6]也发现,给予妊娠17~18 d小鼠400 mg·kg-1APAP后,24 h小鼠肝脏转氨酶水平升高。Neto等[7]于2004年报道了长期给予妊娠大鼠1 500 mg·kg-1APAP(从妊娠d 1到妊娠结束)后,母体及胎儿的肝脏和肾脏均有明显损伤。Thiele等[8]发表的荟萃分析也表明,过量APAP对妊娠期母体和胎儿均存在较大风险。FDA颁布的妊娠用药指南中,将APAP纳入B级(B级:副作用在动物繁殖性研究中得到证实,而不曾在已妊娠3个月的孕妇中证实)。Franko、Thornton等[9-10]分别在2013和2012年报道了妊娠中期孕妇过量服用APAP导致肝移植的病例,APAP孕期安全性评价又重新引起关注[11]。目前并无直接证据表明妊娠中期和晚期肝脏对APAP的耐受性有差异,同时,肾脏作为APAP的主要排泄器官,单剂量APAP是否会引发孕期肾损伤也未知。鉴于APAP妊娠用药的生殖毒性,以及对子代行为学影响已研究较多,本研究将主要关注 APAP 500 mg·kg-1(正常小鼠的最大可耐受剂量[8])对不同妊娠时期(未妊娠时期、妊娠中期、妊娠晚期)母鼠肝肾功能的影响,同时探究相关机制。
1 材料与方法
1.1材料
1.1.1试剂 APAP购于中国食品药品检定研究院, 纯度>99%;谷丙转氨酶 (alanine aminotransferase, ALT)、谷草转氨酶 (aspartate aminotransferase, AST)、碱性磷酸酶 (alkaline phosphatase, ALP)、肌酐(creatinine,Cre)、尿素氮(urea nitrogen, BUN)、超氧化物歧化酶(superoxide dismutase, SOD)、GSH、丙二醛 (malondialdehyde, MDA) 测定试剂盒,均购自南京建成生物工程研究所。
1.1.2实验动物 SPF级昆明小鼠120只,体质量 (20 ± 2) g,购自重庆中药研究院,生产许可证号:SCXK(渝)2017-0003。
1.1.3仪器 API 4000 Qtrap(2台岛津LC-20AD泵,ESI接口离子源,Analyst Software 1.5.1色谱工作站);BS-220全自动生化分析仪(深圳迈瑞);超高速离心机(美国Thermo Scientific 公司)。
1.2孕鼠的制备将♀鼠和♂鼠按照2 ∶1合笼饲养,并于合笼后的每日清晨、中午及晚上检查♀小鼠是否出现阴栓(作为判断受孕的直接证据);同时做阴道涂片观察小鼠的动情周期。阴栓是小鼠在交配后形成的白色浆状物质,堵塞于阴道腔内,是动物已交配的标志,本研究将阴栓出现当天作为妊娠“0 d”。
1.3实验分组实验分为未妊娠组、妊娠中期组(受孕后7~15 d,本实验采用受孕后10 d小鼠)、妊娠晚期组(受孕后15~21 d,本实验采用受孕后18 d小鼠)。灌胃给予上述各组小鼠APAP 500 mg·kg-1,并于给药后0(不同妊娠期各自空白对照组)、6、24、48 h后取材。给药结束后,动物禁食不禁水,并于各时间点摘眼球采血,进行血清生化指标检测。同时取部分肝、肾组织,固定于4%多聚甲醛溶液中,以备后续病理切片。其余的肝组织-80℃冰箱保存待用。
1.4血清生化指标的检测ALT、AST、ALP、Cre、BUN等血液生化指标采用全自动生化分析仪检测。
1.5肝、肾组织氧化应激指标的检测肝、肾组织中SOD、GSH、MDA 含量按照南京建成试剂盒说明书测定。
1.6肝、肾组织HE病理切片制备将固定液中肝、肾组织石蜡包埋, 切片, 苏木精-伊红 (hematoxylin-eosin, HE) 染色后, 光学显微镜下观察病理学变化。
1.7小鼠肝微粒体的制备每份肝、肾取0.1 g,即每组各0.5 g,加入3倍体积冰冷的PBS匀浆,3 500 r·min-1离心30 s(离心2次)。弃去沉淀和上层白色物质。将上清液装入特制离心管中,PBS配平至误差在0.01 g以内,超高速离心(105 000×g,60 min),所得沉淀用pH 7.4的Tris缓冲液重悬浮,得到肝微粒体溶液,BCA试剂盒法测定其蛋白含量。
1.8“Cocktail”探针法检测CYP450s活性[12]向50 μL探针药物(其中右美沙芬2.5 μmol·L-1、非那西丁10 μmol·L-1、甲苯磺丁脲100 μmol·L-1、氯唑沙宗20 μmol·L-1、咪达唑仑5 μmol·L-1)中加入50 μL的小鼠肝微粒体(0.5 g·L-1),接着加入100 μL NADPH(1 mmol·L-1) 启动反应,37℃孵育15 min。反应结束后,加入2倍体积冰甲醇(含有75 μg·L-1内标卡马西平)终止反应。10 000 r·min-1离心10 min,LC-MS/MS“Cocktail”探针法分析上清液[12]。
1.9NAPQI-GSH结合物测定[13]100 μL 10%组织匀浆+400 μL甲醇沉淀,13 000 r·min-1离心5 min,取上清LC-MS/MS分析。流动相:A:水(0.1%甲酸),B:乙腈(0.1% 甲酸);色谱柱:Agilent ZORBAX XDB-C18,3.5 μm,2.1 mm×50 mm Part No. USHP004814;柱温:30℃;流速:0.5 mL·min-1;进样量:10 μL;梯度洗脱(A:0 min→4 min, 98%→2%),ESI+,MRM模式监测离子对457.1/328.1。
2 结果
2.1APAP对不同妊娠期小鼠肝脏组织病理学的影响如Fig 2所示, 当给予各组小鼠500 mg·kg-1APAP后,未妊娠组小鼠在0、6、24、48 h的肝细胞排列正常,门管区未见炎细胞浸润。妊娠中期小鼠肝小叶在6 h时出现炎细胞浸润;24 h时肝小叶结构模糊, 小叶内肝细胞水肿且胞质淡染;48 h时少量肝细胞排列混乱。妊娠晚期小鼠仅在6 h时观察到肝小叶内有少量炎细胞浸润,其余时间点的小叶内肝细胞基本正常。结果提示,在给予同等剂量的APAP后,妊娠中期小鼠出现了轻微的肝细胞损伤,但在48 h时损伤开始恢复。而未妊娠和妊娠晚期小鼠均未出现明显的肝组织损伤病理学变化。
2.2APAP对不同妊娠期小鼠肝脏转氨酶水平的影响如Fig 3A~3C所示, 当给予各组小鼠500 mg·kg-1APAP后,未妊娠组和妊娠晚期组小鼠在0~48 h内的血清ALT、AST、ALP水平均无明显波动,而妊娠中期组这3个转氨酶水平在6 h时明显升高(P<0.01),随后在24~48 h内又恢复到正常水平。值得注意的是,妊娠中期组和妊娠晚期组小鼠血清ALP水平的基础值(0 h)均明显低于未妊娠组(P<0.01)。
2.3APAP对不同妊娠期小鼠肝脏组织氧化应激水平的影响如Fig 3D~3F所示, 当给予各组小鼠500 mg·kg-1APAP后,小鼠肝组织MDA水平变化趋势在3组中基本一致:在24 h时明显升高(P<0.01),在48 h时又恢复到正常水平。SOD水平变化:未妊娠组在0~48 h内有升高趋势;妊娠中期组则是先升高后降低(0~6 h升高,12~48 h降低);而妊娠晚期组则无明显波动。值得注意的是,妊娠中期和晚期组小鼠血清SOD水平的基础值(0 h)均明显高于未妊娠组(P<0.01)。GSH水平变化:未妊娠组小鼠在0~6 h出现短暂降低后,又于12~48 h内恢复到正常水平;妊娠中期组小鼠则是在0~48 h内持续降低;而妊娠晚期组小鼠在0~48 h内无明显波动。值得注意的是,妊娠中期组小鼠血清GSH水平的基础值(0 h)均明显高于未妊娠组(P<0.01)。
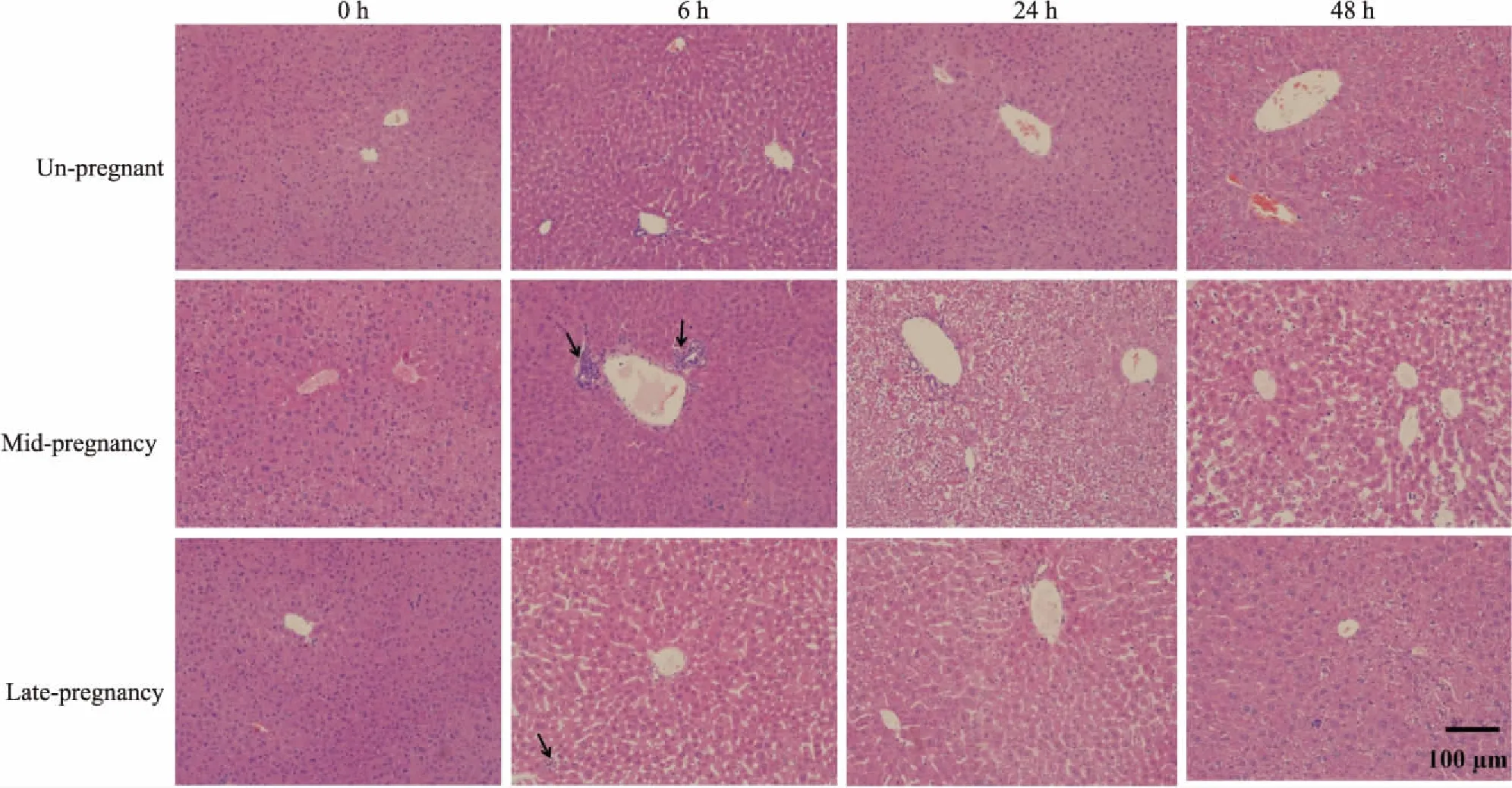
Fig 2 Liver histological evaluation of APAP-treated pregnant mice
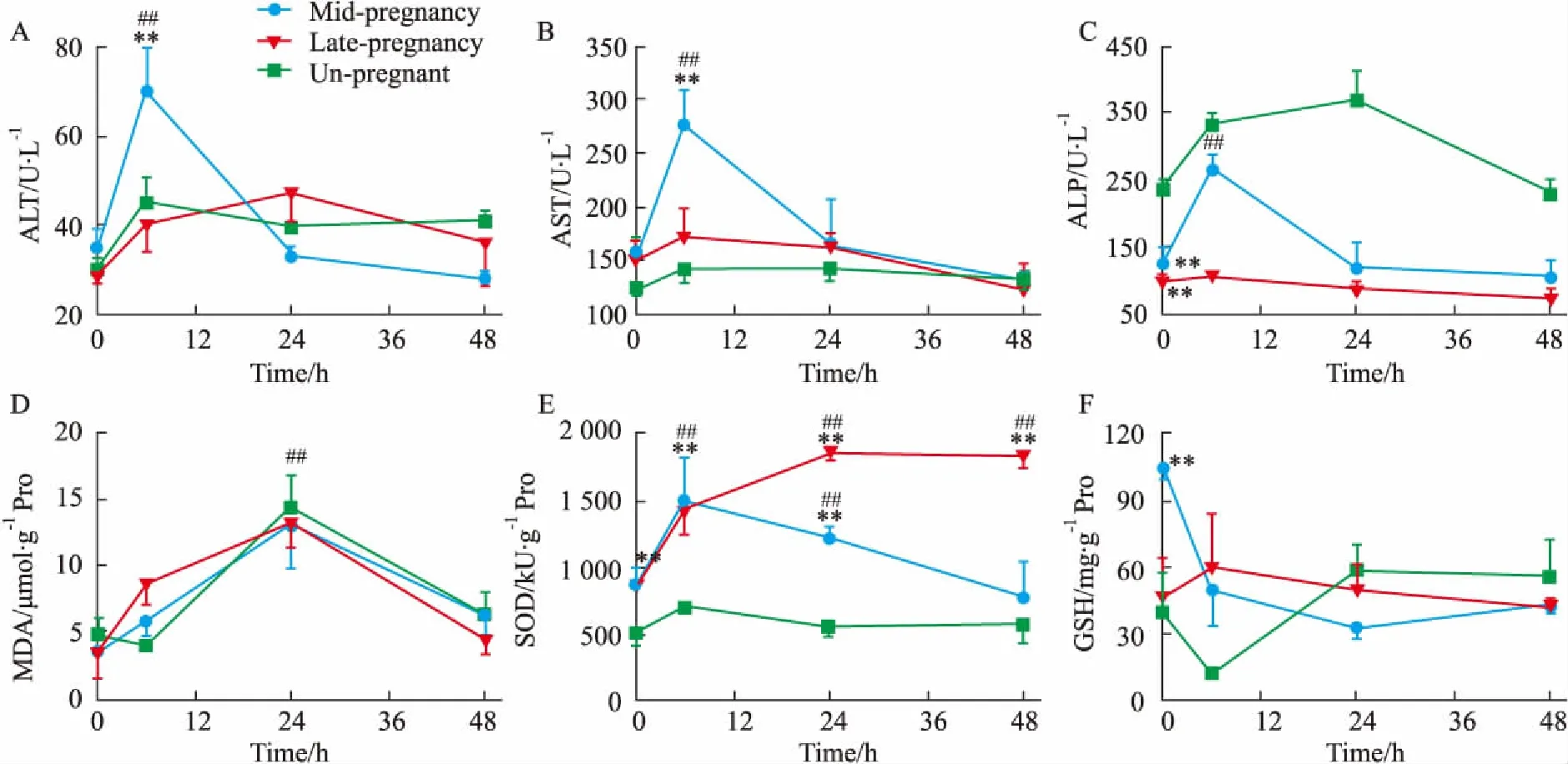
Fig 3 Effects of APAP on the serum activity of ALT (A), AST (B), ALP (C) andon liver MDA (D), SOD (E), GSH (F) contents in pregnant n=10)
##P<0.01vs0 h of mid-pregnancy group;**P<0.01vsun-pregnant group
2.4APAP对不同妊娠期小鼠肾脏组织病理学的影响如Fig 4所示, 当给予各组小鼠500 mg·kg-1APAP后,各组小鼠在0~48 h内,肾小球、肾小囊形态结构正常,肾小囊未见沉积物,肾小管未见冠心,上皮细胞未见肿胀变性。上述结果表明,500 mg·kg-1APAP对妊娠各时期小鼠肾脏组织病理无明显影响。
2.5APAP对不同妊娠期小鼠肾脏组织生化和氧化应激指标的影响如Fig 5所示, 当给予各组小鼠500 mg·kg-1APAP后,未妊娠组、妊娠中期组和晚期组小鼠的血清Cre和BUN水平在0~48 h内无明显波动。MDA和SOD水平变化:仅妊娠晚期组在6 h时出现了短暂升高,而后在12~48 h又降低恢复到正常水平;其余组在0~48 h内无明显变化。GSH水平变化:妊娠中期组在0~48 h内有持续降低现象,而其他组未见明显波动。
2.6不同妊娠期小鼠肝脏CYP450s活性的变化如Fig 6A所示,小鼠在妊娠中期(妊娠后10 d)的肝脏CYP1A2、2D6、3A4、2E1酶活性水平明显高于未妊娠小鼠(P<0.01),而上述代谢酶活性水平在妊娠晚期(妊娠后18 d),恢复到未妊娠时水平。
APAP的毒性物质基础为其活性代谢产物NAPQI,其稳定性较差,不能被直接检测,但其可被GSH捕获,生成NAPQI-GSH复合物,故研究中常用 NAPQI-GSH水平来反映NAPQI生成量。本研究也对给药后,各组肝脏中的NAPQI-GSH生成量进行了检测。如Fig 6B所示,给予APAP后,各组NAPQI-GSH水平在6 h时均有升高,但仅妊娠中期组存在明显差异(P<0.05),而在随后的48 h内,NAPQI-GSH在肝脏中水平急剧降低。
3 讨论
妊娠是非常复杂的生理过程,是妇女的一段特殊时期,该时期用药应尤为谨慎。肝脏作为人体最大的代谢器官,含有丰富的药物代谢酶系统,妊娠期激素水平变化影响着肝脏各种代谢或抗氧化酶的水平变化。临床和实验研究表明,妊娠期间CYP450s活性的变化可影响美托洛尔、咖啡因、罗红霉素等药物药代动力学的变化[3]。本研究也证实,妊娠中期肝脏CYP450s主要代谢酶的活性水平上调,这与之前的研究结果相一致[3, 14]。Ning等[15]研究表明,肝细胞核因子4α激活介导了妊娠期小鼠Cyp2d40的表达上调,而其他CYP450s表达上调是否也与该转录因子相关,还有待进一步研究。本研究所观察到的妊娠晚期小鼠肝脏CYP450s活性又趋于正常,这可能跟妊娠期间激素的周期性变化有关,而究竟是哪种激素还有待进一步研究。此外,本研究还发现,妊娠中期和晚期组小鼠血清SOD水平,中期组小鼠的GSH水平均明显高于未妊娠组。该结果提示,在妊娠时期机体自身抗氧化能力增强,可应对突发的自由基水平升高,由于SOD等抗氧化酶表达主要由Nrf2信号通路调控,故妊娠期间的激素水平是否会影响Nrf2信号通路的下游蛋白调控,也有待于进一步研究。
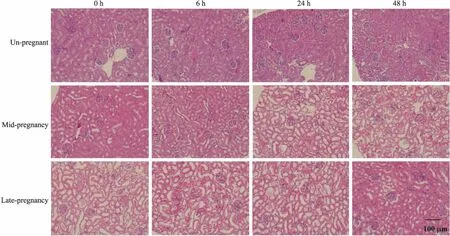
Fig 4 Kindy histological evaluation of APAP-treated pregnant mice
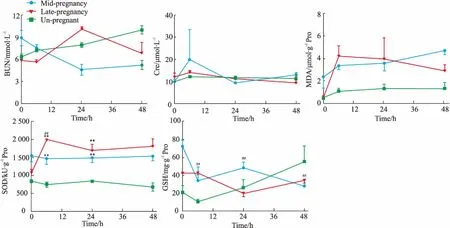
Fig 5 Effects of APAP on the activity ofBUN and Cre in serum, and on theactivity of SOD, the levels of GSHand MDA in kidney tissue of pregnant
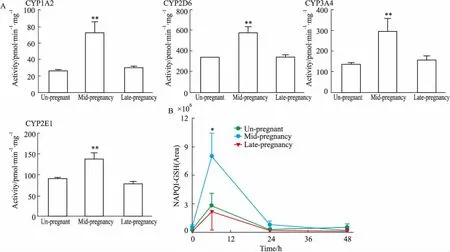
Fig 6 The CYP450s activity(A)and the contents of NAPQI-GSH(B)in liver of different pregnant mice
*P<0.05,**P<0.01vsun-pregnant mice
综上所述,本研究表明,500 mg·kg-1APAP可致妊娠中期小鼠产生急性轻微肝损伤,这可能是妊娠中期小鼠肝CYP450s活性升高,以及SOD活性、GSH水平上调共同调节的结果。本研究提示妊娠中期由于CYP450s活性上调,发生经CYP450s介导产生肝毒性的风险上升,临床用药应更关注该时期的用药方案。
(致谢:本实验在西南大学药学院中药药理学实验室完成,感谢给予实验指导、帮助的老师和同学。)