雾化吸入灭活草分枝杆菌对哮喘模型小鼠T-bet/GATA-3表达的影响
刘位位,孙起翔,张景鸿,杨 霞,李超乾
(广西医科大学第一附属医院 1.呼吸内科、2.急诊科,广西 南宁 530021;3.广西壮族自治区江滨医院呼吸科,广西 南宁 530021)
全球哮喘防治创议指出,支气管哮喘(哮喘)患者虽然在一些国家住院率和死亡率均有所下降,但是在许多国家患病率仍不断上升,哮喘仍然影响着全球的健康问题。目前,治疗支气管哮喘主要药物为糖皮质激素[1],但长期使用高剂量糖皮质激素治疗可能会影响身高、导致骨骼疏松[2],易形成激素依赖性,造成激素抵抗型哮喘。因此,针对哮喘的发病机制,寻找更为有效且能长期安全治疗哮喘的药物成为目前的研究热点。我们课题组前期研究发现,通过雾化吸入灭活草分枝杆菌治疗哮喘小鼠,可以减轻其气道炎症、降低气道高反应性,其作用可能与Toll样受体、调节Th1/Th2[3]和Th17/Treg[4]失衡有关,但其作用机制尚未完全明确,仍需进一步研究。
CD4+T细胞根据不同的细胞因子和功能,可以分为Th1和Th2细胞,哮喘表现为Th2优势应答。在诱导Th0细胞分化为Th1和Th2细胞时,转录因子T-bet和GATA-3起着重要作用。本研究主要通过用卵清蛋白(ovalbumin,OVA)制备支气管哮喘小鼠模型,用灭活草分枝杆菌进行干预,进一步研究草分枝杆菌对T-bet、GATA-3表达的影响。
1 材料与方法
1.1材料
1.1.1试剂 OVA、佛波酯(phorbol-myristate-actetate,PMA)、离子霉素(美国Sigma公司);氢氧化铝凝胶(美国Pierce公司);草分枝杆菌F.U.36注射液(成都金星健康药业有限公司);小鼠IL-4、IFN-γ ELISA试剂盒(武汉华美生物工程有限公司);TRIzol总RNA提取液(Invitrogen公司);逆转录试剂盒、SYBR Green核酸染料、PCR引物设计合成(TaKaRa公司);流式抗体APC-IFN-γ、PE-IL-4(美国eBioscience公司);流式抗体Percp-CD4、莫能霉素、固定/破膜液(美国BD公司)。
1.1.2仪器 酶标仪(美国Bio-Rad公司),超声雾化器WH-2000(广东粤华医疗器械厂),病理图像分析系统(德国Leica公司),Applied Biosystem 7500 RT-PCR仪(美国ABI公司),NanoDrop 2000超微量分光光度计(美国Thermo Scientific公司),5810R高速低温离心机(德国Eppendorf公司),FACS CantoⅡ型流式仪(美国BD公司),自制雾化吸入箱等。
1.2动物分组与模型建立24只SPF级健康♂Balb/c小鼠,6~8周龄,体质量(20±2)g,由广西医科大学动物实验中心提供,许可证号:SCXK桂2014-0002。根据随机分配原则,分为正常组、哮喘组、治疗组,每组8只。模型组和治疗组均于d 0、7、14,用25 μg OVA和1 mg 氢氧化铝(混于0.2 mL PBS中)腹腔注射,于d 21开始激发,将小鼠置于自制雾化箱中,用2% OVA PBS 10 mL雾化吸入,每次约30 min,连续7 d,治疗组于d 28用1 mL草分枝杆菌F.U.36注射液(溶于10 mL生理盐水)雾化吸入,连续5 d,正常组腹腔注射、激发和治疗均用等量生理盐水代替,哮喘组治疗用等量生理盐水代替。小鼠在末次激发24 h内处死,并取相关组织。用10%水合氯醛0.1 mL腹腔注射处死小鼠,符合动物伦理学标准。
1.3标本采集用10%水合氯醛麻醉小鼠后,行气管插管,用4℃ 0.5 mL PBS灌洗,缓慢注入肺中,回收支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),灌洗3次,回收率>85%,收集放入-80℃冰箱保存。打开胸腔,分离支气管肺组织,灌洗4%多聚甲醛使肺组织膨胀,取出左肺组织,浸润4%多聚甲醛固定,24 h后漂洗、乙醇梯度脱水,石蜡包埋,切片厚约4 μm,行HE和过碘酸-雪夫(periodic acid Schiff,PAS)染色。右下肺叶置于-80℃冰箱保存,用于real time-PCR检测。余右肺用于流式细胞术检测。
1.4肺部病理组织学检查取左肺组织,固定后,常规石蜡包埋、切片,行HE和 PAS染色,按照文献方法,光镜下观察肺部炎症情况。
1.5ELISA法检测BALF中IL-4、IFN-γ水平严格按照说明书提供的方法操作,终止反应后,用酶标仪检测450 nm光密度值(OD值),绘制标准曲线,根据标准曲线计算出细胞因子IL-4、IFN-γ浓度。
1.6实时荧光定量PCR测定T-bet、GATA-3mRNA表达TRIzol试剂提取肺组织总RNA,检测肺组织中总RNA浓度及A260/A280比值。按逆转录试剂盒操作说明将总RNA逆转录制备cDNA,放置于-20℃保存。用SYBR Green核酸染料进行real time-PCR,将GAPDH作为内参照。GAPDH:上游引物5′-TGTGTCCGTCGTGGATCTGA-3′,下游引物5′-TGCTGTTGAAGTCGCAGGAG-3′;T-bet:上游引物5′-GTTCAACCAGCACCAGACAGAG-3′,下游引物5′-TGGTCCACCAAGACCACATC-3′;GATA-3:上游引物5′-GGATGTAAGTCGAGGCCCAAG-3′,下游引物5′-ATTGCAAAGGTAGTGCCCGGTA-3′。反应条件:95℃ 30 s,95℃ 5 s,60℃ 34 s,40个循环。各样本均设3个复孔,基因表达的相对变化的倍数用2-ΔΔCT计算。
1.7制备肺组织单个核细胞悬液将小鼠剩余右肺剪碎,加入含有胶原酶Ⅳ(2.5 g·L-1)的RPMI 1640培养基2 mL,置于37℃恒温摇床消化约40 min,每隔15 min用巴氏吸管吹打混匀,将细胞悬液和未完全消化的肺组织团块通过200目滤网并研磨,1 500 r·min-1离心5 min,弃上清,加入红细胞裂解液避光孵育3 min,离心5 min,PBS洗涤3次,用含10%胎牛血清的RPMI 1640培养基重悬肺脏单个核细胞。
1.8流式细胞术检测Th1和Th2细胞用RPMI 1640培养基将肺脏的单个核细胞悬液浓度调整为1×109·L-1,每1 mL细胞悬液加入PMA(25 μg·L-1)、离子霉素(1 μg·L-1)和莫能霉素,于5% CO2、37℃条件下培养4~6 h后收集细胞,用PBS洗涤,离心弃上清,加入Percp抗CD4抗体,4℃避光孵育30 min后,用PBS洗涤,加入固定/破膜液4℃避光孵育20 min,用wash-buffer洗涤,加入PE抗IL-4抗体、APC抗IFN-γ,4℃避光孵育30 min,用PBS洗涤2次后,弃上清,用200 μL PBS重悬细胞,流式细胞仪检测,Flowjo 7.6软件分析数据。
2 结果
2.1肺组织病理学表现如Fig 1所示,肺HE染色及PAS染色显示,正常组小鼠支气管形态规整,上皮细胞无增生,管壁无明显增厚,肺泡间隔正常,支气管及血管周围无或少许炎性细胞浸润,PAS染色见气道上皮杯状细胞少或无,无黏液渗出;哮喘组可见支气管及血管周围有较多炎性细胞浸润,支气管管腔狭窄,管壁增厚。PAS染色可见有大量杯状细胞增生,黏液渗出较明显。治疗组与哮喘组相比,支气管及血管周围炎性细胞浸润明显降低。PAS染色见支气管管腔内杯状细胞及黏液渗出明显减少。
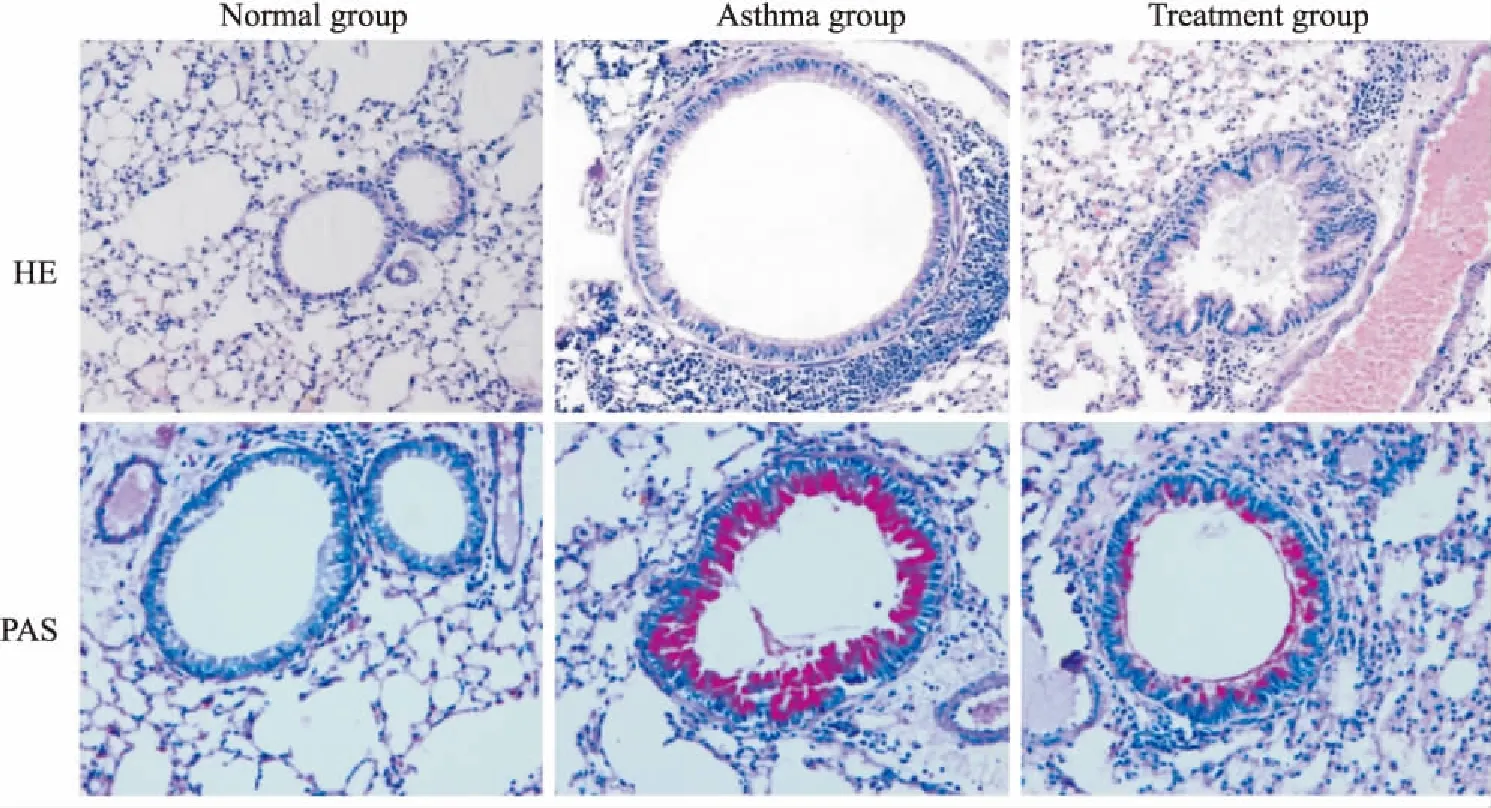
Fig 1 HE staining and PAS staining in lung tissues(×200)
2.2BALF中IL-4、IFN-γ的水平Fig 2的ELISA结果显示,与正常组相比,哮喘组BALF中IL-4水平明显升高,而IFN-γ水平明显降低;与模型组相比,治疗组BALF中IL-4水平明显降低,而IFN-γ水平升高,差异均有统计学意义(P<0.05)。
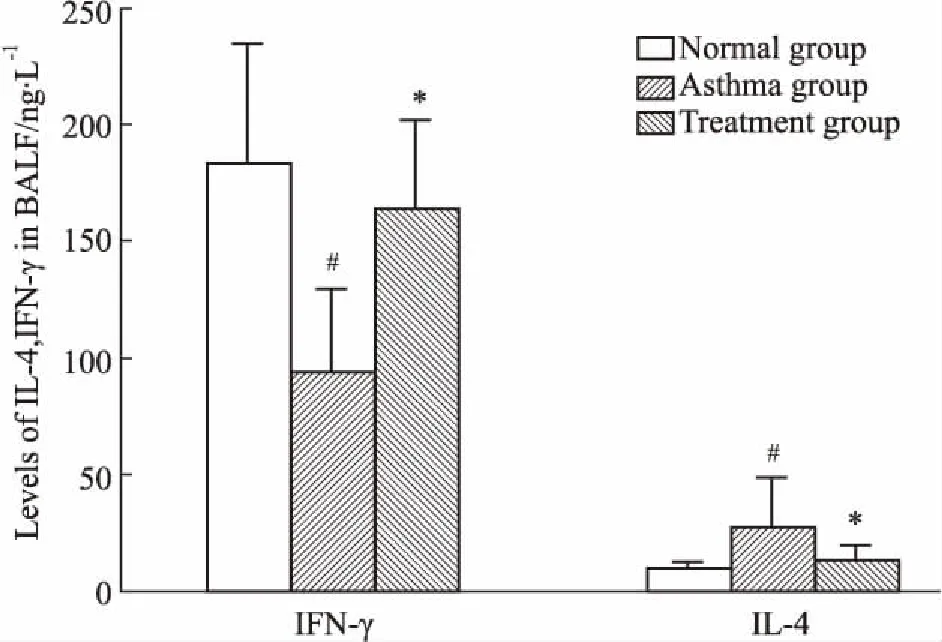
Fig 2 IL-4 and IFN-γ levels in )
#P<0.05vsnormal;*P<0.05vsasthma
2.3肺组织中T-bet、GATA-3mRNA表达如Fig 3所示,哮喘组中T-bet mRNA表达量明显低于正常组,治疗组T-bet mRNA表达量高于哮喘组,差异均有统计学意义(P<0.05);哮喘组中GATA-3 mRNA表达量明显高于正常组,治疗组GATA-3 mRNA表达量低于哮喘组,差异均有统计学意义(P<0.05)。说明雾化吸入灭活草分枝杆菌可以上调哮喘小鼠T-bet表达,同时抑制GATA-3的表达。
2.4肺组织中Th1、Th2细胞占CD4+T细胞百分比如Fig 4、5所示,与正常组相比,哮喘组肺组织中Th2细胞占CD4+T细胞比例升高,而Th1细胞所占比例下降;与模型组相比,治疗组肺组织中Th2细胞占CD4+T细胞比例下降,而Th1细胞所占比例升高,差异均有统计学意义(P<0.05)。提示雾化吸入灭活草分枝杆菌可以调节哮喘小鼠Th1/Th2失衡。
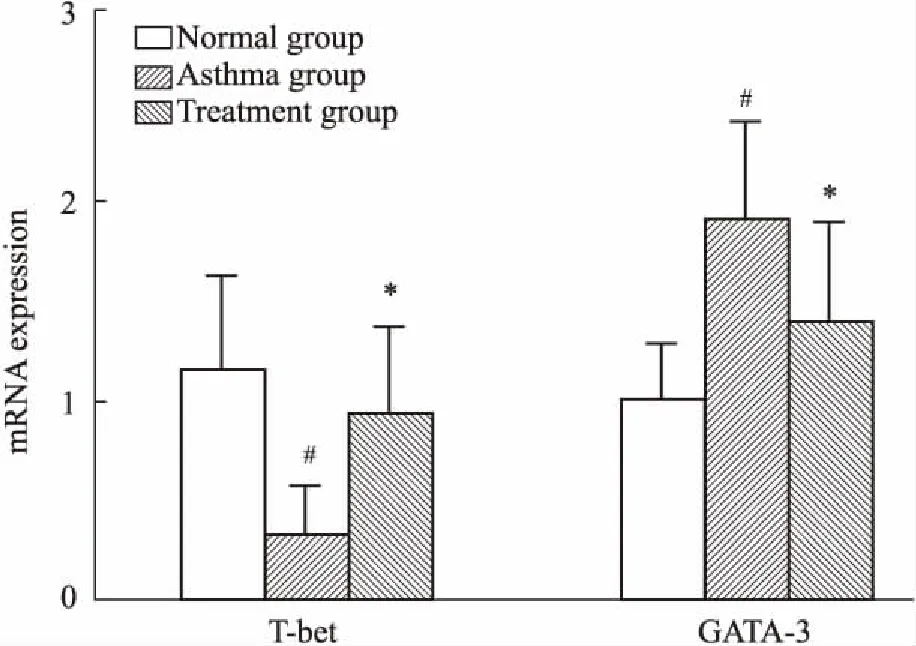
Fig 3 The T-bet, GATA-3 mRNA expression in lungtissues measured by real-time PCR
#P<0.05vsnormal;*P<0.05vsasthma
2.5肺组织中T-bet、GATA-3与Th1、Th2细胞的相关性分析肺组织T-bet mRNA和Th1细胞百分比呈明显正相关(r=0.70,P<0.01);GATA-3 mRNA和Th2细胞百分比呈明显正相关(r=0.76,P<0.01)。见Fig 6。
3 讨论
支气管哮喘仍然是最常见的慢性气道炎症疾病,对患者的生活有重大影响,主要特点是气道炎症、气道高反应性和气道重塑。支气管哮喘通常发生在普通人群中,儿童较为常见,环境因素,如病毒、过敏原和职业暴露都可以加重疾病的发生。目前广泛认可的发病机制为Th1/Th2失衡,呈Th2优势应答,Th2细胞主要产生IL-4、IL-5、IL-13,IL-4能够促进B细胞合成IgE,IL-5促进嗜酸性粒细胞的聚集,IL-13促进黏液分泌和加重气道高反应性。相反,IFN-γ可以促进Th1细胞介导的相关免疫反应。在本实验经OVA诱导的哮喘小鼠模型中,BALF中的IFN-γ降低,IL-4表达升高,病理切片发现气道炎症细胞浸润明显增加,杯状细胞增生,说明哮喘模型制备成功。
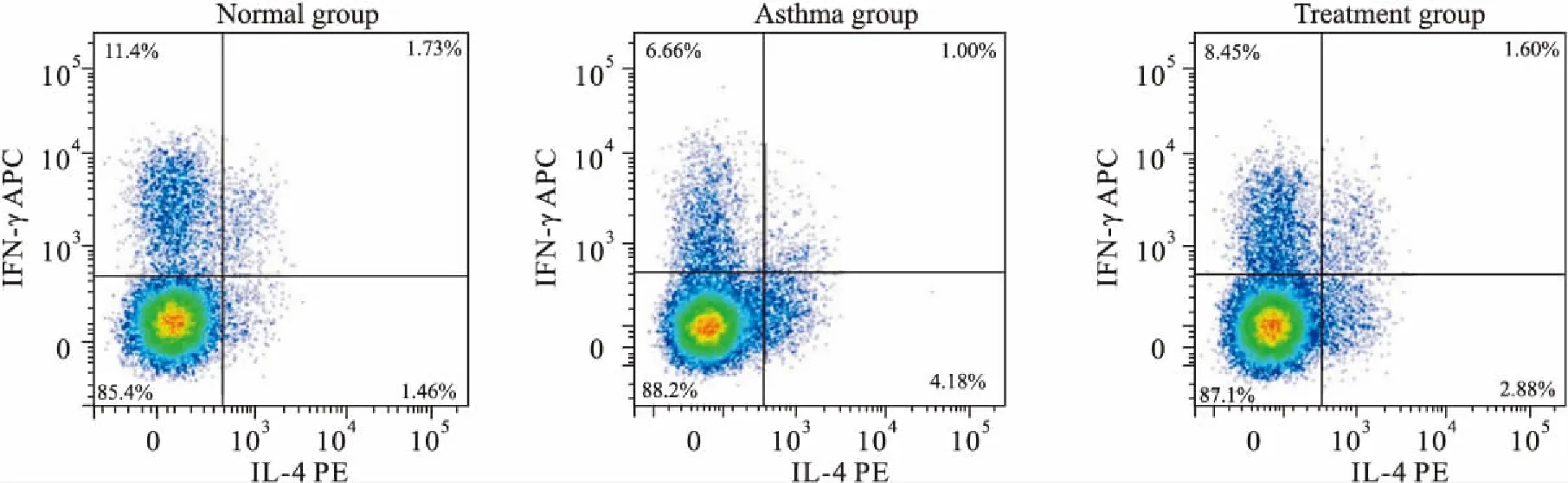
Fig 4 The representative flow cytometric dot plots of Th1 andTh2 cells in lung of normal group, asthma group and treatment group
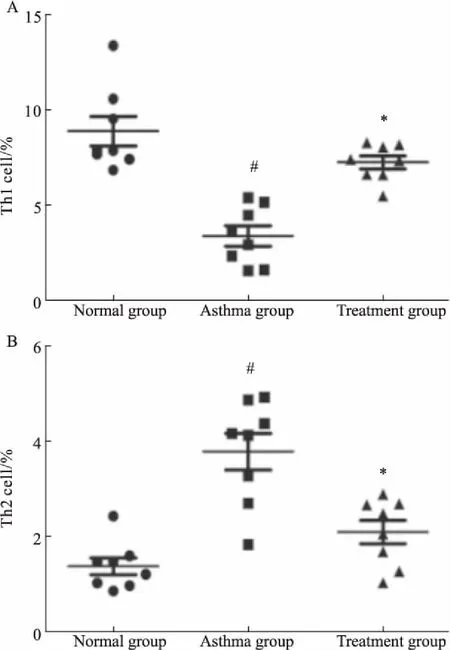
Fig 5 Comparison of percentages of Th1 and Th2 cellsin normal group, asthma group and treatment group
#P<0.05vsnormal;*P<0.05vsasthma
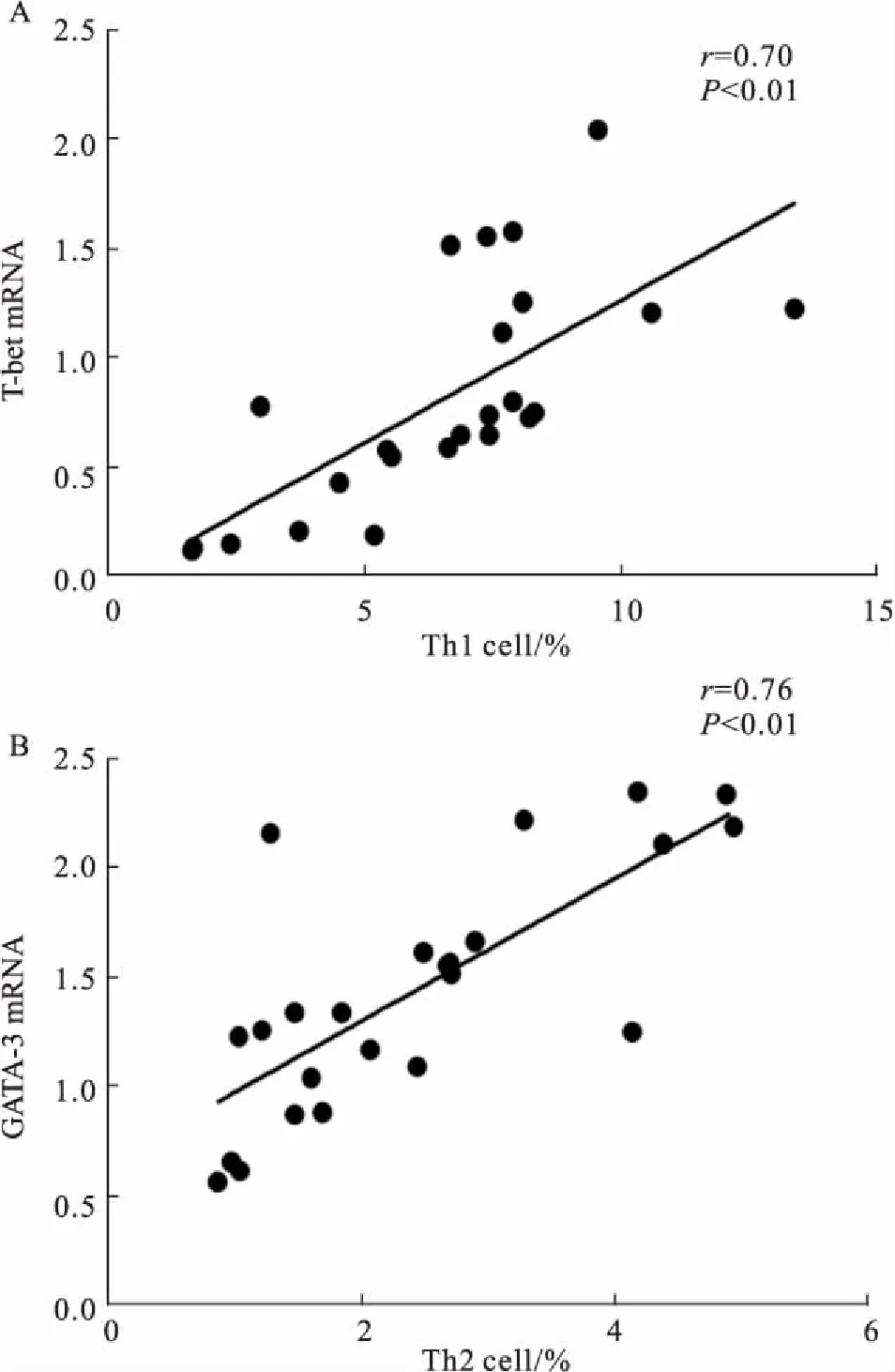
Fig 6 Correlation between T-betmRNA and Th1 cells, GATA-3 mRNA and Th2 cells
幼稚的T细胞通过转录因子T-bet和GATA-3作用,分化成Th1和Th2细胞。T-bet是T-box转录因子家族中的一员,T-bet通过诱导STAT1信号,在Th1分化过程中促进IFN-γ和IL-12Rβ2的表达。Finotto等[5]研究发现,在哮喘患者的气道中T-bet表达减少,同时在缺乏过敏原的暴露下,T-bet敲除小鼠出现与哮喘患者相似的表现,如气道炎症、气道高反应性。应用携带T-bet基因的重组腺相关病毒载体干预哮喘小鼠后,发现IL-4、IL-5降低,IFN-γ表达升高,有效减轻哮喘Th2细胞的优势表达[6]。有研究发现,T-bet在Th1细胞分化中的调节功能主要是通过对GATA-3负调节,而不是促进IFN-γ分泌。
GATA-3属于GATA转录因子家族中的一员,GATA-3通过诱导Th2细胞因子的产生,上调Th2细胞的分化,还能通过抑制T-bet的表达,抑制Th1细胞信号通路。已经证实在哮喘患者中,GATA-3的表达高于正常人[7],促进Th2细胞因子分泌导致气道高反应性。临床研究发现,哮喘患者淋巴细胞中IFN-γ和IL-4水平与T-bet/GATA-3比值相关,这可作为观察哮喘患者是否有免疫失衡的客观指标[8]。因此,改善T-bet/GATA-3比例失衡,对于治疗哮喘有重要作用[9-10]。本实验研究中,哮喘组与正常组相比T-bet表达降低,Th1细胞因子IFN-γ分泌减少,GATA-3表达升高,向Th2细胞偏移。
灭活草分枝杆菌是一种免疫调节剂,通过增加T细胞活性,促进Th细胞分泌B细胞分化因子和生长因子,使B细胞增殖、分化,形成特异性抗体[11];还可以激活固有免疫系统如Toll样受体[12],增强NK细胞、调节性T细胞[4]活性,调节机体的特异性细胞免疫反应。本课题先前的研究已经证实了雾化灭活草分枝杆菌可以减轻OVA诱导的哮喘小鼠气道炎症,通过减少IL-5、IL-13分泌,降低气道高反应性[13],增加IFN-γ和减少IL-4的分泌,逆转Th1/Th2失衡[3],并且对于有中度持续性哮喘的成人和4~12岁小孩,用雾化吸入灭活草分枝杆菌疗法是有效的[14-15],但是其作用机制尚未完全明确。本实验研究发现,经灭活草分枝杆菌治疗后,IFN-γ、T-bet表达水平和Th1/CD4+T细胞比例较哮喘组小鼠明显升高,而IL-4、GATA-3表达水平和Th2/CD4+T细胞比例明显下降,相关性分析发现T-bet与Th1细胞、GATA-3与Th2细胞存在正相关,且差异均有统计学意义。说明灭活草分枝杆菌上调T-bet表达,促进IFN-γ分泌,减少GATA-3表达抑制IL-4的分泌,促进细胞向Th1细胞分化,减轻了哮喘的气道炎症。本实验亦存在不足之处,未进行体外实验进一步阐述灭活草分枝杆菌对T-bet、GATA-3的作用机制。
总之,草分枝杆菌作为一种免疫调节剂,具有双向调节作用,上调T-bet表达促进IFN-γ分泌,抑制GATA-3表达而减少IL-4分泌。在动物和临床研究中,已经证实草分枝杆菌可以纠正哮喘机体的免疫失衡,但是需要进一步研究明确草分枝杆菌是通过何种信号通路影响哮喘的发生。
(致谢:本实验于广西医科大学医学科学实验中心完成,感谢实验室老师和同学的指导和帮助!)